Нарушения микроциркуляции занимают значимое место в формировании осложнений сахарного диабета (СД). По мнению ряда авторов, поражение сосудов конечного кровотока при СД может быть причиной не только ретино-, нефропатии, но и невропатии [1]. Состояние капиллярного кровообращения определяют резистивные микрососуды – артериолы и прекапилляры, стенки которых содержат гладкомышечные клетки. Последние обеспечивают изменения величины рабочего просвета сосудов и, следовательно, объема крови, поступающего в капилляры. На уровне микроциркуляторного русла возможны нарушения функции эндотелия, сосудистого тонуса, структуры сосудов, а также запустевание большой части сосудов. Изменения сосудистого тонуса при СД могут быть следствием развития диабетической автономной невропатии (АНП) [2]. В последние годы большой интерес вызывают отклонения в гемостазе и их связь с изменениями микроциркуляции у больных СД [3]. Таким образом, уточнение факторов, влияющих на дистальный кровоток у больных СД, имеет важное значение для профилактики прогрессирования поздних диабетических осложнений.
Цель исследования: оценка изменений кардиоваскулярной иннервации, гемостаза и уточнение их связи с нарушениями микроциркуляции у больных СД 2 типа (СД2).
Материал и методы
Обследованы 260 женщин с диагнозом СД2, проходивших лечение в эндокринологическом отделении ОКБ г. Твери. Средний возраст больных составил 54,0 (53–55) года, длительность диабета на момент обследования – 9,5 (8,6–10,5) лет. В 88,5% случаев СД2 у пациенток сопровождался артериальной гипертензией. При поступлении в стационар больные имели установленные осложнения СД: у 92,6% из них диагностировалась полиневропатия, у 55% – имели место макроангиопатии (в т.ч. ИБС – у 27,8%, хроническая ишемия головного мозга – у 68,8% и периферическая ангиопатия – у 16,1% обследованных). Микроангиопатии определены в 81,1% случаев, при этом диабетическая ретинопатия (1-й и 2-й стадий) была диагностирована у 81,1% больных, причем в 25% случаев она сочеталась с нефропатией (стадия микроальбуминурии). Контрольную группу (добровольцы) составили 30 женщин в возрасте от 46 лет до 61 года с нормальными уровнями артериального давления (АД) и глюкозы крови, без тяжелых соматических и вне обострения хронических заболеваний.
Все исследования проведены в первые дни госпитализации и включали помимо клинико-лабораторного обследования углубленную диагностику, направленную на выявление кардиоваскулярной АНП (5 кардиоваскулярных тестов по Ewing) у 180 больных. Состояние микроциркуляции изучали с помощью ультразвуковой высокочастотной допплерографии артериолярного кровотока (АК) в сосудах ногтевого валика с помощью аппарата Мини Макс Доплер М (260 пациентов), при этом определяли линейные скоростные показатели (систолическую – Vs, диастолическую –Vd, среднюю – Vm, см/с) в состоянии покоя (базальные значения) и на фоне ишемической пробы (реактивные). Оценка агрегационной функции тромбоцитов проведена 80 больным с помощью двухканального лазерного агрегометра LA-230 «НПФ Биола». Изучали параметры агрегации тромбоцитов при спонтанной и стимулированной аденозиндифосфатом и ристомицином агрегации с использованием кривой среднего размера агрегатов и светопропускания. Первая методика (по кривой среднего размера) наиболее современная и точная, поэтому окончательное заключение о состоянии агрегационной функции тромбоцитов у пациентов и здоровых лиц проведено по ней. При этом изучались качественная характеристика тромбоцитов (степень агрегации максимальная и за 5 минут: Lm и L за 5 мин) и их функция (скорость образования агрегатов: Vm).
Статистическая обработка полученных результатов проведена с использованием пакета прикладных программ «STATISTICA 6.1» (Stat-Soft, 2001). Для учитываемых в настоящем исследовании количественных признаков рассчитывались средние значения (М) и их 95% доверительные интервалы (95% ДИ). Проведена проверка параметров на нормальность распределения. Статистическая значимость межгрупповых различий при нормальном распределении признака оценивалась по t-критерию Стьюдента для несвязанных вариант, в противном случае – по критерию Манна–Уитни. Взаимосвязь между количественными признаками с нормальным распределением определена с помощью корреляционного анализа Пирсена. Для выявления взаимосвязей между качественными признаками использован анализ распределения с помощью критерия χ2 или точного критерия Фишера. При вероятности ошибки первого рода, не превышающей 5%, анализируемая связь признавалась статистически значимой.
Результаты исследования
В результате проведенного обследования установлено, что большинство женщин с СД2 страдали ожирением или избыточной массой тела (95% случаев). Индекс массы тела (ИМТ) в среднем составил у них 33,1 (32,3–33,85) кг/м2, при этом преобладали больные с ожирением I (65%) и II (15%) степеней. Объем талии в среднем составлял 100,9 (99,0–102,7) см, а соотношение объемов талии и бедер – 1,02 (1,00–1,03). Это указывало на абдоминальный тип ожирения, диагностированный у 85% женщин и сопровождавшийся гипертриглицеридемией у 80% обследованных (уровень триглицеридов – 2,25 [2,14–2,36] ммоль/л).
Средний уровень систолического АД у больных составил 130,3 (128,2–132,5) мм рт.ст., диастолического – 75,3 (73,0–76,5) мм рт. ст., что свидетельствовало о наличии корригированной до нормотензии артериальной гипертензии в большинстве случаев (86%). Нарушения углеводного обмена соответствовали декомпенсации СД. У большинства (92%) больных целевые значения гликемии на момент обследования не были достигнуты, что подтверждали показатели гликемии натощак (9,0 [8,7–9,4] ммоль/л), гликемии после еды (10,9 [10,3–11,4] ммоль/л), гликированного гемоглобина (HbA1c – 9,1 [8,8–9,4] %) и гиперхолестеринемии (5,6 [5,5–5,8] ммоль/л).
По результатам 5 стандартных тестов Ewing, кардиоваскулярная АНП была зафиксирована у 113 из 180 больных (в 62,8% случаев).
Наихудшие результаты пациенты демонстрировали в тестах, указывающих на патологию парасимпатического отдела вегетативной нервной системы: 30:15 (отношение 15-го RR-интервала к 30-му с момента начала вставания при ортостатической пробе) и тесте на изменение частоты сердечных сокращений при медленном глубоком дыхании (29 и 25% соответственно). Реже всего патологические результаты были получены в ортостатической пробе и в тесте с изометрическим сокращением (12 и 8% соответственно).
Степень тяжести кардиоваскулярной АНП оценивалась по классификации Ewing [6].
В зависимости от полученных результатов обследованные женщины с СД2 были разделены на 2 группы: в основную вошли 108 больных типичной кардиоваскулярной АНП (возраст – 54,0 [53,0–55,0] года; длительность СД – 10,5 [9,3–11,7] лет; ИМТ – 33,9 [32,9–34,9] кг/м2; HbA1c – 9,5 (9,1–9,6)%; общий холестерин – 5,6 [5,3–5,8] ммоль/л); в группу сравнения – 67 больных без АНП (соответственно 54 [53,0–55,0] года; 7,9 [6,4–9,4] года; 31,7 [30,6–32,8] кг/м2; 8,4 [8,0–8,8]%; 5,7 [5,5–5,9] ммоль/л). Больные АНП имели большие длительность заболевания (p<0,001), ИМТ (p<0,005), уровень HbA1c (р<0005). В зависимости от выраженности нарушений со стороны вегетативной нервной системы в группе больных кардиоваскулярной АНП были выделены подгруппы: 1-я начальных поражений (ПГ1) – 52 пациентки (48,1%), 2-я – несомненных поражений (ПГ2) – 34 (31,5%) и 3-я – грубых поражений (ПГ3) – 22 (20,4%). Больные разных подгрупп не различались по возрасту и ИМТ. Однако длительность СД была наибольшей у больных с грубой патологией автономной нервной системы (ПГ3) по сравнению группой без АНП (ПГ4; р<0,05). По данным оценки HbA1c, худшие показатели были отмечены в ПГ2 и ПГ3 (p1-3<0,01, p2-4<0,01, p3-4<0,01). Также более высокое значение общего холестерина было выявлено в ПГ3, чем в ПГ1 (p1-3<0,05).
Пять больных с атипичной формой кардиоваскулярной АНП были исключены из дальнейшего исследования.
При изучении состояния микроциркуляции у больных СД2 были отмечены сниженные скорости АК, особенно систолической (Vs – 7,9±3,41 см/с, Vm – 4,9±2,33 см/с, Vd – 2,9±1,51 см/с) по сравнению с группой здоровых: Vs – 9,1±1,2 см/с, p<0,05; Vm – 4,8±1,4 см/с, p>0,05; Vd – 2,6±1,0 см/с, p>0,05. Низкие значения линейных скоростей АК, особенно систолической, отмечены и в ранее проведенных исследованиях [4, 5].
Результаты пробы с реактивной гиперемией показали у большинства обследованных (в 73% случаев) недостаточное повышение скорости кровотока в ответ на ишемию.
Так, на 2-й минуте пробы выявлен отрицательный прирост скоростных показателей, который у пациенток с нарушенной реактивностью составил в среднем -16% Vs, -18% Vm и -20% Vd, против 40% Vs (р<0,05), 30% Vm (р<0,05) и 28% Vd (р<0,05) у больных с нормальной реактивностью.
Установлено, что из числа анализируемых показателей на скорость кровотока оказывали влияние ИМТ, уровни HbA1c и общего холестерина.
Линейные скоростные характеристики АК в покое у пациенток с ИМТ до 25 кг/м2 составили: Vs – 6,1±3,20 см/с, Vm – 3,13±1,20 см/с, Vd – 2,13±1,47 см/с; у пациенток с ИМТ более 25 кг/м2 эти показатели были выше: Vs – 9,1±4,91 см/с (р<0,05), Vm – 5,8±1,01 см/с (р<0,05), Vd – 3,17±1,7 см/с (р>0,05).
У больных, имевших уровень HbAlс более 7,5%, значения линейных скоростных параметров были: Vs – 6,3±4,10 см/с, Vm –3,4±2,98 см/с и Vd –1,8±1,98 см/с, у больных с HbAlс менее 7,5% они составляли: Vs – 9,9±4,9см/с (р<0,05), Vm – 5,8± 2,70 см/с (р>0,05) и Vd – 3,7±1,77 см/с (р <0,05). Уровень холестеринемии также оказывал влияние на АК (в основном на систолическую скорость) у больных СД2.
Так, при холестеринемии более 4,5 ммоль/л значения линейных скоростных характеристик составили: Vs – 6,5±4,94 см/с, Vm – 3,9±2,03 см/с, Vd – 2,13±2,04 см/с, а при холестеринемии до 4,5 ммоль/л эти показатели были выше (соответственно 9,5±4,48 см/с, р<0,05; 5,4±2,16, р>0,05; 3,64±2,27, р>0,05).
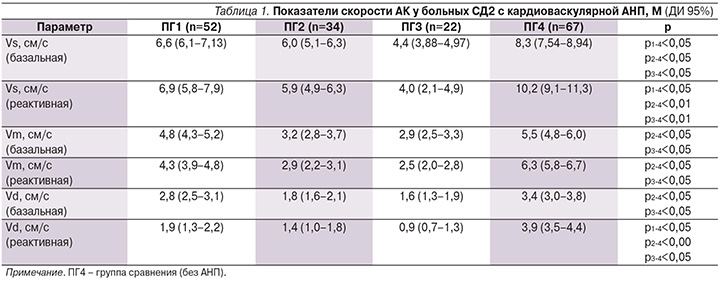
Далее более подробно была проанализирована взаимосвязь между поражением автономного звена нервной системы и АК. У пациенток с разными результатами теста Ewing были обнаружены отличия в скоростных показателях АК. Это касалось как базальных, так и реактивных скоростей (на фоне ишемической пробы). При этом скоростные показатели изменялись по мере утяжеления АНП. Как они менялись, можно видеть в табл. 1, где приводятся результаты скоростных показателей больных с разной степенью тяжести АНП. В подгруппах больных с АНП имелось снижение значений базальных скоростей АК относительно группы сравнения (ПГ4). Худшие результаты продемонстрировали пациенты из ПГ2 и ПГ3. Более низкие линейные скорости АК могут свидетельствовать о снижении тонуса артериол в группе пациентов с выраженными нарушениями вегетативной регуляции. Для пациентов с кардиоваскулярной АНП было характерно не только уменьшение базальных скоростных показателей, но и низкие скорости АК фоне ишемической пробы.
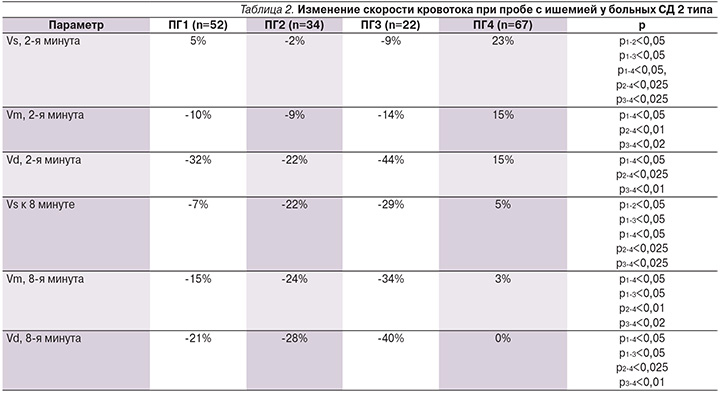
У пациенток с диабетической кардиоваскулярной АНП результаты пробы с реактивной гиперемией показали недостаточное повышение скорости кровотока в ответ на ишемию в 93,8% случаев, тогда как в группе сравнения недостаточная реактивность сосудов была выявлена в 37,3% случаев (χ2=62,03; p<0,001). Так, прирост скоростных показателей в целом у больных АНП составил на 2-й минуте пробы в среднем: Vs – (-1%), Vm – (-11%) и Vd – (-30%), против Vs – 23%, Vm – 15% и Vd – 15% в группе сравнения (все p<0,05). Следует отметить, что у большинства больных АНП был отрицательный прирост скоростей АК относительно группы сравнения (табл. 2). Наиболее выраженную недостаточность реактивности сосудов демонстрировали пациентки из ПГ2 и ПГ3. В ПГ1 эти изменения также присутствовали, но в меньшей степени. Кроме того, мы проанализировали еще один показатель – редукцию скорости кровотока к 8-й минуте окклюзионной пробы. У 82% больных АНП обнаружено стойкое снижение скорости кровотока после ишемии, в то время как у большинства больных без нарушений кардиоваскулярной иннервации (92%) к 8-й минуте скорость кровотока в большинстве случаев восстанавливалась полностью (χ2=10,8; p<0,01).
При расшифровке агрегатограмм со спонтанной агрегацией тромбоцитов по кривой среднего размера агрегатов у здоровых добровольцев было получено значение Lm 1,49 (1,23–1,58) от.ед. У женщин с СД2 по сравнению со здоровыми были выявлены следующие результаты: значения Lm ≤1,23 от.ед. имели 50 пациенток (62,5%), что свидетельствовало о снижении агрегации; Lm ≥1,58 от.ед. – 21 (26,3%) – повышение агрегации тромбоцитов; Lm от 1,24 до 1,57 от.ед. – 9 (11,2%). При оценке по кривой светопропускания среди этих 9 больных в 6 случаях встречалась гипоагрегация, в 3 – гиперагрегация тромбоцитов. В результате у 56 (70%) больных СД2 была диагностирована гипоагрегация, у 24 (30%) – гиперагрегация тромбоцитов.
У больных СД2 с гипоагрегацией средний возраст составил 54,0 (53,0–55,0) года; стаж СД – 9,8 (8,5–11,2) года; уровень HbA1c – 9,4 (9,1–9,7)%, уровень общего холестерина – 6,4 (6,1–6,8) ммоль/л. У больных с гиперагрегацией те же показатели были соответственно: 55,0 (52,0–58,0) лет; 10,1 (8,15–12,1) года; 7,9 (7,5–7,8)% (p<0,001); 5,1 (4,9–5,1) ммоль/л (p<0,001). Группы были сопоставимыми по возрасту, длительности заболевания, но отличались по показателям углеводного и липидного обменов.
Эти данные подтвердил и проведенный корреляционный анализ. Показатель Lm при спонтанной агрегации тромбоцитов по кривой среднего размера имел обратную высокую взаимосвязь с HbA1c (Rxy=-0,91; p<0,05) и уровнем холестерина (Rxy=-0,86; p<0,05). Другой показатель (L от.ед. на 5-й минуте) имел аналогичную, но более слабую взаимосвязь: соответственно: Rxy=-0,58 (p<0,05) и Rxy=-0,50 (p<0,05).
При изучении показателя Vm по кривой среднего размера агрегатов была также отмечена связь агрегации с HbA1c (Rxy=-0,46; p<0,05) и уровнем холестерина (Rxy=-0,37; p<0,05).
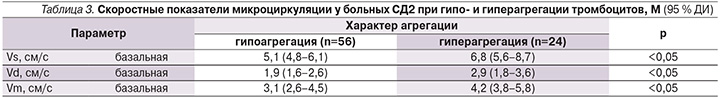
В табл. 3 приведены результаты определения дистального кровотока у больных СД2 с разной агрегацией тромбоцитов. У пациенток с гипоагрегацией скоростные показатели микроциркуляции были снижены по сравнению с группой больных гиперагрегацией (Vs – в 1,3 раза, Vm – в 1,5 раза и Vd – в 1,4 раза; все параметры p<0,05).
Корреляционный анализ выявил взаимосвязь между агрегацией тромбоцитов и дистальным кровотоком.
У больных СД2 параметры спонтанной агрегации тромбоцитов по кривой среднего размера агрегатов были взаимосвязаны с диастолической скоростью (Vd): для Lm – Rxy=0,43 (p<0,05), для Vm – Rxy=0,31 (p<0,05), для L от.ед. на 5-й минуте – Rxy=0,23 (p<0,05). Систолическая скорость коррелировала только с L от.ед. на 5-й минуте – Rxy=0,22 (p<0,05).
Более высокие значения всех скоростных показателей АК у этих больных при гиперагрегации, возможно, связаны с повышением венозного давления в сосудах микроциркуляции и с его снижением при гипоагрегации.
При проведении пробы с гиперемией у пациенток с гиперагрегацией отмечена тенденция к нарастанию систолической скорости по сравнению с больными гипоагрегацией. На 2-й минуте у пациенток с гиперагрегацией прирост составил +5,7 против -3,5% (р<0,05) при гипоагрегации.
К 8-й минуте исследования у больных с гиперагрегацией также имелся прирост систолической скорости на 2,9%, тогда при гипоагрегации фиксировалась редукция кровотока на 27,9% (p<0,05).
Таким образом, у женщин, длительно болеющих СД2, диагностируется снижение линейных скоростных показателей АК и нарушение реактивности сосудов, что может быть обусловлено наличием кардиоваскулярной АНП и нарушениями в системе гемостаза в сторону гипоагрегации, усиливающимися на фоне выраженной декомпенсации диабета.
Выводы
- Кардиоваскулярная АНП у женщин, больных СД2 более 9 лет, наблюдается в 63% случаев с преобладанием начальной стадии поражения (у 48% больных) и в основном с дисфункцией парасимпатического отдела вегетативной нервной системы.
- У 2/3 больных СД2 в тромбоцитарном звене гемостаза отмечается смещение в сторону гипоагрегации, которая чаще сопровождает более выраженную декомпенсацию СД, проявляющуюся более выраженными нарушениями показателей углеводного и липидного обменов.
- Скорость систолического АК у женщин, больных СД2 снижена на 20% по сравнению со здоровыми, причем в 73% случаев наблюдается нарушение реактивности сосудов, а выявленные изменения в дистальном кровотоке усиливаются на фоне выраженной декомпенсации СД и гиперхолестеринемии.
- Скорость АК у пациенток с кардиоваскулярной формой АНП до 2 раз ниже, чем у больных без вегетативной дисфункции, и снижается по мере утяжеления АНП.
- У женщин с СД2 более выраженное снижение всех скоростных показателей (в 1,3–1,5 раза) и отсутствие их прироста при ишемической пробе наблюдается при гипоагрегации тромбоцитов.
- Наибольшее влияние кардиоваскулярная АНП и гипоагрегация тромбоцитов оказывают на реактивность сосудов. При пробе с ишемией у больных с выраженными нарушениями автономной регуляции ритма сердца и гипоагрегацией наблюдается отсутствие пикового прироста и стойкое снижение скорости АК после ишемии.



