Сахарный диабет 2 типа (СД2) является хроническим заболеванием, которое характеризуется неуклонным снижением функции β-клеток поджелудочной железы и прогрессирующим дефицитом инсулина. Поэтому хотя многим пациентам вначале удается контролировать уровень гликемии с помощью диеты и приема пероральных сахароснижающих препаратов (ПССП), в конечном счете, большинству требуется инсулинотерапия (ИТ).
Существует три вида старта ИТ – базальный, двухфазный (или предварительно смешанный) и прандиальный инсулин (последний редко используется в России), которые могут быть использованы в зависимости от образа жизни и питания пациента, показателей глюкозы крови натощак и после еды.
В начале терапии все три режима позволяют пациентам достигать целевых параметров гликемии, но из-за прогрессивного характера СД2 в конечном счете для поддержания целевого уровня гликированного гемоглобина (HbA1c) необходимо использование как базального, так и прандиального инсулина.
Согласно современным рекомендациям [1], любой пациент с СД2 и неудовлетворительным контролем уровня HbA1c на проводимой в течение 3–6 месяцев сахароснижающей терапии ПССП или базальным инсулином (±ПССП) нуждается в пересмотре и интенсификации проводимого лечения.
Базис-болюсный режим ИТ является наиболее физиологическим и обеспечивает оптимальный уровень инсулина в течение 24 часов (и базальный, и прандиальный). Но вместе с тем требует проведения строгого и частого самоконтроля уровня гликемии, на основании которого пациент должен уметь самостоятельно корректировать дозу базального и прандиального инсулинов. К сожалению, многие пациенты опасаются интенсификации сахароснижающей терапии. Кроме того, пациенты, получающие базис-болюсную ИТ, должны иметь сильную мотивацию, чтобы тщательно ежедневно выполнять назначенный режим ИТ.
В свою очередь нерациональная терапия (выбор неоптимального режима и/или дозы сахароснижающих препаратов) поддерживает длительную гипергликемию и может способствовать более раннему развитию и более быстрому прогрессированию микро- и макрососудистых осложнений.
Готовые смеси аналогов инсулина являются более простой и удобной альтернативой интенсфицированной ИТ у пациентов с СД2, поскольку дают возможность уменьшить число ежедневных инъекций инсулина по сравнению с базис-болюсной ИТ. Они обеспечивают необходимый и базальный, и постпрандиальный уровень инсулина в крови. Многочисленные исследования показывают, что двухфазные аналоги инсулина обеспечивают лучший постпрандиальный гликемический контроль и как следствие – более значимое снижение уровня HbA1c, позволяя большему числу больных достигать целевого HbA1c (<7% или ≤7%), чем только базальный инсулин [2, 3]. Согласно мета-анализу, двухфазный инсулин обеспечивает более выраженное снижение уровня HbA1c, но при этом не увеличивает риска гипогликемии (ночной и тяжелой) по сравнению с базальным инсулином [4]. Эти результаты согласуются с данными систематического обзора [5].
Оптимальный двухфазный инсулин должен имитировать нормальную физиологическую секрецию инсулина в ответ на прием пищи и в то же время обеспечивать стабильный уровень базального инсулина в течение 24 часов. Большинство двухфазных инсулинов не в полной мере отвечает этим критериям вследствие более длительного сахароснижающего эффекта болюсного компонента смеси, чем это необходимо для контроля уровня гликемии после приема пищи, тогда как базальный компонент комбинированных препаратов инсулина демонстрирует меньшую продолжительность сахароснижающего эффекта по сравнению с базальными аналогами инсулина. Кроме того, протаминированные аналоги инсулина в составе премикс-препаратов инсулина имеют достаточно выраженную фармакологическую вариабельность, с чем связано сохранение возможного риска гипогликемии, особенно при инициации и интенсификации ИТ у пациентов с СД. К дополнительным недостаткам относятся фиксированное соотношение базального и прандиального компонентов смесей и необходимость введения строго в зависимости от приема пищи. Поэтому данный режим ИТ подходит пациентам с СД2 с постоянным и предсказуемым режимом питания и физической активности, а также количеством потребляемых при еде углеводов.
Физико-химическая несовместимость и возможность взаимного изменения фармакокинетического/фармакодинамического профилей широко используемых аналогов базального инсулина (детемира и гларгина) и прандиальных аналогов инсулина делают невозможным их комбинирование в одном растворе [6].
Разработка инсулина деглудек (Дег) – первого базального инсулин сверхдлительного (>42 часов) действия с периодом полужизни около 25 часов, стабильной структурой молекулы и ровным стабильным профилем сахароснижающего эффекта в равновесном состоянии [7], открыла новые возможности для разработки новых комбинированных препаратов на основе инсулина. Важно, что Дег обладает наименьшей среди доступных для клинического применения базальных инсулинов вариабельностью фармакологического профиля [8], благодаря чему его применение позволяет снизить риск гипогликемии (особенно ночной, тяжелой и ночной тяжелой) у пациентов с СД2 [9], а также предоставляет возможность гибкого изменения времени между очередными введениями (в рекомендуемом диапазоне от 8 до 40 часов) без неблагоприятных последствий в отношении гликемического контроля по сравнению с инсулином гларгин 100 ЕД/мл [10].
Единственная фиксированная растворимая комбинация аналога человеческого инсулина сверхдлительного действия Дег (70%) с аналогом инсулина сверхбыстрого действия аспарт (Асп, 30%) в одной инъекции – препарат Райзодег (Ново Нордиск, Дания), который при введении 1 раз в сутки обеспечивает покрытие потребности как в базальном, так и в прандиальном инсулине и позволяет успешно контролировать уровень гликемии в течение всех суток [11]. В равновесном состоянии инсулин деглудек/аспарт (Дег/Асп) оказывает отдельное базальное и постпрандиальное сахароснижающее действие с пиком действия, соответствующим Асп, и длительным (24 часа и более), плоским и стабильным профилем действия Дег [12]. Отсутствие суммирования эффекта при введении Дег с интервалом между инъекциями ≥8 часов, а также сверхкороткая продолжительность действия Асп (до 4 часов) позволяет при необходимости использовать Дег/Асп 2 раза в сутки перед любым приемом пищи (при условии, что интервал между очередными инъекциями/приемами пищи >4 часов) без повышения риска гипогликемии.
В клинических исследованиях при СД2 у взрослых (старше 18 лет) было показано, что независимо от предыдущего опыта лечения инсулином терапия инсулином Дег/Асп 2 раза в сутки по эффективности контроля гликемии (HbA1c) не уступает базальному инсулину гларгин, двухфазному инсулину Асп (ДИАсп 30) и даже базис-болюсной терапии аналогами инсулина [13–16], но при этом реже вызывает ночную и тяжелую гипогликемию, чем ДИАсп 30 или базис-болюсного режима [13, 15]. Анализ объединенных данных двух исследований 3-й фазы у пациентов с СД2, ранее получавших инсулин, подтвердил преимущества комбинированного инсулина Дег/Асп по сравнению с ДИАсп 30 в отношении контроля гликемии натощак и риска гипогликемии [17].
Целью данного анализа была оценка эффективности терапии с использованием комбинированного инсулина Дег/Асп пациентами с СД2, не достигшими целевых значений гликемии на предшествовавшей ИТ, в условиях повседневной клинической практики.

Материал и методы
Проанализированы данные 10 пациентов с СД2 (6 мужчин, 4 женщины), средний возраст составил 50 (52–60) лет; средняя длительность СД – 8 (6–10) лет, с декомпенсированным углеводным обменом: на фоне предшествовавшей ИТ средний уровень НbА1с – 10,3 (9–11)%. 50% пациентов получали базальный инсулин в комбинации с ПССП – метформин в средней дозе 2000 (2000–2500) мг/сут), и 50% – базис-болюсную терапию. Средняя длительность ИТ составила 2 (1–4) года; средняя суточная доза инсулина – 38 (34–77) ЕД/сут. До назначения инсулина Дег/Асп 80% пациентов в качестве базального инсулина получали инсулин гларгин. Все пациенты имели признаки поздних осложнений диабета (диабетическую полиневропатию – 100%, диабетическую ретинопатию – 41,7%, хроническую болезнь почек – 29,2%). Большинство (70,8%) пациентов также имели сопутствующее ожирение: средняя масса тела – 101 (100–103) кг, индекс массы тела (ИМТ) – 32 (30–34) кг/м2 и сердечно-сосудистые заболевания (91,2% – артериальную гипертензию, 16,7% – ишемическую болезнь сердца, 8,3% – преходящие нарушения мозгового кровообращения).
Все пациенты были переведены на инсулин Дег/Асп, средняя начальная доза составила 38 (34–77) ЕД/сут. Титрация дозы проводилась в соответствии с рекомендованным в инструкции алгоритмом.
Анализировали динамику клинико-лабораторных показателей (уровни глюкозы плазмы натощак – ГПН, постпрандиальной гликемии – ППГ, С-пептида). Кроме того, для оценки вариабельности гликемии в течение суток всем пациентам в условиях эндокринологического стационара проводили суточное мониторирование глюкозы в течение 10 дней при помощи системы Medtronic iPro2 (США). Оценивали среднесуточную гликемию, процент отклонений от нормогликемии (3,9–7,9 ммоль/л) на предшествовавшей терапии и после перевода пациентов на инсулин Дег/Асп. Дополнительно анализировали частоту гипогликемии и побочных эффектов.
Статистическую обработку данных выполняли с помощью пакета программ SPSS 17.0 for Windows (SPSS Inc.). Результаты представлены в виде медианы (Ме) и интерквартильного размаха (Q25–Q75). Статистически значимым считали различия при р<0,05.
Результаты
Через 2 недели после перевода на инсулин Дег/Асп уровень ГПН снизился с 11,5 до 6,2 ммоль/л (в среднем на 5,3 ммоль/л), ППГ – с 12,7 до 9,6 ммоль/л (в среднем на 3,1 ммоль/л). При анализе показателей суточного мониторирования глюкозы до перевода на Дег/Асп минимальное значение гликемии составило в среднем 6,8 (5,9–8,3), максимальное – 14,5 (14,0–16,0) ммоль/л, вариабельность гликемии составила 6,0 (4,9–8,0) ммоль/л. При этом лишь 18% времени уровень гликемии находился в пределах целевого диапазона значений гликемии. Гипогликемических состояний исходно зарегистрировано не было. Через 2 недели после применения инсулина Дег/Асп минимальное значение гликемии составило 4,9 (4,6–5,3) , максимальное – 11,1 (8,8–12,5) ммоль/л, вариабельность гликемии составила 4,2 (3,2–6,1) ммоль/л. При этом 88% времени уровень гликемии находился в диапазоне целевых значений и только в течение 12% времени отмечалась гипергликемия. Гипогликемии зарегистрировано не было. Средняя доза инсулина через 2 недели применения инсулина Дег/Асп составила 44 (40–60) ЕД/сут.
Ниже представлен клинический случай, демонстрирующий улучшение гликемического контроля у пациента с СД2 и длительным неудовлетворительным контролем гликемии на фоне проводимой базис-болюсной терапии аналоговыми препаратами инсулина после перевода на инсулин Дег/Асп (Райзодег).
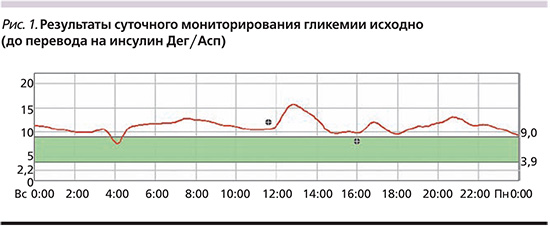
Пациентка 61 года с СД2 (длительность диабета – 13 лет), осложненного диабетической полиневропатией нижних конечностей (по данным электронейромиографии, октябрь 2014 г.), диабетической макроангиопатией в виде атеросклероза артерий нижних конечностей с множественными стенозами берцовых артерий (сужение просвета на 30–35%), медиакальцинозом (по данным ультразвуковой допплерографии, апрель 2014 г.). Сопутствующая патология: морбидное ожирение (более 20 лет; масса тела – 124 кг, ИМТ – 42,7 кг/м2, окружность талии – 134 см), артериальная гипертензия (около 10 лет; на фоне приема бисопролола 10 мг/сут, артериальное давление – АД 120–130/80 мм рт.ст.), дислипидемия (уровень липопротеидов низкой плотности [ЛПНП] – 4,37 ммоль/л; периодически принимает гиполипидемические препараты – статины). По данным суточного мониторирования АД найтпикер, увеличение скорости и величины утреннего подъема АД, вариабельность систолического АД (САД) и диастолического АД (ДАД) в пределах допустимых значений.
С 2007 г. получает базальную ИТ (инсулин гларгин – 34 ЕД/сут) в комбинации с ПССП – метформин 3000 мг/сут, глимепирид 6 мг/сут. Регулярно проводит самоконтроль гликемии (3–4 раза в день). Из-за недостижения оптимального контроля гликемии (НbА1с 10,6%, С-пептид натощак 1,79 нг/мл, после нагрузки 2,23 нг/мл) с октября 2014 г. с целью интенсификации был назначен прандиальный инсулин (глулизин в дозе 10 ЕД 3 раза в сутки), доза гларгина была увеличена до 38 ЕД/сут, глимепирид отменен. Несмотря на коррекцию терапии, сохранялась гипергликемия от 8,0 до 20 ммоль/л, HbA1c – 11,7%. Уровень креатинина плазмы – 51 мкмоль/л; скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration) – 112 мл/мин/1,73 м2, ЛПНП – 2,1 ммоль/л, триглицериды – 1,4 ммоль/л, аланинаминотранфераза – 28 ЕД/л, аспартатаминотрансфераза – 25 ЕД/л, общий анализ мочи – без патологии. Отмечено увеличение массы тела на 4 кг и повышение аппетита.
Для оценки функциональной активности β-клеток по НОМА-2 (Homeostatic Model Assessment) модели была проведена нагрузочная проба со стандартным завтраком. Была выявлена высокая инсулинорезистентность периферических тканей на фоне сниженной базальной и стимулированной секреции инсулина (табл. 1).
Данные непрерывного мониторирования гликемии с использованием системы мониторирования глюкозы Medtronic iPro2 (США) на фоне предшествовавшей терапии представлены на рис. 1.
С целью улучшения гликемического контроля была проведена коррекция терапии – пациентка переведена на Дег/Асп (Райзодег) 2 раза в сутки (30 ЕД в завтрак и ужин) в комбинации с эмпаглифлозином (10 мг 1 раз в сутки) и метформином (1000 мг 2 раза в сутки).
Уже через 3 дня после начала применения инсулина Дег/Асп отмечено существенное уменьшение колебаний уровня гликемии в течение суток: уровень гликемии варьировался от 4 до 8 ммоль/л, более 97% значений гликемии находились в целевом диапазоне (от 3,9 до 7,8 ммоль/л); гипогликемии не было (рис. 2). Через 1 неделю после перевода на инсулин Райзодег (в комбинации с ПССП) сохранялось стабильное улучшение гликемического контроля (рис. 2).
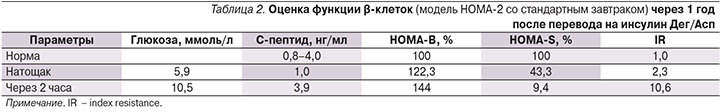
Через 1 год после перевода на препарат Райзодег сохраняется значительное улучшение гликемического контроля. Уровни гликемии в течение дня, по данным самоконтроля, колеблются от 4 до 8 ммоль/л. Признаков гипогликемии в течение анализируемого периода не было. Масса тела снизилась на 3 кг. Уровень НbА1с за год снизился на 3,5% и достиг 8,2%.
Улучшение гликемического контроля ассоциировалось с улучшением функции β-клеток по НОМА-2 модели со стандартным завтраком (табл. 2).
Данные суточного мониторирования гликемии на фоне проводимой терапии представлены на рис. 3. Средний уровень гликемии, по данным мониторирования, составил 6,4 ммоль/л; 82% времени уровень гликемии соответствовали целевому диапазону значений – 3,9–7,8 ммоль/л. Расчетный показатель НbА1с составил 5,6%.
Заключение
Данные доказательной медицины свидетельствуют о необходимости достижения и поддержания целевого контроля гликемии для обеспечения снижения риска развития осложнений и увеличения продолжительности качественной жизни при СД2. В то же время несколько крупных исследований (ACCORD, ADVANCE, VADT) показали, что достижение строгого целевого уровня НbА1с <6,5% может приводить к различным исходам, включая сердечно-сосудистую и общую смертность. Значимыми причинами неблагоприятного влияния интенсивного снижения уровня сахара в крови на прогноз являются хроническая гипергликемия на фоне неадекватной сахароснижающей терапии, высокая вариабельность действия препаратов инсулина, развитие тяжелой гипогликемии. Поэтому у пациентов с СД2 ИТ должна адаптироваться к индивидуальным особенностям и потребностям пациента.
При выборе индивидуальных целей гликемического контроля, режима и препарата ИТ необходимо учитывать многочисленные факторы, включая возраст, сопутствующие заболевания, параметры гликемии, риск развития гипогликемии, образ жизни, характер питания, а также психологический и социально-экономический аспекты. При переводе с одного типа инсулина на другой, особенно для пациентов с длительной гипергликемией и наличием сосудистых осложнений и сопутствующих заболеваний, очень важно отдавать предпочтение препаратам с низким потенциальным риском гипогликемии, особенно в период сразу после смены фармакотерапии.
Представленные данные подтверждают результаты клинических исследований и показывают, что у пациентов с СД2, не достигших оптимального контроля гликемии на ранее применяемом режиме ИТ, перевод на комбинированный инсулин Райзодег имеет преимущества в виде быстрого и значительного улучшения параметров гликемического контроля, способствует уменьшению колебаний гликемии и поддерживает уровень глюкозы в крови на уровне, близком к состоянию нормогликемии, не увеличивает риска гипогликемии, а также хорошо переносится и не приводит к увеличению массы тела. Таким образом, инсулин Райзодег является простой и безопасной альтернативой интенсивной базис-болюсной терапии для достижения целевого гликемического контроля. В связи с этим можно рекомендовать использование инсулина Райзодег для оптимизации ИТ при лечении СД2.
Дополнительная информация
О.С. Елсукова и А.А. Соболев принимают участие в клинических исследованиях, поддерживаемых компанией Ново Нордиск. О.С. Елсукова также выступает с лекциями от компании Ново Нордиск и принимает участие в работе консультационных советов, поддерживаемых компанией Ново Нордиск.
Работа выполнена по инициативе и при личном участии авторов при поддержке компании Ново Нордиск. Компания Ново Нордиск не привлекалась к разработке дизайна анализа, не оказывала влияния на выбор пациентов, не участвовала в сборе, анализе или интерпретации данных. Авторы несут полную ответственность за содержание и выводы, изложенные в этой рукописи.
Авторы выражают благодарность Алексеевой Яне Геннадиевне (Ново Нордиск, Россия) за помощь при подготовке статьи.



