Поражения нервной системы при сахарном диабете (СД) встречаются достаточно часто, при этом их проявления довольно разнообразны. В клинической практике чаще всего приходится сталкиваться с сенсомоторной периферической полиневропатией, относящейся к генерализованным невропатиям.
В многочисленных исследованиях доказан вклад гипергликемии и длительности заболевания в развитии диабетической дистальной полиневропатии (ДПН). Риск развития ДПН повышается на 10–15% на каждый ммоль подъема уровня гликемии натощак или 1% уровня гликированного гемоглобина (HbA1c). Распространенность ДПН возрастает с 14% при длительности СД меньше 5 лет до 44% при длительности заболевания более 30 лет. В ряде работ продемонстрировано, что распространенность ДПН в возрастной категории от 20 до 44 лет составляет 5–8%, тогда как у больных СД старше 45 лет этот показатель возрастает до 23–44%. Однако значение возраста в развитии ДПН, возможно, переоценивается, т.к. ряд показателей, в частности вибрационная чувствительность, с возрастом снижаются, что не всегда учитывается при проведении исследований [1]. Доказано, что помимо гипергликемии и длительности СД на развитие и прогрессирование осложнения оказывают негативное влияние такие факторы риска, как артериальная гипертензия, дислипидемия, центральный тип ожирения [2].
Клинические проявления
Клинические проявления ДПН во многом зависят от стадии развития процесса (табл. 1).
На ранних стадиях (острая болевая невропатия) преобладает достаточно яркая клиническая симптоматика. Больных беспокоят жалобы на жжение, боли стреляющего характера, покалывания, парестезии и т.д. Характерны гиперестезия, аллодиния – ощущение боли от прикосновения предметов, которые в норме не вызывают боли (например, одежда, постельное белье и т.д.). В физиологических условиях боль является защитной реакцией организма на повреждение тканей. При нарушении целостности тканей высвобождаются биологически активные вещества, такие как гистамин и простагландины, которые активизируют болевые рецепторы (ноцицепторы). При ДПН механизм возникновения боли другой. В генезе болевых ощущений принимают участие прямая активация ноцицептивных рецепторов, активная аксональная дегенерация, атрофия аксона и т.д. Кроме того, болевые ощущения могут возникать вследствие эктопической генерации импульсов при регенерации аксона в волокнах мелкого сечения. С подобным феноменом можно столкнуться при улучшении показателей гликемии после применения инсулинотерапии. Как правило, на этой стадии объективные признаки нарушения чувствительности минимальны. Если за три месяца не удается справиться с болевыми ощущениями, острая болевая стадия переходит в хроническую. На этой стадии имеющиеся жалобы могут усиливаться ночью. Клиническая симптоматика может сопровождаться потерей чувствительности по типу «носков и перчаток». При этом объективные признаки нарушения чувствительности также минимальны или отсутствуют.
На более поздних стадиях, напротив, симптомы проявляются менее ярко. Как правило, пациентов беспокоит онемение, ощущение «отсутствия ног». Нередко жалоб вообще нет. Однако при объективном осмотре выявляются выраженные признаки снижения чувствительности. В подобной ситуации может развиться невропатическая форма синдрома диабетической стопы (СДС), в более редких случаях нейроостеоартропатия (стопа Шарко).
Диагноз ДПН необходимо установить как можно раньше с целью назначения необходимых лечебно-профилактических мероприятий.
В клинической практике диагностика ДПН состоит из двух частей:
- оценки симптомов;
- клинического неврологического обследования с применением количественных тестов для оценки степени выраженности неврологических расстройств.
К симптомам ДПН относятся жалобы на жжение, острую, стреляющую боль в стопах, ощущение «ползания мурашек», покалывание и онемение в стопах и/или кистях рук, судороги. При наличии болевого синдрома необходимо провести дифференциальную диагностику с другими заболеваниями. В клинической практике чаще всего дифференциальный диагноз проводится между ДПН и нарушением магистрального кровотока нижних конечностей (табл. 2).
Для ДПН характерна дистальная симметричная локализация болей – это чаще всего пальцы стоп, подошвенная и/или тыльная поверхность стоп, тогда как при нарушениях магистрального кровотока болевой синдром возникает в икроножных мышцах. Невропатические боли возникают преимущественно в состоянии покоя, а при нарушениях магистрального кровотока прослеживается четкая связь с дистанцией ходьбы (больной может пройти в среднем от 50 до 200 м – синдром перемежающейся хромоты). Положение ног (опущенное, приподнятое, горизонтальное) никак не влияет на характер болевых ощущений при ДПН. В запущенных случаях нарушений магистрального кровотока опущенное положение ноги облегчает болевые ощущения. Необходимо отметить, что при одновременном наличии ДПН и патологии магистрального кровотока синдрома перемежающейся хромоты может не быть. Это затрудняет клиническую диагностику и требует обязательного проведения ультразвуковой допплерографии сосудов нижних конечностей.
Для объективной оценки неврологического статуса необходимо провести клиническое неврологическое обследование. С этой целью наиболее широко применяют исследование различных видов чувствительности (тактильной, болевой, температурной и вибрационной), а также оценку коленных и ахилловых рефлексов. Для углубленной диагностики ДПН и в научно-исследовательских целях применяются более сложные инструментальные инвазивные и неинвазивные методы.
Современные подходы к терапии ДПН
Лечебно-профилактические мероприятия при ДПН необходимо начинать как можно раньше. Необходимо отметить, что основным методом как профилактики, так и лечения ДПН является компенсация углеводного обмена. Одним из подтверждений этого являются результаты, полученные в одном из крупнейших проспективных исследований DCCT (Diabetic Control and Complication Trial, 1993), в котором через 5 лет в группе больных, получающих традиционную инсулинотерапию, ДПН развилась в 9,6% случаев, а в группе больных, находящихся на интенсифицированном режиме инсулинотерапии с лучшим контролем гликемии, лишь в 2,8% случаев [4].
Учитывая полученные данные о вкладе дополнительных факторов риска в развитие ДПН наряду с оптимизацией уровня глюкозы, особое внимание следует уделять достижению целевых показателей артериального давления – АД (≤130/80 мм рт.ст.) и липидов крови.
В настоящее время основной целью медикаментозной терапии ДПН является воздействие на симптомы ДПН, которые значительно снижают качество жизни больных. При этом лечение может иметь патогенетическую направленность, а также воздействовать на проявления заболевания по принципу симптоматической терапии.
Целью симптоматического лечения является купирование болевой симптоматики. В данном аспекте в качестве стандартной терапии назначают трициклические антидепрессанты, противосудорожные средства, анальгетики, средства местного воздействия (капсикам, капсаицин) [5, 6].
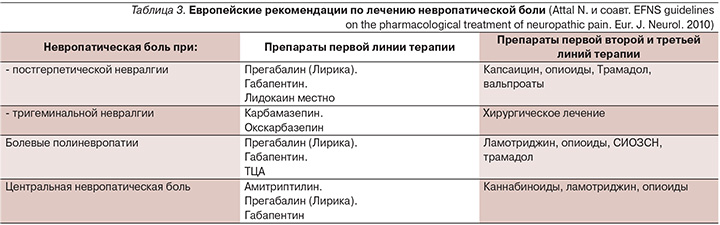
В последних отечественных и международных рекомендациях по лечению болевой формы ДПН препаратом выбора является прегабалин (табл. 3).
Прегабалин – производная γ-ами-номасляная кислота. Механизм его действия основан на неспецифическом связывании с α2-β-субъединицей потенциалзависимых кальциевых каналов центральной нервной системы. В результате поступление Са2+ в нервные окончания снижается, что приводит к уменьшению высвобождения нейротрансмиттеров, ответственных за чувство боли. Эффективность и безопасность оригинального прегабалина (Лирика®, Пфайзер) доказаны в многочисленных плацебо-контролируемых исследованиях.
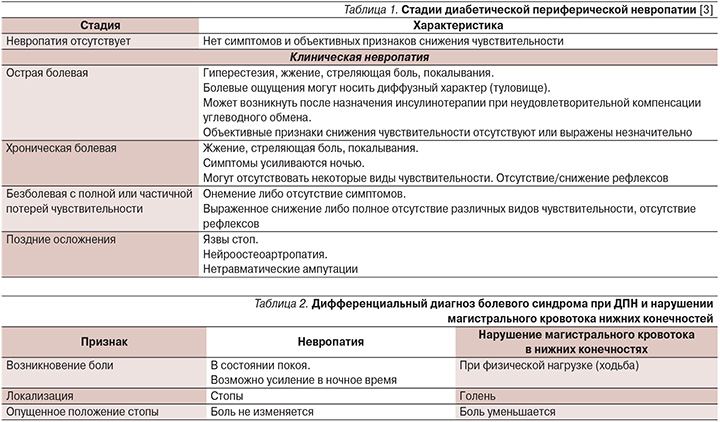
Так, в обзорном анализе 7 рандомизированных контролируемых исследований было сделано заключение о достоверном снижении болевой симптоматики и связанных с ней нарушений сна у пациентов, принимающих прегабалин, по сравнению с плацебо ((p≤0,007; рис. 1) [7].
В другой работе, оценивавшей результаты двойного слепого плацебо-контролируемого многоцентрового исследования с участием 338 пациентов с невропатической болью, было выявлено, что как фиксированная доза прегабалина, так и гибкий режим в течение 12 недель приводили к существенному по сравнению с плацебо уменьшению боли и улучшению сна (p<0,001) [8].
Подбор эффективной дозировки осуществляется методом титрации. Рекомендовано начинать прием со 150 мг/сут. Эффективным признан прием 300–600 мг препарата в сутки. В наблюдательном открытом исследовании с участием 15 301 пациента у 5091 была диагностирована ДПН. Из 5808 поликлиник и клиник прегабалин назначался в среднем на 45 дней. Для снижения интенсивности боли на 62% большинство (78%) пациентов получали 150 мг прегабалина в сутки в качестве стартовой терапии. Поддерживающая дозировка в 300 мг потребовалась 43% больным [9].
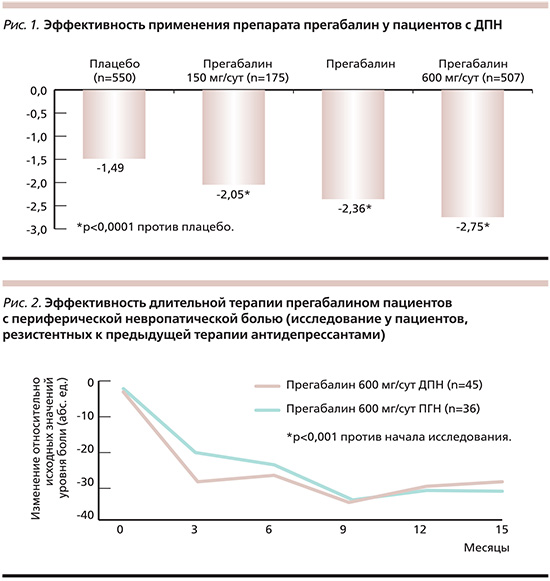
Длительность приема зависит от клинической ситуации. При необходимости прегабалин может приниматься длительное время. Результаты 4 открытых исследований по оценке эффективности длительности терапии прегабалином с участием 444 пациентов, находившихся на гибком режиме приема препарата, продемонстрировали, что уровень боли оставался постоянным в течение 2 лет. Частота и интенсивность побочных эффектов были сопоставимыми с таковыми при непродолжительном курсе приема препарата (рис. 2) [10].
Побочные эффекты связаны с механизмом действия препарата. Наиболее часто встречаются головокружение и сонливость. Следует отметить, что указанные выше побочные эффекты дозозависимые и общие для всех противосудорожных препаратов. У прегабалина они выражены в меньшей степени. Как правило, они не требуют приема дополнительных препаратов для устранения и проходят самостоятельно в течение 2–4 недель постоянного приема.
Таким образом, прегабалин является препаратом выбора для лечения болевой формы ДПН с учетом достаточной доказательной базы клинических исследований по его эффективности. В целом препарат хорошо переносится, большинство побочных эффектов носит преходящий характер, являются несерьезными, легкой или средней степеней тяжести. Дозировка препарата титруется. Начинать следует с дозы 150 мг/сут. При необходимости дозировку увеличивают каждые 7 дней, максимальная доза препарата составляет 600 мг/сут. Препарат может приниматься длительное время без снижения его эффективности.


