Актуальность проблемы
Хронические раны представляют собой серьезную проблему для мирового здравоохранения на протяжении многих лет. Многие российские и зарубежные авторы занимались ее изучением, принимая различные определения этого понятия и предлагая множество методов лечения при данной патологии [1, 3, 6, 9]. Несмотря на массу научных трудов по этой тематике и сотни предложенных инновационных методов лечения, проблема лечения хронических ран и сейчас остро стоит перед хирургами во всем мире [2–4, 11, 12]. Ежегодные затраты на лечение хронических ран достигают 9 млрд долл. США и требуют массу времени и усилий медицинского персонала для организации длительного адекватного наблюдения за этой категорией пациентов [5, 6, 8, 10, 12].
В 1996 г. Европейское общество репарации тканей на специальном заседании приняло определение: «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации». Отечественные авторы дополнили это определение и описывают хроническую рану как рану, репарация которой нарушена из-за неблагоприятных фоновых состояний. Понятие «хроническая рана» – очень широкое и включает также трофические язвы, хроническую анальную трещину и другие длительно не заживающие раневые дефекты. Причины, обусловливающие формирование хронических ран, также бывают весьма разнообразными. Хорошо изучены этиологические факторы, приводящие к развитию трофических язв. Они бывают венозными на фоне хронической лимфовенозной недостаточности, артериальными, при хронической ишемии нижних конечностей, на фоне диабетической полинейропатии, микро- и макроангиопатии, гипертоническими (синдром Марторелла), при системных заболеваниях (болезни крови, обмена веществ, коллагенозы, васкулиты), нейротрофическими, рубцово-трофическими; застойными (на фоне недостаточности кровообращения), пиогенными, специфическими и инфекционными, малигнизированными, при синдроме Лайелла, при врожденных пороках развития сосудистой системы, лучевыми, артифициальными [2, 3, 7]. Генез большинства хронических ран полиэтиологичен с вовлечением различных патогенетических механизмов, затрагивающих клеточный и тканевой метаболизм, микрососудистый эндотелий [7, 9, 11]. В связи с этим актуально применение терапевтических методик с использованием, в частности, фармакологических препаратов, влияющих на различные звенья патогенеза. Препарат Актовегин, обладающий плейотропными эффектами, показал свой терапевтический потенциал в отношении пациентов с сахарным диабетом и хронической ишемией нижних конечностей, сопровождающейся язвенно-некротическими осложнениями [1, 3, 4, 7]. С учетом вышесказанного целью нашей работы стала оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии.

Материал и методы
Под нашим наблюдением находились 118 пациентов в возрасте от 52 до 80 лет, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета ГКБ № 81. Все пациенты находились на лечении в связи с наличием хронических раневых дефектов. Больные были разделены по этиологическому фактору на три группы, включившие патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. В 1-ю группу были включены 54 пациента, страдавших длительно незаживающими трофическими язвами нижних конечностей вследствие хронической венозной недостаточности. У всех пациентов при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей диагностирована несостоятельность клапанов подкожных вен и наличие длительно существующих (от 2 до 48 месяцев) незаживающих раневых дефектов в области нижней и средней третях голеней. Всем больным выполнено этиопатогенетическое лечение: после курса антибактериальной терапии с учетом микробного пейзажа и очистки раневых дефектов была проведена кроссэктомия в сочетании с операцией Линтона. В послеоперационном периоде больные были разделены по 27 пациентов на две группы – основную и контрольную, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больным проведена медикаментозная терапия и местное лечение в полном объеме. Пациенты основной группы помимо традиционного лечения получали Актовегин внутривенно (1200 мг 1 раз в сутки в течение 14 дней) и местно в форме геля, мази или крема в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки больным назначен препарат Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе местное лечение осуществлено мазевыми повязками (Бетадин, метилурацил, Левосин).
Во 2-ю группу включены 36 пациентов с симптомами хронической артериальной ишемии нижних конечностей, а также длительно незаживающими раневыми дефектами на различных уровнях стоп на фоне облитерирующего атеросклероза и эндартериита. При УЗДС артерий нижних конечностей диагностированы окклюзии бедренно-подколенно-берцового сегмента на различных уровнях. Всем больным по показаниям выполнена коррекция магистрального кровотока: бедренно-дистальные шунтирования аутовенной или синтетическими протезами, проведена консервативная гемореологическая (реополиглюкин, декстран и т.д.), антикоагулянтная (гепарин, Плавикс, Вессел Дуэ Ф), дезагрегантная (пентоксифилин, ацетилсалициловая кислота) терапия в полном объеме. В послеоперационном периоде пациенты были разделены по 18 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больные основной группы помимо стандартного лечения получали Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе Актовегин не применялся, а местное лечение осуществлено раствором Бетадин, мазью Левомеколь, метилурациловой мазью.
В 3-ю группу включены 28 пациентов, длительное время страдавших сахарным диабетом 2 типа, с клиническими признаками полинейропатии и длительно существующими раневыми дефектами нижних конечностей, не связанными с хронической артериальной или венозной недостаточностью. У этих пациентов проведены коррекция углеводного обмена (инсулинотерапия), местное лечение в объеме некрэктомии (по показаниям), гемореологическая и нейротропная терапия (Октолипен, Берлитион), ультразвуковая кавитация ран в регенерационном режиме через день, перевязки с гелем Hydrosorb, раствором Бетадин. Эти больные также были разделены по 14 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии.
В основной группе больные помимо общепринятого лечения получали препарат Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Во всех нозологических группах пациентов до и после курсов комплексной терапии произведен визуальный контроль ран по системе MEASURE [11], а также выполнены исследования микроциркуляции методом лазерной допплеровской флоуметрии. Датчик располагался в дне раневых дефектов. Помимо этого всем больным выполнено гистологическое исследование биоптатов из ран на протяжении всего срока стационарного лечения в динамике. Биоптаты фиксировали в 10%-ном нейтральном формалине и,по общепринятой методике заливали в парафиновые блоки. Изготовленные из парафиновых блоков гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Результаты и их обсуждение
У пациентов 1-й группы, проходивших лечение по поводу хронических ран, вызванных хронической венозной недостаточностью, уменьшение площади раневых дефектов (высчитывалась из линейных размеров ран) в основной группе отмечено на 4–5-е сутки, в контрольной группе – на 7–9-е послеоперационного периода.
В обеих группах на 3–4-е сутки послеоперационного периода уменьшалось количество экссудата с умеренного до скудного, причем качественно экссудат оценивался нами как серозный или серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е сутки, тогда как в контрольной группе – на 6–7-е. На момент выписки хронические раны полностью зажили у 10 (37%) пациентов основной группы и у 5 (18,5%) – контрольной. Через 3 недели после выписки раны зажили в основной группе у всех (100%) больных, в контрольной группе – у 15 (55,5%) пациентов.
У пациентов 2-й группы, получавших лечение по поводу хронических ран, обусловленных хронической артериальной недостаточностью, уменьшение площади раневых дефектов, отмечено в обеих группах, однако в основной группе оно происходило на 4–5-е сутки, а в контрольной группе – на 7–8-е сутки после операции. Количество экссудата уменьшалось со скудного до его отсутствия в обеих группах на 3–4-е сутки послеоперационного периода, качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью на 6–7-е сутки у 11 (61%) пациентов основной группы и 6 (33%) контрольной. У остальных пациентов раны полностью были покрыты твердым и сухим струпом. В основной группе болевой синдром значительно уменьшился на 3–4-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 6–7-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе была отмечена на 4–6-е сутки и на 8–10-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 7 (38,8%) пациентов основной группы и у 3 (16,6%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у 12 (66,6%) пациентов основной группы и у 8 (44,4%) пациентов контрольной группы.
У пациентов 3-й группы, проходивших лечение по поводу хронических ран, на фоне нейропатической формы синдрома диабетической стопы, уменьшение площади раневых дефектов в основной группе отмечено на 2–3-е сутки, в контрольной группе – на 4–5-е сутки после начала лечения. Количество экссудата уменьшалось с умеренного до скудного в основной группе на 1–2-е сутки, в контрольной группе – на 2–3-е сутки, причем качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е и на 5–6-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 12 (85%) пациентов основной группы и у 8 (57%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у всех пациентов основной группы (100%) и у 12 (85,7%) пациентов контрольной группы.
Особое внимание уделено динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии. Результаты исследования показали, что при сочетании применения Актовегина для наружного использования и внутривенных инфузий через месяц от начала лечения эпителизация язвенного дефекта наблюдалась более чем у половины (53%) пациентов, что статистически достоверно.
При применении Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс появление грануляций были в среднем меньше по сравнению со сроками в контрольных группах на 3–4-е суток (табл. 1). Через месяц от начала терапии у 29 пациентов основной группы и у 16 контрольной наблюдали эпителизацию язвенного дефекта. У 9 больных основной группы наблюдались вялые грануляции с отложениями фибрина, в контрольной группе – у 20 больных (табл. 2).
Результаты исследования микроциркуляции методом лазерной допплеровской флоуметрии представлены в табл. 3.
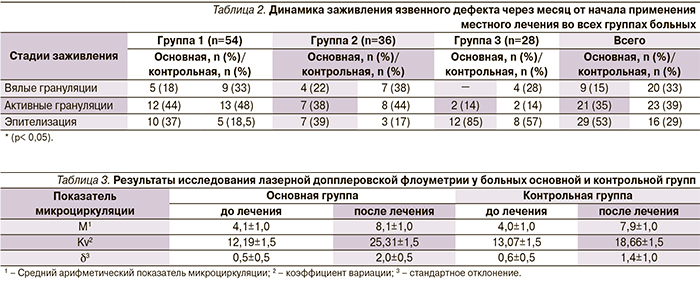
При гистологическом анализе биоптатов из ран после срока стационарного лечения у всех пациентов, получавших Актовегин, по сравнению с пациентами контрольных групп отмечалась нормализация процессов пролиферации и дифференцировки грануляционной ткани (коллагенообразования и новообразования сосудов), менее выраженная лейкоцитарная инфильтрация, активные процессы эпидермизации участков поражения кожи (рост эпителиального пласта на границе с грануляционной тканью).
В качестве иллюстрации эффектов комплексной терапии приводим клинический пример.
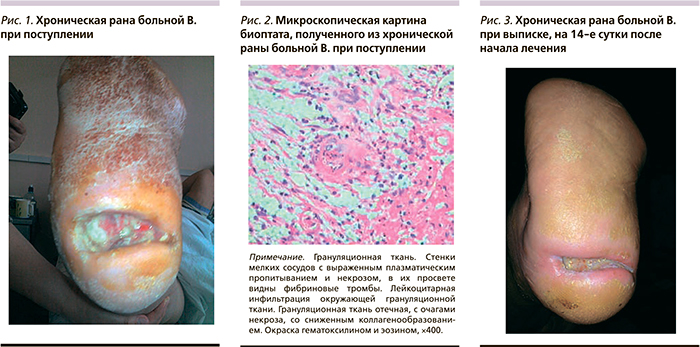
Пациентка В. 67 лет с синдромом «диабетическая стопа», нейропатией 2-й степени по Wagner, трофической язвой подошвенной поверхности резецированной правой стопы на фоне натоптыша в течение трех месяцев (рис. 1). Больная лечилась амбулаторно в поликлинике, по назначению хирурга применялись перевязки с мазью левомеколь в течение одного месяца без эффекта. Пациентка была направлена в отделение гнойной хирургии и гнойных осложнений сахарного диабета в плановом порядке. При обследовании: клинико-биохимические показатели в пределах нормы, при УЗДС артерий нижних конечностей окклюзия дистальных отделов передней и задней большеберцовой артерий.
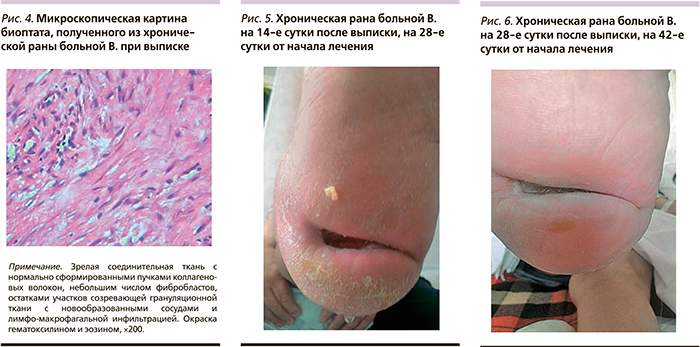
При поступлении больной была взята биопсия из раны (рис. 2), проведена нормализация углеводного обмена, назначены местное лечение: ультразвуковая кавитация в регенерационном режиме через день, повязки с гелем Hydrosorb. Наряду с традиционным лечением больной был назначен курс препарата Актовегин 1200 мг внутривенно 1 раз в сутки в течение 14 дней. На 6-е сутки после очищения раны использован гель Актовегин толстым слоем под повязку. На фоне лечения была отмечена положительная динамика: размеры раны уменьшились, исчезло перифокальное воспаление (рис. 3). При выписке у пациентки была проведена биопсия раны (рис. 4). После выписки больной было рекомендовано принимать амбулаторно Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней, а местно использовать Актовегин в форме геля. На 28-е сутки от начала лечения отмечена выраженная положительная динамика (рис. 5), а на 42-е сутки от начала лечения у больной сформировался соединительно-тканный рубец на месте трофической язвы резецированной правой стопы. Результат лечения расценен как удовлетворительный (рис. 6).
В заключение стоит отметить, что назначение препарата Актовегин оказалось не случайным и обусловлено его фармакологическими свойствами: выраженным метаболическим и эндотелиопротекторным действиями на уровне микрососудистого русла. Актовегин улучшает коллатеральный кровоток, трофическое обеспечение кислородом тканей при их хронической ишемии, а также при сосудистых и нейропатических осложнениях сахарного диабета [1–3, 7]. Полученные результаты позволили сделать нам следующие выводы и рекомендации:
В комплексном лечении хронических ран ведущая роль принадлежит патогенетическому лечению.
Для лечения хронических ран различной этиологии применение Актовегина в составе комплексной терапии достоверно позволяет увеличивать ее эффективность. При применении Актовегина на 3–4 суток раньше уменьшаются размеры хронических ран, на 2-3 суток раньше снижается болевой синдром по сравнению с больными контрольной группы.
Назначение Актовегина позволяет достоверно улучшать микроциркуляцию в хронической ране (средний показатель микроциркуляции в среднем выше на 0,2 пФ в группе пациентов, получавших Актовегин).
Мы рекомендуем включать препарат Актовегин в схему комплексного лечения больных с хроническими ранами различной этиологии по следующей схеме: внутривенно по 1200 мг 1 раз в сутки в течение 14 дней. Далее переход на таблетированную форму: по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Для местного лечения чистых хронических ран различной этиологии мы рекомендуем использовать Актовегин в форме геля 1 раз в сутки до полного заживления.


