Рак молочной железы (РМЖ) по-прежнему остается основной формой новообразований у женщин. В РФ в структуре онкологических заболеваний среди женщин РМЖ занимает 1-е место и составляет 21,4 % (в 2013 г. в России РМЖ заболели более 55 тыс. женщин). Смертность женщин от РМЖ в РФ стоит на третьем месте после болезней системы кровообращения и несчастных случаев, на первом – в структуре женской смертности от онкологических заболеваний 17,4 % [3].
Среди осложнений радикального лечения РМЖ отек верхней конечности на стороне операции выделялся всегда особо.
Долгое время лимфедерма игнорировалась в качестве значительного позднего побочного эффекта хирургического лечения и лучевой терапии.
В настоящее время она признается как потенциальный хронический, неблагоприятный и снижающий качество жизни результат лечения [4, 5, 10]. В структуре синдрома важное место занимает нарушение лимфооттока из верхней конечности на стороне операции [2]. Следует подчеркнуть, что проявления постмастэктомического синдрома чаще носят комбинированный характер и наблюдаются в различных вариантах практически у всех больных [1, 6, 11].
Несмотря на внедрение методов лечения, при которых остаются интактными пути лимфооттока и в отсутствие метастазов в сторожевом лимфатическом узле возможно не проводить подмышечную лимфодиссекцию; частота лимфедемы, связанной с лечением РМЖ, остается высокой и заболение развивается у 30,9–81,0 % больных, как результат – до 40 % из них становятся нетрудоспособными [1, 13, 14].
 Лечение лимфедемы достаточно трудное, может быть консервативным и хирургическим. Многие авторы отмечают необходимость мультидисциплинарного подхода к этой проблеме [12, 15]. В настоящее время методом выбора в лечении лимфедемы любой стадии Международным обществом лимфологов названа комплексная физическая терапия. Этот метод заключается в поэтапном применении ряда консервативных средств на протяжении всей жизни пациента. Его основу составляют мануальный лимфодренаж, компрессионная терапия, физиотерапия, лечебная физическая культура. Большое значение имеет применение пероральных фармакологических средств, обладающих лимфотонизирующим и противоотечным действием. Помимо этого пациенту рекомендуют внести значительные коррективы в привычный образ жизни и трудовую деятельность [5, 6].
Лечение лимфедемы достаточно трудное, может быть консервативным и хирургическим. Многие авторы отмечают необходимость мультидисциплинарного подхода к этой проблеме [12, 15]. В настоящее время методом выбора в лечении лимфедемы любой стадии Международным обществом лимфологов названа комплексная физическая терапия. Этот метод заключается в поэтапном применении ряда консервативных средств на протяжении всей жизни пациента. Его основу составляют мануальный лимфодренаж, компрессионная терапия, физиотерапия, лечебная физическая культура. Большое значение имеет применение пероральных фармакологических средств, обладающих лимфотонизирующим и противоотечным действием. Помимо этого пациенту рекомендуют внести значительные коррективы в привычный образ жизни и трудовую деятельность [5, 6].
К наиболее перспективным методам медицинской реабилитации данной категории больных можно отнести подкожную хирургическую коррекцию лимфедемы с последующим проведением комплекса консервативных мероприятий (компрессионные и медикаментозные методы, воздействие физическими факторами: лазерное излучение, фототерапия и современный пневмомассаж) в послеоперационном периоде [8, 9].
Материал и методы исследования
Основу исследования составили клинические материалы обследования и комплексного лечения 350 пациенток с постмастэктомической лимфедемой верхней конечности, прошедших реабилитационное лечение в ФГБУ ФБ МСЭ Министерства труда и социального развития РФ и ГБУЗ МО «Московский областной онкологический диспансер» с 2000 по 2013 г.
Этот временной промежуток разделен на два периода: с 2000–2009-х и с 2010–2013 гг. В течение указанных периодов используемая лечебно-диагностическая тактика в отношении пациенток с постмастэктомической лимфедемой верхней конечности претерпела значительные изменения.
В контрольную (I группа) вошли 300 больных первого периода, в основную (II группа) – 50 пациенток второго периода.
В контрольной группе в лечении больных был использован комплексный подход. Все пациенты получали лечение диетой (субкалорийная диета с ограничением поваренной соли), медикаментозную терапию (антикоагулянтную, венотонизирующую, улучшающую периферическое кровообращение), физиотерапию (магнито-, лазеротерапию, дозированную пневмокомпрессию, фототерапию), массаж (лимфодренажный с бандажированием), лечебную физическую культуру. В случаях развития контрактуры плечевого сустава на стороне поражения проводились занятия на роботизированных реабилитационных аппаратах. Для снижения рецидивов рожистого воспаления использованы курсы иммунотерапии (Т-активин, реаферон, Ингарон, α- и γ-интерфероны и др.). Мы применяли также лимфотропное введение иммунных препаратов. Курсы подбирались индивидуально для каждой больной после определения полного иммунного статуса. Работа в этом направлении продолжается.
Основную группу составили пациентки, которым была дополнительно выполнена операция подкожной хирургической коррекции лимфедемы – липосакция.
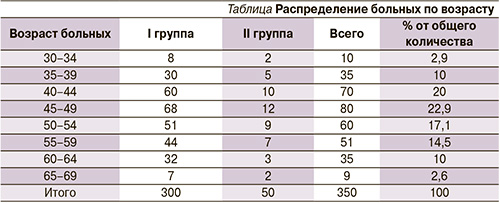
В контрольной группе средний возраст составил 48,1 ± 2,4 года с индивидуальными колебаниями от 30 до 65 лет. В основной группе средний возраст достигал 48,4 ± 2,1 года с индивидуальными колебаниями от 30 до 65 лет. Распределение больных по возрастным группам представлено в таблице.
Как видно из данных таблицы, большая часть (261 [87 %] контрольной, 45 [90 %] основной) больных находилась в трудоспособном возрасте – в рассвете профессиональной деятельности, что подтверждает социальную значимость и актуальность работы. Всего число больных трудоспособного возраста 30–59 лет составило 306 (87,4 %).
Все пациенты на предыдущем этапе получали лечение в специализированных стационарах по поводу злокачественных новообразований молочной железы. В контрольной группе 32 (10,67 %) получили хирургическое лечение, 158 (52,67 %) – комбинированное и 110 (36,66%) комплексное лечение. В основной группе 5 (10 %) получили хирургическое лечение, 26 (52 %) комбинированное и 19 (38 %) комплексное лечение.
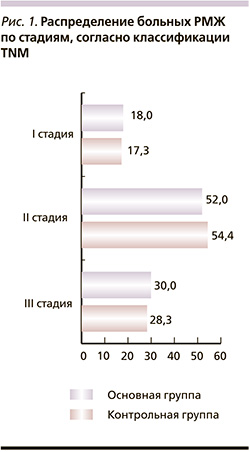
Опухоль молочной железы стадировали, согласно классификации TNM (VII издание) (рис. 1). Из представленных данных на рис. 1 видно, что в контрольной группе у 52 (17,3%) пациенток была до начала лечения I стадия РМЖ, у 163 (54,4 %) – II стадия РМЖ, III стадия была диагностирована у 85 (28,3 %). В основной группе распределение выглядело следующим образом: у 9 (18 %) диагностирован РМЖ I стадии, у 26 (52 %) – II, у 15 (30 %) – III стадии.
Стадия лимфодемы определена по клинико-симмптоматической классификации по К.Г. Абламасову (1992). Распределение больных контрольной группы в зависимости от стадии лимфедемы выглядело следующим образом: I степень диагностирована у 22 (7,3 %) больных, II и III степени в 92 (30,7 %) и 168 (56 %) наблюденях, IV степень лимфедемы была диагностирована у 18 (6 %) больных.
В основной группе лимфедема II степени была выявлена у 20 (40 %) больных, III – у 25 (50 %), IV – у 5 (10 %) больных.
Отек верхней конечности развился в срок от 2 недель до 12 лет после специального лечения. Так, за первые 6 месяцев отек был выявлен у 42 (12 %) больных, в период 6–12 месяцев – у 154 (44 %) пациентов, в период 12–24 месяца – у 137 (39 %). В срок свыше 24 месяцев отек манифестировал у 17 (5 %) больных.
В контрольной группе отек верхней конечности локализовался справа у 176 (58,6 %), слева у 124 (41,4%) больных.
В основной группе распределение было следующим: правая верхняя конечность была поражена у 28 (56%) больных, левая у 22 (44%).
Сопутствующие заболевания имелись у 342 (97,7 %) больных. В структуре сопутствующих заболеваний основное место занимали ожирение II–III ст. у 273 (78 %), сахарный диабет у 99 (28,3 %) пациентов. Ише-мическая болезнь сердца у 78 (22,3 %) пациентов, хронические заболевания печени и почек у 62 (17,7 %), хронические заболевания легких у 34 (9,7 %).
Всем больным контрольной группы выполнена операция подкожной хирургической корекции лимфедемы под общим обезболиванием. Липосакция проводилась по методике, предложенной в 1980-е гг. G. Hetter.
Показаниями к оперативному лечению были как медицинские (плотный постоянный отек, фиброзно-склеротические изменения кожи и подкожной клетчатки, деформация верхней конечности, ограничение подвижности в плечевом, локтевом суставах, трофические нарушения, увеличение объема отечной конечности в пределах 50 % и более объема здоровой конечности, отсутствие эффекта от консервативной терапии), так и социальные факторы (снижение способности к самообслуживанию, трудовой деятельности, отсутствие возможности подбора одежды для выхода из помещения, психоэмоциональное напряжение, замкнутость).
В ходе исследования нами было изучено качество жизни пациентов, перенесших лечение по поводу постмастэктомической лимфедемы. Исследования предполагали сбор субъективных данных путем анкетирования пациентов с помощью общего опросника здоровья MOS SF-36 (Medical Outcomes Study – Short Form).
Оценку статистической значимости показателей и достоверности различий сравниваемых групп производили с использованием программного пакета BIOSTAT.
Результаты
В контрольной группе максимальный регресс лимфатического по одному из 6 антропометрических имерений верхней конечности отека составил 7 ± 3 см. Наилучшие положительные результаты при этом достигнуты пациентками с I и II степенью лимфедемы. Неудовлетворительные клинические результаты больных с более высокими степенями лимфедемы верхней конечности можно объяснить грубыми нарушениями моторики и реактивности, а также емкостной фунции лимфангионов под действием высокобелкового отека. Таким образом, нарушается основной фактор оттока лимфы.
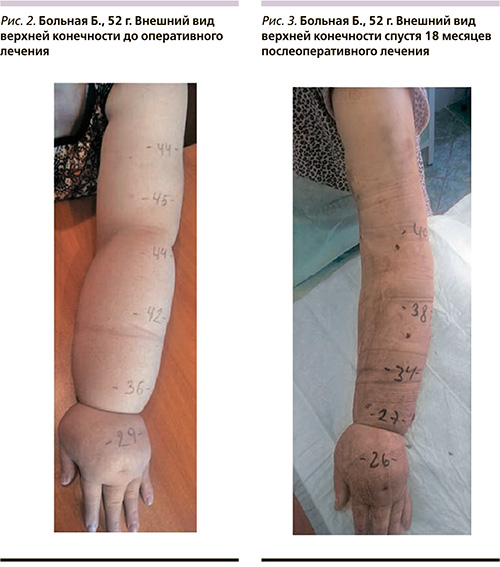
В срок наблюдения от 4 до 36 месяцев у всех пациенток основной группы отмечена выраженная положительная динамика – значительный регресс отека верхней конечности, уменьшение обхвата плеча и предплечья 16 ± 7 см, выраженный психо-эмоциональный подъем и улучшение социальной адаптации (групповая работа психолога, психокоррекция) (рис. 2, 3).
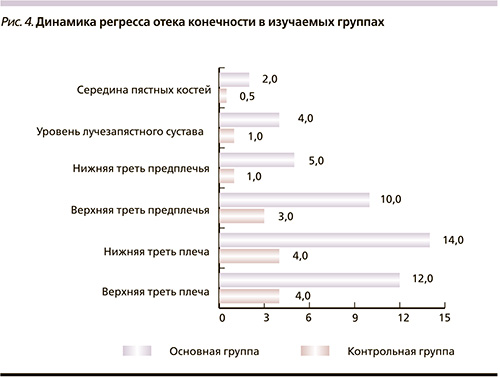
На рис. 4 представлены средние значения регресса отека (в сантиметрах) в основной и контрольной группах.
При проведении подкожной коррекции лимфедемы мы одновременно оперировали плечо и предплечье, причем с конечности удалено от 2500 до 3500 мл измененной подкожно-жировой клетчатки. В результате использования раствора с адреналином кровопотеря не превышала 195 ± 36 мл. В послеоперационном периоде обязательными условиями было применение компрессионного белья на верхнюю конечность и с учетом иммунодефицита онкологических больных – профилактическое использование противомикробных препаратов.
Из 50 пациентов послеоперационные осложнения развились в 7 (14 %) случаях в виде кровоподтека и временной потери чувствительности по наружной поверхности плеча, которые регресировали на фоне проводимых консервативных меропириятий. В послеоперационном периоде все прооперированные пациенты получали весь комплекс консервативных мероприятий, направленных на устранение послеоперационного отека и воспаления.
Проведенный сравнительный анализ качества жизни между иследуемыми группами больных показал, что уровень качества жизни 93 % пациенток после комплексного лечения постмастэктомической лимфедемы верхней конечности с применением малоинвазивных технологий приближается к популяционной норме, тогда как у лиц, получавших консервативную терапию, качество жизни снижено в два раза относительно уровня качества жизни популяционной нормы.
Таким образом, включение в комплексную реабилитацию больных с постмастэктомическим отеком II–IV степеней подкожной хирургической коррекции лимфедемы позволяет в 86 % наблюдений уменьшить объем верхней конечности на 16 ± 7 см, 63,5 % больных – увеличить объем активных движений в суставах верхней конечности на стороне поражения, а 93 % пациенток приводит к улучшению качества их жизни.


