Актуальность
Рак молочной железы (РМЖ) является самой частой злокачественной опухолью у женщин. Число новых случаев заболевания в мире превышает 1 млн в год. На протяжении жизни одна из 7 женщин в США, а в России одна из 12 женщин заболевает РМЖ [1]. РМЖ железы занимает первое место в структуре заболеваемости злокачественными новообразованиями среди женщин в России и составляет 21,2 на 100 тыс. женщин [2]. В Ханты-Мансийском автономном округе (ХМАО), расположенном на севере Тюменской области, заболеваемость РМЖ выше, чем в среднем по России, и составляет 26,5 на 100 тыс. женщин [3].
На фоне комплексного лечения РМЖ у больных появляется болевой синдром, который чаще обусловлен явлениями остеопороза (ОП). Причиной развития метаболических нарушений костной структуры при ОП является как влияние самой болезни, так и результат воздействия большого количества факторов, в т.ч. полихимиотерапии, гормонотерапии и хирургической кастрации, которые являются важными методами лечения РМЖ [4]. Эндокринная терапия может вызывать снижение минеральной плотности кости (МПК) за счет уменьшения уровня эстрогенов (ингибиторы ароматазы, аналоги гонадотропин-релизинг-гормона), так и путем влияния на соответствующие сигнальные пути (тамоксифен у женщин в пременопаузе). Кроме того, некоторые химиотерапевтические препараты способны оказывать прямое повреждающее действие на костную ткань, приводя к быстрому снижению МПК, а также вызывать дисфункцию яичников с развитием преждевременной менопаузы. Таким образом, комплексное лечение РМЖ приводит к развитию ОП, на фоне чего усиливается болевой синдром, ухудшая качество жизни пациентов [5].
На сегодняшний день проблема потери костной ткани в результате противоопухолевого лечения РМЖ является актуальной в подгруппе больных с большой продолжительностью жизни, которых противоопухолевая терапия (эндокринная терапия, химиотерапевтическое лечение и хирургическая кастрация) приводит к снижению уровня половых гормонов – эстрогенов. Несмотря на то что адекватная терапия ОП способна снижать частоту последующих осложнений на 40–60%, диагностика проводится менее чем 25% женщин, а соответствующую адекватную терапию получают еще меньше пациенток [1]. ОП является серьезным побочным эфектом, отрицательно влияющим на качество жизни онкологических больных, в первую очередь за счет болевого синдрома, который носит постоянный характер [6].
Цель работы – выявление взаимосвязи ОП у больных РМЖ фертильного возраста и болевого синдрома, а также повышение эффективности диагностики ОП у данной категории больных для улучшения качества их жизни.
Материал и методы
Работа основана на обследовании 157 женщин, из них 103 (65,6%) – женщины, страдавшие РМЖ, и 54 (34,4%) – женщины без РМЖ. В возрасте от 30 до 50 лет обследованы 47 больных РМЖ и 54 женщины группы сравнения. Клиническими базами для проведения исследования были БУ «Няганская окружная больница» г. Нягани и онкологический центр БУ «Окружная клиническая больница» г. Ханты-Мансийска в период с 2013 по 2015 г.
Критерии включения в обследование: больные с гистологически верифицированным диагнозом РМЖ в фертильном возрасте. Всем пациенткам была проведена остеосцинтиграфия для исключения метастазов в кости. Критериями исключения из обследования стали первично-множественные опухоли, пациентки с наличием метастазов в кости, больные, принимавшие более 3 месяцев глюкокортикоиды, высокие дозы L-тироксина, заболевания щитовидной железы, надпочечников. Критериями исключения из обследования группы контроля явились ранняя менопауза, длительный прием глюкокортикоидов, заболевания щитовидной железы, надпочечников, печени и почек.
Всем 47 пациенткам с РМЖ проведено оперативное лечение, из них 7 (14,9%) – радикальная резекция молочной железы, 18 (38,3%) пациенткам проведена неоадъювантная полихимиотерапия в связи с распространенностью процесса и с целью проведения органосохраняющей операции, 38 (80,8%) получили адъювантную полихимиотерапию, 12 (25,5%) – лучевую терапию. Гормонотерапия назначена 36 (76,6%) больным РМЖ.
Всем пациенткам с диагнозом РМЖ проведено обследование до назначения специального лечения и через полгода после проведенного лечения.
Обследование включило проведение остеоденситометрии, плотность костей определена методом DXA на денситометре EXPLORER производства Hologic (США, 2007 год). При стандартной остеоденситометрии измерялась МПК в поясничном отделе позвоночника и проксимальном отделе бедренной кости. Время, необходимое для исследования, составило 20 минут. По результатам остеоденситометрии в соответствии с рекомендациями Всемирной организации здравоозранения (2001) проведена оценка Т-критерия, результаты оценивались как нормальные при значении Т-критерия от (+2) до (-1) ББ (стандартное отклонение), остеопения – от (-1,1) до (-2,5) ББ и ОП – менее (-2,5) ББ.
 Оценка болевого синдрома проводилась с помощью Мак-Гилловского болевого опросника (R. Melzack, 1975) и по данным классификации болевого синдрома. Болевой синдром при ОП характеризуется снижением работоспособности, повышенной утомляемостью, болью в спине, в т.ч. после физической нагрузки, ощущением тяжести между лопатками, необходимостью отдыха в положении лежа. Появляются летучие боли в костях и суставах, непостоянные, усиливающиеся при смене погоды, минимальная утренняя скованность не более 30 минут, уменьшение объема движений. По данным симптомам нами составлены критерии классификации болевого синдрома.
Оценка болевого синдрома проводилась с помощью Мак-Гилловского болевого опросника (R. Melzack, 1975) и по данным классификации болевого синдрома. Болевой синдром при ОП характеризуется снижением работоспособности, повышенной утомляемостью, болью в спине, в т.ч. после физической нагрузки, ощущением тяжести между лопатками, необходимостью отдыха в положении лежа. Появляются летучие боли в костях и суставах, непостоянные, усиливающиеся при смене погоды, минимальная утренняя скованность не более 30 минут, уменьшение объема движений. По данным симптомам нами составлены критерии классификации болевого синдрома.
Были исследованы биообразцы (волосы) 157 женщин, входящих в исследование. Установлено, что волос является более подходящей тканью, чем кровь или моча, для исследования баланса микроэлементов. Определение элементного состава волос проводилось методами атомно-эмиссионной спектрометрии и масс-спектрометрии с индуктивно связанной аргоновой плазмой (АЭС-ИСП и МС-ИСП) на приборах Optima 200DV и ELAN 9000 (Perkin Elmer, CША) в Центре биотической медицины (Москва) [7]. Показатели концентрации химических элементов в волосах сравнивали с референтными значениями.
Статистическая обработка материала проведена с применением приложения Exel и Statistica 8.0, включая определение средней арифметической (M), стандартной ошибки (m), медианы (Ме), 25-го и 75-го перцентилей, оценку достоверности по Манну–Уитни и с применением χ²-критерия Пирсона с коррекцией на непрерывность по Йетсу, используемую при непараметрическом распределении изучаемых параметров. За достоверные принимали различия при значениях р<0,05.
Результаты и обсуждение
В контрольной группе женщин фертильного возраста (от 30 до 50 лет) остеопения – начальные изменения костной ткани, наблюдалась в 6 случаях, что составило 11,1%. ОП в группе сравнения не было. Клинические проявления в виде болевого синдрома 1-й степени у здоровых женщин наблюдались в 10 (18,5%) случаях.
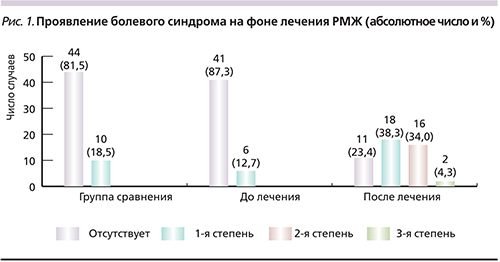
При анализе данных 47 больных РМЖ фертильного возраста болевой синдром до лечения основного заболевания определялся в 6 (12,7%) случаях. Через 6 месяцев после лечения РМЖ болевой синдром был выявлен в 36 (76,6%) случаях: в 18 – 1-й степени, в 16 – 2-й и в 2 случаях – 3-й степени (рис. 1).
Получена статистически достоверная разница появления и усиления болевого синдрома до лечения по поводу РМЖ и через 6 месяцев после проведенного лечения (р<0,01).
Пациенткам с диагнозом РМЖ была проведена остеоденситометрия: 1-я подгруппа – нормальные значения Т-критерия, 2-я подгруппа – остеопения (отклонение Т-критерия по остеоденситометрии от -1,1 до -2,5 ББ) и 3-я подгруппа – ОП (показатели остеоденситометрии менее -2,5 ББ Т-критерия).
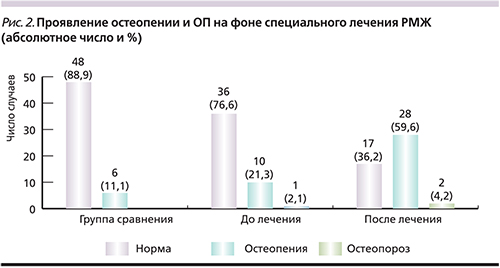
У больных РМЖ до лечения признаки остеопении и ОП наблюдались в 11 (23,4%) случаях, из них у 1 – ОП, а через полгода после проведенного лечения – в 30 (63,8%) случаях, из них 2 пациентки с ОП (рис. 2).
Среднее значение абсолютных показателей МПК женщин в исследовании до лечения составило -0,01+1,23 г/см2, уже через 6 месяцев после проведенного лечения средний показатель МПК составил -0,85+1,24 г/см2. Получены статистически значимые результаты появления ОП и остеопении после проведенного лечения по поводу РМЖ (р<0,001).
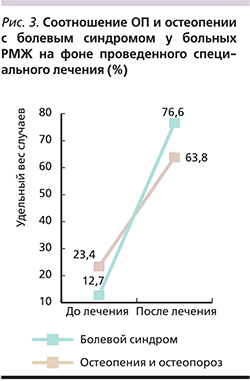
На фоне проведенного специального лечения уже через 6 месяцев у больных РМЖ фертильного возраста достоверно увеличилось число случаев развития ОП и остеопении на фоне проявления и (или) усиления болевого синдрома (рис. 3). Прямая корреляционная зависимость болевого синдрома от степени ОП и остеопении до и после проведения специального лечения подтверждена статистически (р<0,01).
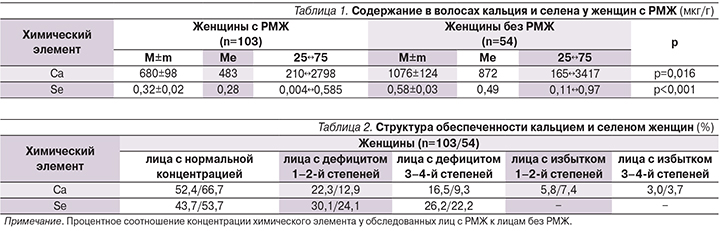
Концентрация химических элементов в волосах обследуемых лиц обеих групп находилась в диапазоне физиологически допустимых значений для здоровых лиц соответствующего возраста [8]. При сравнении концентрации в волосах химических элементов у женщин, страдавших РМЖ, по сравнению с лицами без него статистически значимые различия были выявлены нами в отношении кальция (Cа) и селена (Se) (табл. 1).
Обнаружена достоверно (р=0,016) более высокая концентрация Са в волосах женщин группы сравнения по сравнению с таковым показателем у больных РМЖ. Изменения содержания Ca в волосах также могут свидетельствовать об ОП [9, 10].
В табл. 2 показано, как были распределены обследованные нами лица по степени обеспеченности изучаемыми химическими элементами.
Обращает на себя внимание, что практически у половины женщин с РМЖ и у трети обследованных женщин без РМЖ было обнаружено нарушение обеспеченности Са. При этом дефицит разной степени выраженности характеризовал элементный статус 40 (38,8%) больных РМЖ и 12 (22,2%) женщин без РМЖ. Избыток Са обнаружен у 9 (8,8%) женщин с РМЖ и у 6 (11,1%) женщин без РМЖ (табл. 2). Избыточное содержание Са в волосах, по мнению А.В. Скального, характеризует ускоренное выведение данного биоэлемента из организма и является, по сути, стадией преддефицита [11].
Наиболее значимые достоверные (p<0,001) различия между обследованными группами женщин были выявлены в отношении главного микроэлемента антиоксидантной защиты организма человека – Se. Результаты исследований, проведенных в районах с низким потреблением Se, свидетельствуют о высоком риске онкологических заболеваний [12]. Нормальная обеспеченность Se не только является профилактикой некоторых видов рака, но и препятствует прогрессированию и метастазированию уже образовавшихся опухолей. Исследования Y.M. Shah и соавт. показали антиканцерогенный эффект Se при РМЖ. Применение Se ингибировало эстрогеновые рецепторы α (ER-α), что объясняет механизм не только превентивного действия Se у женщин с высоким риском РМЖ, но и терапевтическую обоснованность стратегии применения Se для борьбы с уже развившимся РМЖ [13].
Дефицит главного микроэлемента антиоксидантной защиты – Se –наблюдался в обеих группах женщин, но в наибольшей степени был выражен у больных РМЖ: адекватно обеспечеными Se оказались менее половины женщин с РМЖ и 29 (53,7%) пациенток без РМЖ (табл. 2).
Выводы
- ОП и остеопения у больных РМЖ фертильного возраста после комплексного лечения выявляется в 63,8% случаев, а болевой синдром – в 76,6% случаев, что подтверждено статистически (р<0,01). Имеется прямая корреляционная зависимость появления и усиления болевого синдрома от степени ОП и остеопении до и после проведения специального лечения (р<0,01).
- ОП чаще наблюдается у пациенток, которым проведено комплексное лечение с блокировкой функции яичников, т.е. с наступлением искусственной менопаузы (р<0,01). Этим пациенткам рекомендована остеоденситометрия для своевременной диагностики ОП.
- С целью профилактики и лечения РМЖ наряду с общепризнанными методами необходима оптимизация обеспеченности Са и Se женщин при помощи необходимых препаратов и обогащенных данными биоэлементами продуктов питания.



