Среди функциональных заболеваний желудочно-кишечного тракта (ЖКТ) синдром раздраженного кишечника (СРК) продолжает сохранять ведущие позиции и привлекать внимание гастроэнтерологов, поскольку служит своеобразным “эталоном” для понимания патогенетической сути функциональных заболеваний органов пищеварения, в частности кишечника, являясь наиболее распространенной и изученной патологией [9, 10, 14, 15, 20].
СРК чаще диагностируют среди лиц молодого, трудоспособного возраста, поэтому заболевание наносит большой экономический ущерб обществу как по прямым показателям затрат на медицинское обслуживание и лечение, так и по непрямым показателям, включающим компенсацию временной нетрудоспособности [9, 15].
Этиология и патогенез
Под СРК понимается функциональное расстройство кишечника, при котором боль или неприятные ощущения (дискомфорт) в животе связаны с дефекацией, изменениями частоты и характера стула или другими признаками нарушения опорожнения кишечника.
СРК в настоящий момент рассматривается как биопсихосоциальное расстройство, которое формируют два патологических механизма: психосоциальное воздействие и сенсорно-моторная дисфункция [9, 15, 18–20].
В основе психосоматического расстройства лежит нарушение нервной регуляции работы кишечника на уровне вегетативной и центральной нервной системы. Так, нарушение вегетативной иннервации внутренних органов обнаружено примерно в четверти случаев СРК. Aggarwal и соавт. показали, что вагусная дисфункция играет ведущую роль у больных СРК с преобладанием запоров. В то же время у пациентов с доминирующей диареей чаще выявляется симпатическая адренергическая дисфункция.
Доказано, что центральная нервная регуляция, в частности т. н. ось “мозг–кишка” (brain gut axis), также играет важную роль в функционировании кишки как в норме, так и в патологии. С одной стороны, повторяющиеся стрессы сопровождаются моторными расстройствами кишечника, с другой – на фоне повышенной рецепторной чувствительности в кишечнике вырабатываются афферентные стимулы, достигающие по чревному и блуждающему нервам центральных подкорковых и корковых отделов ЦНС, в свою очередь изменяющих их функциональную деятельность. При этом в патологический процесс вовлекается интрамуральная нервная система кишечника, нарушается выработка некоторых интестинальных гормонов (интестинального полипептида, холецистокинина, мотилина и др.) и биогенных аминов (гистамина, серотонина, имеющих отчасти микробное происхождение; брадикинина), что усугубляет изменения в рецепторном аппарате кишечника.
Особое место в формировании функциональной патологии отводится сенсорно-моторной дисфункции, в основе которой лежит изменение висцеральной чувствительности, которая в настоящее время рассматривается в качестве первичного механизма, отвечающего за возникновение и интенсивность болевого синдрома при СРК. При этом изменение висцеральной чувствительности имеет два аспекта: 1) усиливается восприятие боли (повышенная чувствительность к болевым стимулам и ощущению боли, вызванное неболевыми стимулами – гипералгезия); 2) нарушается двигательная активность кишечника, вызываемая болевыми воздействиями (аллодиния).
Одним из факторов формирования сенсорно-моторной дисфункции, привлекающим в настоящее время внимание исследователей, являются стойкие нейроиммунные повреждения, которые развиваются после инфекционных заболеваний кишечника, чаще вызванных Campylobacterjejuni, Escherichiacoli, Shigella, Salmonella и вирусами. При этом реализуются генетическая предрасположенность к возникновению постинфекционного СРК и другие факторы риска (женский пол, стресс в течение года после инфекции, поведенческие факторы, продолжительная диарея, отсутствие рвоты, возраст менее 60 лет, склонность к соматизации, лечение инфекции антибиотиками).
В последние годы все большее внимание уделяется роли нарушений собственной кишечной флоры, вызванных различными причинами (стресс, инфекционные заболевания и др.), в развитии и поддержании клинических симптомов СРК, реализуемых ее метаболитами, в частности короткоцепочечными жирными кислотами (КЖК) [1–3, 5, 7, 24]. В литературе имеется немало данных о прямом воздействии КЖК на гастроинтестинальную моторику. В экспериментах in vitro Т. Yajima (1985) [24] показал влияние аппликаций пропионовой, масляной, валериановой кислот на сократительную активность изолированных сегментов толстой кишки, объяснив полученные данные прямым воздействием КЖК на моторику посредством местных рефлексов.
Наши результаты изучения содержания КЖК в кале in vivo [1, 2] подтверждают данную концепцию; а именно: увеличение (при СРК с преобладанием диареи) или уменьшение (СРК с преобладанием запора) концентраций кислот соотносится с типом моторно-эвакуторных расстройств. Кроме того, нами установлено изменение качественного состава КЖК при различных вариантах СРК, что указывает на увеличение активности аэробного звена микрофлоры, продуцирующего уксусную кислоту, при СРК с преобладанием запора и строгих анаэробов – продуцентов пропионовой и масляной кислот при СРК с преобладанием диареи. Данный факт можно объяснить стрессовым воздействием на эпителий кишечника, когда происходит переключение метаболизма колоноцитов с цикла Кребса на анаэробный вариант гликолиза и активацию гексозомонофосфатного шунта, что нарушает трофическую базу колоноцитов.
Существуют другие работы, подтверждающие влияние КЖК на сократительную активность кишечника. В 1995 г. C. Cherbut и соавт. [24] провели исследование, заключающееся в индукции с помощью КЖК сокращений конечного изолированного сегмента подвздошной кишки крыс и оценке влияния различных фармакологических препаратов на данный эффект. Выявленное сокращение не блокировалось атропином, демонстрируя отсутствие связи с холинергическим путем, но полностью купировалось верапамилом. Этот результат свидетельствует, что сократительный эффект КЖК, очевидно, опосредуется кальций-зависимым миогенным механизмом [8]. Как известно, активация кальциевых каналов – это “конечный общий путь” всех механизмов регуляции перистальтики ЖКТ. Наши данные [1, 2] по изучению КЖК подтверждают данную концепцию.
Активно обсуждается роль других метаболитов микрофлоры в формировании клинической картины СРК. В частности, речь идет о γ-аминомасляной кислоте (ГАМК) – антистрессорном медиаторе, который продуцируется бактериальной микрофлорой и образует единый пул с эндогенной фракцией ГАМК. Изменение уровня ГАМК у больных СРК, возможно, объясняют наличие низких порогов возбуждения, склонность к повышенной возбудимости и тревожности, понижение порога болевой чувствительности у данной группы пациентов по сравнению со здоровыми лицами.
Достаточно хорошо изучены психосоциальные факторы, участвующие в формировании симптомов СРК: эмоциональное, сексуальное и физическое насилие; стрессовые ситуации; хронический социальный стресс и тревожные расстройства; дезадаптивное копинговое поведение. При этом стресс, определяемый как триггерное звено развития психосоматических заболеваний, представляет собой не совокупность средовых воздействий, а внутреннее состояние организма, при котором осложняется реализация его интегративных функций.
В патогенезе СРК обсуждается также роль пищевой аллергии и пищевой непереносимости.
Таким образом, СРК в настоящее время рассматривается как многофакторное заболевание, в патогенезе которого участвуют генетические, биологические, социальные и психосоциальные факторы (рис. 1).
Диагноз
Диагноз СРК, согласно Римским критериям III (2006) [20], может быть поставлен при наличии рецидивирующей абдоминальной боли (или дискомфорта), продолжающейся по крайней мере 3 дня и более в месяц на протяжении последних 3 месяцев в сочетании минимум с двумя из следующих признаков:
• улучшение состояния после дефекации;
• начало связано с изменением частоты стула;
• начало связано с изменением формы кала.
Дополнительными симптомами являются патологическая частота стула (< 3 раз в неделю или > 3 раз в день); патологическая форма стула (комковатый/твердый стул или жидкий/водянистый стул); натуживание при дефекации; императивный позыв или чувство неполного опорожнения; выделение слизи и вздутие.
Согласно Римским критериям III (2006), рекомендуется использовать классификацию СРК, основанную только на преобладающей характеристике стула, используя Бристольскую шкалу формы кала (рис. 2).

В настоящее время выделены следующие типы СРК:
1. СРК с запором – при наличии твердого или бобовидного кала при > 25 % из общего числа опорожнений кишечника, однако допускается и наличие разжиженного (кашицеобразного) или водянистого кала при < 25 % из общего числа опорожнений кишечника.
2. СРК с диареей, при котором имеет место кашицеобразный или водянистый кал при > 25 % из общего числа опорожнений кишечника, однако допускается и наличие твердого или бобовидного кала при < 25 % из общего числа опорожнений кишечника.
3. СРК смешанного типа, при котором имеет место чередование твердого или бобовидного кала и кашицеобразного или водянистого кала при < 25 % из общего числа опорожнений кишечника.
4. Неклассифицированный СРК – недостаточная выраженность отклонений консистенции кала для вышеуказанных типов.
Лечение
Различия в патогенезе и клинической характеристике СРК предполагают разные подходы к ведению больных [9–11, 13, 16, 21]. Причем для выбора адекватного лечения (интенсивность, продолжительность, поддерживающая терапия) необходима также оценка степени тяжести больных СРК (табл. 1).
Лечение больных СРК (согласно рекомендациям Римских критериев III) включает как общие мероприятия (нормализация образа жизни, установление правильных взаимоотношений между врачом и пациентом, соблюдение диеты, причем выбор пищевых продуктов зависит от варианта СРК), так и назначение лекарственных средств, применение методов психотерапии. Ключевым компонентом лечения больных СРК является фармакотерапия.
С целью купирования абдоминального болевого симптома могут быть использованы различные средства [4, 12, 16], при этом основными направлениями являются нормализация моторных расстройств; снижение висцеральной чувствительности; коррекция механизмов восприятия боли.
В рекомендациях по лечению (Римские критерии III) в разделе клинического симптома “боль в животе” на первом месте указаны спазмолитики (табл. 2). Следует отметить, что они играют ведущую роль и в нормализации моторно-эвакуаторной функции толстой кишки и акта дефекации. Поскольку наиболее частым патофизиологическим механизмом в развитии абдоминальной боли является спазм гладких мышц органов брюшной полости, для ее купирования используются релаксанты гладкой мускулатуры, включающие несколько групп препаратов, различающихся по основному механизму воздействия на этапы сокращения мышечного волокна [4, 16].
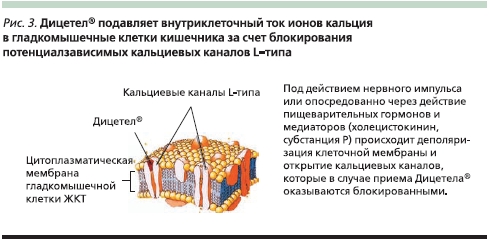
Известно, что сократительная функция мышечного волокна находится в прямой пропорциональной зависимости от концентрации цитозольного Са2+. Одним из условий, необходимых для сокращения мышечного волокна, является высокая активность фосфодиэстеразы, которая участвует в расщеплении цАМФ и обеспечении энергией процессов соединения актина с миозином. Транспорт ионов кальция через клеточные мембраны осуществляется через специальные каналы, представленные встроенными в мембрану клетки макромолекулярными белками, содержащими распознающие ионы кальция рецепторы (кальциевые или медленные каналы).
В регуляции транспорта ионов кальция участвует ряд нейрогенных медиаторов – ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку. Ионы Ca2+, поступившие в цитоплазму из внеклеточного пространства и внутриклеточных депо связываются кальмодулином с последующей активацией киназы легких цепей миозина и его взаимодействием с актином, что приводит к мышечному сокращению.
Расслабление мышечного волокна опосредуется медиатором симпатической нервной системы норадреналином. Последний через активизацию α1-рецепторов наружной мембраны миоцитов приводит к открытию быстрых ионных каналов и утечке положительно заряженных ионов из клетки и ее гиперполяризации. В условиях нарастания мембранного потенциала прекращают функционирование медленные кальциевые каналы, концентрация цитозольного кальция резко падает и наступает релаксация мышечного волокна. В регуляции моторики ЖКТ существенную роль играет серотонин. Выделяют несколько подтипов серотониновых рецепторов (5-НТ1-4), из которых наиболее изучены 5-НТ3 и 5-НТ4. Связывание серотонина с 5-НТ3-рецепторами способствует расслаблению, а с 5-НТ4-рецепторами – сокращению мышечного волокна. Определенное значение в регуляции моторной функции органов ЖКТ отводится эндогенным опиоидам. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-опиоидными рецепторами – замедление моторики пищеварительного тракта.
В зависимости от основного механизма воздействия на этапы сокращения мышечного волокна выделяют группы мышечных релаксантов, представленные в табл. 3.
Существуют комбинированные препараты, например Метеоспазмил, содержащий в своем составе регулятор моторики, блокатор серотониновых рецепторов и симетикон.
Однако наиболее патогенетически обоснованными в лечении СРК (по данным различных исследований, представленных выше) являются блокаторы кальциевых каналов, в частности пинаверия бромид (Дицетел), в связи с выраженной эффективностью и практически отсутствующими побочными эффектами.
Пинаверия бромид (Дицетел) – это агонист кальция с высокоселективным спазмолитическим действием в отношении гладких мышц кишечника, что определяет его терапевтическое применение при боли в животе, кишечной дисфункции и кишечном дискомфорте, обусловленных СРК, у взрослых.
Пинаверия бромид был зарегистрирован в 1975 г., и с тех пор во всем мире препарат ежегодно назначается примерно 3 млн пациентов. В настоящее время он используется более чем в 60 странах.
Пинаверия бромид (Дицетел) обладает уникальным двойным механизмом действия: подавляет гипермоторику и снижает гиперчувствительность кишечника. Эффект пинаверия бромида на двигательную активность ЖКТ обусловлен его свойствами антагониста кальция. Препарат подавляет внутриклеточный ток ионов кальция в гладкомышечные клетки кишечника за счет блокирования потенциал-зависимых кальциевых каналов L-типа на уровне α1-субъединицы, которая соответствует расположению дигидропиридинового рецептора и локализуется вблизи наружной поверхности плазматической мембраны (рис. 3). Кроме того, значительное количество экспериментальных исследований на животных указывает на то, что пинаверия бромид эффективно влияет на висцеральную чувствительность. Подтверждением тому являются:
• прямые данные – снижение афферентной импульсации по блуждающему нерву и уменьшение выраженности боли в животе в ответ на растяжение прямой кишки при наличии воспалительного процесса;
• наблюдения, которые демонстрируют вовлеченность афферентных желудочно-кишечных нервов в механизм действия пинаверия бромида, – устранение эффектов препарата на постпрандиальную моторику толстой кишки после деструкции афферентных нейронов капсаицином;
• фармакологическая активность в отношении передачи ноцицептивных импульсов – свойствами антагониста кальция (кальций задействован в механизмах хронической боли воспалительного генеза), устранением эффектов холецистокинина на моторику ЖКТ.
В отличие от традиционных блокаторов кальциевых каналов пинаверия бромид не обладает клинически значимой активностью вне ЖКТ.
На протяжении последних 20 лет эффективность пинаверия бромида была продемонстрирована в 8 двойных слепых плацебо-контролируемых исследованиях. Препарат также был изучен в сравнении с другими лекарственными средствами, применяемыми в лечении СРК. Eго эффективность была подтверждена в широком спектре открытых и долгосрочных исследований (в общей сложности пинаверия бромид изучен более чем у 6400 пациентов). Во всех работах пинаверия бромид хорошо переносился с минимальным количеством побочных эффектов.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей, что также нашло отражение врекомендациях по лечению (табл. 3). В настоящее время широко обсуждается возможность использования ряда препаратов (антидепрессантов, антагонистов 5-НТ3-рецепторов, агонистов κ-опиоидных рецепторов, аналога соматостатина октреотида).
Проведенный различными авторами мета-анализ контролируемых исследований подтвердил достоверно более высокую эффективность трициклических антидепрессантов и СИОЗС в отношении уменьшения выраженности болей в животе и диареи по сравнению с плацебо. Благоприятный эффект данных препаратов объясняется, с одной стороны, снижением уровня депрессии и тревоги на фоне их приема, с другой – способностью антидепрессантов непосредственно уменьшать выраженность кишечных симптомов за счет влияния на ось “головной мозг–кишечник” [17, 23]. Тесная связь депрессии с абдоминальной болью объясняется общими биохимическими процессами, в первую очередь недостаточностью моноаминергических (серотонинергических) механизмов, что подтверждается высокой эффективностью антидепрессантов (особенно СИОЗС). Однако с учетом необходимости их длительного (в течение нескольких месяцев) приема, достаточно высокой частотой побочных эффектов (в первую очередь со стороны ЦНС) данные препараты показаны прежде всего больным с тяжелыми резистентными формами заболевания.
В рекомендациях III Римского консенсуса по лечению больных СРК указаны также препараты для восстановления частоты и консистенции стула (табл. 3), однако их доступность может различаться в разных странах [10, 13].
Например, для регуляции моторно-эвакуаторной функции кишечника могут быть использованы и агонисты периферических серотониновых рецепторов (тегасерод и др.) – при запоре, и их антагонисты (алосетрон, силансетрон и т. д.) – при диарее. В России данных препаратов нет, но за рубежом они или их аналоги в ряде случаев (в основном в отсутствие эффекта от спазмолитических препаратов) применяются. В тех же случаях или для усиления эффективности лечения при диарейном варианте СРК может быть использован лоперамид.
В лечении больных СРК с преобладанием запоров эффективны слабительные средства, такие как псиллиум (Мукофальк), лактулоза (Дюфалак) и макроголь (Форлакс), зарегистрированные в России. Причем преимущество отдается первым двум, т. к. наряду со слабительным эффектом данные препараты обладают выраженным пребиотическим эффектом.
Необходимо отметить, что псиллиум в связи с присущим ему выраженным сорбционным эффектом может быть с успехом использован и при лечении больных СРК с преобладанием диареи, заменяя предложенный Римским консенсусом III холестирамин.
Когда в клинике СРК преобладают жалобы на вздутие и метеоризм, при адекватной оценке роли газообразования в каждом конкретном случае показано назначение препаратов, механизм действия которых основан на ослаблении поверхностного натяжения пузырьков газа в пищеварительном тракте, что обеспечивает резорбцию и свободное выделение газов. Одним из таких препаратов является Эспумизан (основное действующее вещество – симетикон).
Коррекция микробиоценоза кишечника отечественными исследователями и врачами отнесена к основным принципам лечения СРК [3, 10, 11, 13]. Это в первую очередь связано с тем, что воздействие на микрофлору кишечника приводит к восстановлению рецепторного аппарата последнего, что в свою очередь сопровождается повышением эффективности других методов лечения.
Для восстановления эубиоза применяют препараты:
• пробиотики – живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию его микроэкологического статуса;
• пребиотики – препараты или биологически активные добавки немикробного происхождения, неперевариваемые в кишечнике, способные оказывать позитивный эффект на организм через стимуляцию роста и/или усиление метаболической активности нормальной микрофлоры кишечника.
Доказана эффективность использования бифидо- и лактосодержащих пробиотиков в лечении пациентов, страдающих СРК [3, 11, 13, 25]. Это объясняется их способностью потенцировать эффект действия основных лечебных препаратов (регуляторов моторики и т. д.).
Большую перспективу в деле использования имеют препараты-пробиотики, содержащие не культуру бактерий, а вещества микробного происхождения, выступающие в роли своеобразных ”сигнальных молекул” (например, Хилак форте), или комбинацию культуры бактерий с веществами микробного происхождения.
В ряде случаев (при наличии синдрома избыточного бактериального роста) проводят деконтаминацию условно-патогенной флоры, используя в основном невсасывающиеся кишечные антибиотики (рифаксимин – Альфа нормикс) или антисептики (нифуроксазид Энтерофурил и др.).
При изменении микробиоценоза, в основном в толстой кишке, с успехом применяются препараты с пребиотическим эффектом (псиллиум и др.), фруктоолиго- и полисахариды, лактулоза (Дюфалак) и др. Их преимущество (кроме стимуляции собственной индигенной флоры) заключается в возможности пролонгированного (даже постоянного) использования.
В лечении больных, рефрактерных к обычно применяемым препаратам, могут оказаться эффективными различные психотерапевтические методы [17, 21], которые должны проводиться опытными психиатрами (в идеальном варианте – хорошо знающими гастроэнтерологические аспекты СРК).
Для оценки эффективности лечения целесообразно использовать критерии, основанные на прекращении симптомов болезни или уменьшении их интенсивности: нормализация моторики, купирование болевого и диспепсического синдромов; продолжительность ремиссии; улучшение самочувствия (частичная ремиссия).


