Язвенный колит (ЯК) – это хроническое заболевание толстой кишки, проявляющееся неспецифическим воспалением в ее слизистой оболочке. Периоды обострения при ЯК характеризуются кишечными кровотечениями, диареей, болями в животе, тенезмами и запорами (при дистальных поражениях) [1]. В период ремиссии интенсивность симптоматики уменьшается либо она исчезает полностью.
В некоторых случаях после проведенного лечения пациент с ЯК продолжает предъявлять жалобы на учащение стула (или запоры), боли в животе, вздутие, урчание. В отсутствие данных объективного обследования (колоноскопия, компьютерная томография) подобная симптоматика может наводить на мысль о наличии сохраняющегося воспаления в толстой кишке. Однако если обследование все-таки проводится, то чаще в толстой кишке пациента наблюдается эндоскопическая ремиссия. В этих случаях можно говорить, что на фоне ремиссии ЯК пациент предъявляет жалобы на наличие симптоматики, подобной при синдроме раздраженного кишечника (СРК) [3].
Возможных причин возникновения СРК-подобных симптомов может быть несколько. Наиболее часто это наличие микроскопического воспаления в слизистой оболочке толстой кишки, сохраняющееся иммунное воспаление [27], психоэмоциональный стресс, а также изменения в микрофлоре желудочно-кишечного тракта.
J. Keohane и соавт. [4] оценивали частоту встречаемости СРК-подобных симптомов у больных с воспалительными заболеваниями кишечника в фазу ремиссии и их корреляцию с уровнем фекального кальпротектина. В результате соответствие Римским критериям-II было отмечено у 17 из 44 (38,6%) пациентов с ЯК. Уровень фекального кальпротектина был повышен в обеих группах, однако более выраженное повышение его уровня отмечено в группе пациентов с наличием СРК-подобной симптоматики, в связи с чем был сделан вывод, согласно которому причиной СРК-подобных симптомов может служить сохраняющееся неспецифическое воспаление.
Облигатная микрофлора кишечника способна формировать естественный барьер для патогенных микроорганизмов. В связи с этим любое ее количественное или качественное изменение может приводить к нарушению просветной экосистемы, включающей, с одной стороны, полноценное сообщество микробов-резидентов, с другой – нормальный формируемый здоровыми эпителиоцитами гликокаликс с адекватным количеством муцина.

В норме в двенадцатиперстной и тощей кишке общее количество микроорганизмов составляет 102–104 КФЕ (колониеформирующих единиц)/г химуса; в подвздошной и толстой кишке – порядка 1010 КФЕ/г содержимого и 1010–1012 КФЕ/г содержимого соответственно. Дисбиоз толстой кишки проявляется в дефиците бифидо- и лактофлоры и росте количественного содержания различных условно-патогенных микроорганизмов.
Микрофлора при ЯК может играть определенную роль в патогенезе и влиять на его течение:
- патогенные микроорганизмы (например, Cl. difficile) могут вызывать обострения ЯК, ухудшать клиническую и эндоскопическую картину ЯК;
- при наличии тяжелой атаки ЯК возможна транслокация микроорганизмов через кишечную стенку, что может приводить к сепсису;
- патогенная и условно-патогенная флора может приводить к формированию резистентности к терапии кортикостероидами и аминосалицилатами;
- патогенная микрофлора может приводить к усилению симптоматики при активном воспалении, а также при эндоскопической ремиссии ЯК.
Существуют различные методы коррекции микрофлоры, например, с помощью про-, пре-, симбиотиков и фекальных клизм. При ЯК часто используют антибактериальные препараты [13]. Возможным вариантом терапии может стать применение, например, рифаксимина-альфа [16].
Рифаксимин-альфа (Альфа Нормикс) имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий. Рифаксимин-альфа демонстрирует практически полное отсутствие всасывания в желудочно-кишечном тракте. Это было убедительно доказано в экспериментальных исследованиях на животных, а затем в клинических исследованиях у здоровых добровольцев и пациентах с заболеваниями кишечника. Всасыванию рифаксимина-альфа препятствует наличие в его молекуле пиридоимидазо-группы, электрический заряд и ароматическое кольцо которой препятствуют прохождению через эпителий кишечника. Установлено, что при пероральном приеме рифаксимина-альфа натощак, в крови обнаруживается не более 0,4% от принятой дозы. Минимальное всасывание действующего вещества в плазму крови снижает риск возникновения системных побочных эффектов, внекишечных лекарственных взаимодействий с другими препаратами, а у пациентов с заболеваниями печени и почек нет необходимости в коррекции дозы. В последние десятилетия эффективность рифаксимина-альфа активно изучалась в зарубежных и Российских плацебо-контролируемых исследованиях, в том числе в лечении ВЗК [17]. Однако до настоящего времени ни разу не проводилось исследований, которые позволили определить, насколько рифаксимин-альфа эффективен в коррекции симптомов СРК на фоне эндоскопической ремиссии ЯК.
Целью нашей работы стало определение эффективности препарата рифаксимин-альфа (Альфа Нормикс) в терапии пациентов с эндоскопической ремиссией ЯК и наличием СРК-подобной симптоматики.
Материал и методы
В исследование были включены 37 пациентов с подтвержденным диагнозом ЯК, наблюдавшихся в ФГБУ ГНЦК МЗ РФ в 2012–2013 гг. С помощью эндоскопических методов исследования (колоно-, ректороманоскопия) была констатирована ремиссия воспалительного процесса. Возраст пациентов колебался от 18 до 65 лет (средний возраст – 33,51+/-11,36). Женщин было 20 (54%), мужчин – 17 (46%).
По распространенности поражения тотальный язвенный колит отмечен у 24 (65%) пациентов, левосторонний – у 13 (35%). У всех оценивалась частота встречаемости жалоб на СРК-подобные симптомы (боль в животе, усиливающаяся перед дефекацией и стихающая после нее, вздутие живота, примесь слизи в стуле, чувство неполного опорожнения прямой кишки). Изучалось также качество жизни с помощью опросника, оценивающего качество жизни пациентов с СРК – IBS-QOL (Irritable Bowel Syndrome – Quality of Life). Данный опросник включает 34 вопроса, ответ на каждый из которых оценивается по пятибалльной системе. Затем ответы суммируются и трансформируются в шкалу от 0 до 100%: чем выше показатель, тем лучше качество жизни. Перерасчет производится по формуле:
Результат=(сумма всех ответов – наименьшая возможная сумма ответов)/возможный диапазон исходной оценки*100.
Для оценки уровня депрессии использовался опросник Бека (Beck Depression Inventory – BDI). Этот опросник состоит из 21 группы утверждений. При ответе на каждый вопрос начисляется от 0 до 3 баллов (табл. 1).
Всем пациентам выполнен анализ кала на дисбактериоз. В составе облигатной микрофлоры оценивалось количество бифидо- и лактобактерий методом посева, а также присутствие условно-патогенных микроорганизмов транзиторной флоры методом разведений и ИФА (анализ на токсины А и В Cl. difficile).
После проведенного обследования всем 37 пациентам проведена терапия антибиотиком с минимальным всасыванием – рифаксимин-альфа (Альфа-Нормикс) в дозе 800 мг в сутки в течение 9 дней. После лечения оценены частота встречаемости СРК-подобных симптомов, качество жизни и состав просветной микрофлоры толстой кишки.
Результаты
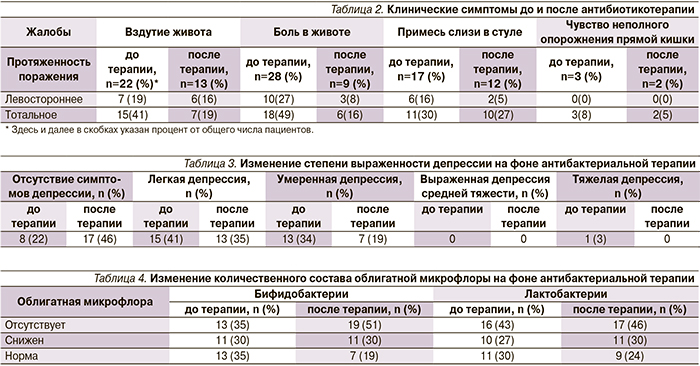
Частота дефекаций на фоне лечения сократилась с 5,11+/-2,73 до 2,52+/-1,29 раза (р<0,05) в сутки. Все пациенты с ремиссией ЯК до лечения предъявляли жалобы на различные симптомы, характерные для проявлений СРК: вздутие живота, боль, усиливающаяся перед дефекацией и стихающая после нее, наличие примеси слизи в стуле, чувство неполного опорожнения прямой кишки. На фоне антибактериальной терапии рифаксимином-альфа число жалоб значительно сократилось. Клинические проявления на фоне лечения рифаксимином-альфа представлены в табл. 2.
При оценке качества жизни с помощью опросника IBS-QOL в исследуемой группе пациентов результат колебался от 20 до 65% (среднее значение – 35,29+/-11,13), однако на фоне терапии присутствовала тенденция к увеличению показателя качества жизни до 40,81+/-11,09 балла (показатели колебались в промежутке от 20 до 62%).
При оценке уровня депрессии по шкале BDI до и после терапии отмечено изменение соотношения числа пациентов с различной степенью выраженности депрессивных расстройств. Так, если до терапии отсутствие депрессивных расстройств имело место у 8 (22%) пациентов, то после терапии количество пациентов без депрессивных расстройств увеличилось до 17(46%). Легкая депрессия, отмечавшаяся до терапии у 15 (41%) пациентов, после терапии осталась приблизительно у такого же числа пациентов – у 13 (35%). Число пациентов с умеренной депрессией с 13 (34%) до терапии после терапии уменьшилось до 7 (19%). Показателей, соответствующих выраженной депрессии средней тяжести, не было ни у одного пациента ни до, ни после терапии. Тяжелая депрессия, которая до лечения была выявлена у 1 (3%) пациента, после проведенной терапии отсутствовала (табл. 3).
У всех пациентов оценивалось количество бифидо- и лактобактерий до и после терапии. С этой целью пациенты были условно разделены на 3 группы: группа с нормальным количеством бактерий (бифидобактерии – 108–109 КОЕ/г, лактобактерии 106–107 КОЕ/г), группа с отсутствием облигатных микроорганизмов и группа со снижением их количества. Полученные данные представлены в табл. 4.
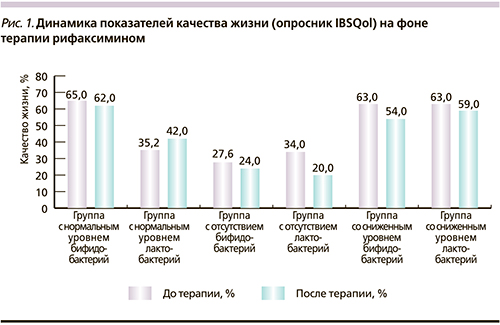
В каждой группе оценивался уровень качества жизни по опроснику IBSQoL. Статистически достоверных различий получено не было (см. рис. 1).
Не отмечено статистически значимой связи между протяженностью поражения ЯК и количеством лакто- и бифидобактерий. Также не отмечено корреляции между количеством лакто- и бифидобактерий и уровнем качества жизни, однако обращал на себя внимание тот факт, что в отсутствие бифидобактерий имели место более низкие показатели уровня качества жизни по сравнению с остальными группами (21 балл при среднем показателе 35,29+/-11,13 до терапии и 40,81+/-11,09 балла после).
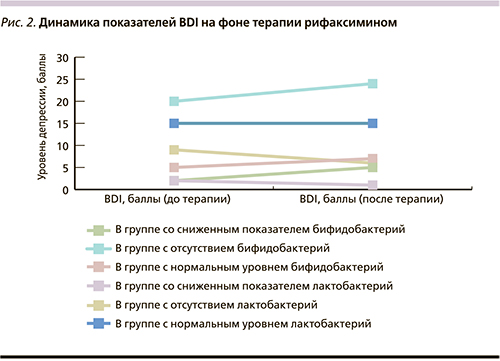
Оценивался уровень депрессии на фоне терапии рифаксимином-альфа в группах с различным содержанием облигатных микроорганизмов. Не отмечено статистически значимого снижения уровня депрессивного расстройства у пациентов с различным количеством облигатных микроорганизмов в кишечнике. Кроме того, нет взаимосвязи между степенью выраженности депрессии и количеством облигатных микроорганизмов. Полученные результаты представлены на рис. 2.
Не отмечено статистически значимой связи между протяженностью поражения ЯК и количеством бифидобактерий, а также корреляции между количеством бифидобактерий и уровнем качества жизни, однако обращал на себя внимание тот факт, что в отсутствие бифидобактерий отмечены более низкие показатели уровня качества жизни по сравнению с остальными группами (21 балл при среднем показателе 35,29+/-11,13 до терапии и 40,81+/-11,09 баллов после).
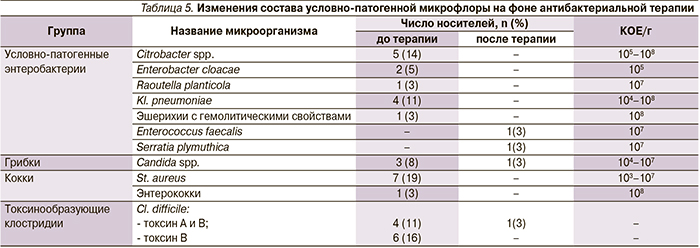
Оценивалось также количество и состав условно-патогенных энтеробактерий (табл. 4). До терапии у 10 (27%) пациентов отклонений от нормы выявлено не было, у 27 (73%) выявлены различные патогенные микроорганизмы. После проведенного лечения 34 (92%) пациентов наличия патогенных организмов и условно-патогенных в высоком титре выявлено не было. У 3 (8%) пациентов были выявлены изменения в составе микрофлоры.
Отмечена взаимосвязь между протяженностью поражения ЯК и наличием токсинов Cl. difficile А и В. Так, до лечения среди пациентов с отсутствующими в просветной микрофлоре бифидобактериями у 4 определен токсин А и В Cl. difficile, у 1 – токсин В. При снижении уровня бифидобактерий у 2 определен токсин В Cl. difficile, у пациентов с нормальным содержанием бифидобактерий у 3 определен токсин В. Протяженность поражения ЯК была тотальной для всех пациентов с выявленными токсинами Cl. difficile.
У 2 пациентов, в составе просветной флоры которых не определены лактобактерии, выявлены токсины А и В Cl. difficile, у 2 – токсин В. При снижении уровня лактобактерий у 2 пациентов был выявлен токсин В Cl. difficile. При нормальном содержании лактобактерий у 3 пациентов также выявлен токсин В, у 1 – токсины А и В. У этого пациента было левостороннее поражение, у всех остальных – тотальное. Единственный выявленный случай носительства токсина Cl. difficile после проведенной терапии был выявлен при нормальных показателях бифидо- и лактобактерий у пациента с тотальной протяженностью ЯК.
Обсуждение
Полученные данные позволяют выявлять некоторые закономерности в изменениях микрофлоры и проявлениях СРК-подобной симптоматики у пациентов с эндоскопической ремиссией ЯК. Так, вздутие живота, боли, примесь слизи в стуле и чувство неполного опорожнения прямой кишки считаются часто встречающимися жалобами со стороны пациентов в отсутствие эндоскопической активности ЯК. В оцениваемой нами группе каждый пациент имел одну или несколько подобных жалоб. До начала терапии обращало на себя внимание увеличение частоты дефекаций.
По критериям Truelove и Witts при ремиссии ЯК частота стула составляет менее 3 раз в сутки, в стуле не отмечается примеси крови (2). В нашем исследовании среднее число дефекаций в сутки составило 5,11+/-2,73 при условии отсутствия примеси крови в стуле.
Возможно, наличие подобных жалоб объясняется изменениями в просветной микрофлоре кишечника. В норме порядка 90% просветной флоры должны составлять бифидо- и лактобактерии, тогда как 10% должны приходиться на условно-патогенные микроорганизмы [21]. В проведенном нами исследовании выявлено, что по содержанию бифидо- и лактобактерий пациенты разделились на 3 приблизительно равные группы. Так, у трети пациентов уровень бифидо- и лактофлоры был нормальным, у трети – снижен, у остальных бифидо- и лактобактерии полностью отсутствовали. Если сравнить данные подгруппы между собой, в частности, по уровню качества жизни и выраженности депрессивных расстройств, обращает на себя внимание следующая тенденция: при полном отсутствии облигатной микрофлоры выявлен самый низкий уровень качества жизни. При оценке депрессивных расстройств, напротив, полное отсутствие симптомов депрессии отмечается у пациентов со снижением уровня облигатной флоры. В среднем уровень качества жизни был достаточно низким: 35,29+/-11,13% при максимально возможном результате 100%. Наличие депрессивных расстройств различной степени выраженности наблюдалось у 29 из 37 пациентов.
Довольно разнообразен состав условно-патогенной микрофлоры кишечника, выявленный у данной группы пациентов. К наиболее часто встречающимся микроорганизмам относятся золотистый стафилококк (7 пациентов), Citrobacter spp. (5 пациентов). Но все же самым частым остается носительство клостридий [26]. Так, у 4 пациентов выявлены токсины А и В Cl. difficile, у 6 – токсин В.
Частота встречаемости токсинов клостридии зависела от протяженности ЯК. Так, на фоне тотального ЯК встречались токсины А и В Cl. dfficile в различных сочетаниях (9 пациентов), тогда как при левостороннем поражении только в 1 случае имело место наличие вышеозначенных токсинов. После проведенной антибактериальной терапии только у 1 пациента с тотальным язвенным колитом продолжали выявляться токсины В Cl. difficile. На фоне проведенной антибактериальной терапии состав просветной условно-патогенной флоры значительно изменился: всего у 4 пациентов отмечалось наличие патогенных микроорганизмов в стуле. Cl. dfficile, сохранялся только у 1 пациента с исходным тотальным ЯК.
В исследовании была выявлена корреляция количества бифидо- и лакто- бактерий с качеством жизни и степенью выраженности депрессивных симптомов: при полном отсутствии облигатной микрофлоры отмечался самый низкий уровень качества жизни, тогда как при снижении уровня бифидо- и лактобактерий – полное отсутствие депрессивных симптомов. Это косвенным образом может быть объяснено тем фактом, что есть работы, доказывающие влияние бифидо- и лактобактерий на нормализацию показателей тревожности и депрессивности [25].
Исходя из средних цифр, уровень качества жизни на фоне терапии улучшился: с 35,29+/-11,13% до 40,81+/-11,09%. При этом число пациентов с признаками депрессивного расстройства значительно уменьшилось и стало составлять всего 54% (19 пациентов из 37 по сравнению с исходными 29).
Состав просветной условно-патогенной флоры тоже значительно изменился: всего у 4 пациентов отмечено наличие патогенных микроорганизмов в стуле. Самый часто встречающийся микроорганизм, Cl. difficile, сохранился только у 1 пациента с исходным тотальным ЯК.
На фоне выявленных подобных изменений менялась и клиническая картина: значительно (на 2/3) уменьшилось количество жалоб, предъявляемых на наличие СРК-подобной симптоматики. По сравнению с исходным количеством уменьшилось число дефекаций: с 5,11+/-2,73 до 2,52+/-1,29 (р<0,05).
Таким образом, можно сделать следующие выводы: состав микрофлоры кишечника в значительной степени влияет на наличие жалоб и качество жизни пациента. Так, у 27 (73%) пациентов с ремиссией язвенного колита и проявлениями СРК-подобной симптоматики были обнаружены патогенные и условно-патогенные микроорганизмы различных групп (кокки, энтеробактерии, грибки). При этом пациенты предъявляли жалобы на наличие симптомов, сходных с СРК: 22 (59%) пациента предъявляли жалобы на вздутие живота, 28 (76%) – на боль в животе, 17 (46%) – на наличие примеси слизи в стуле; 3 (8%) – на чувство неполного опорожнения прямой кишки. У этих пациентов отмечено низкое качество жизни (согласно опроснику IBS-QOL) и высокий уровень депрессивных проявлений (шкала BDI).
На фоне курса терапии невсасывающимся кишечным антибиотиком с минимальным всасыванием широкого спектра действия рифаксимином-альфа в дозе 800 мг в сутки в течение 9 дней была отмечена выраженная положительная динамика: частота стула снизилась с 5,1 до 2,5 раз в сутки; улучшилось качество жизни и снизился уровень депрессии; значительно снизилась частота жалоб на СРК-подобную симптоматику.



