Среди функциональных заболеваний кишечника синдром раздраженного кишечника (СРК) по праву продолжает сохранять ведущие позиции и привлекает внимание гастроэнтерологов всего мира [6, 9]. Частота СРК в общей популяции населения колеблется от 8 до 30 % [2, 12]. При этом следует учитывать, что 2/3 лиц, отмечающих симптомы СРК, к врачам не обращаются [4]. Пик заболеваемости приходится на молодой трудоспособный возраст – 30–40 лет [13, 14].
Высокая частота СРК и поражение им лиц наиболее трудоспособного возраста определяют существенную клиническую и социальную значимость данного синдрома. Заболевание наносит как прямой экономический ущерб, определяемый затратами на обследование и лечение больных, так и непрямой ущерб, связанный с компенсацией временной нетрудоспособности больных [7].
Так, по оценке Американской ассоциации гастроэнтерологов, затраты на диагностику и лечение СРК, включая экономические потери, обусловленные 13 (в среднем) нерабочими днями по состоянию здоровья, в 1998 г. составили 1,6 млрд долл. США. Причем, по данным других литературных источников, ущерб, связанный с СРК, варьируется от 8 до 20 млрд долл.
Поток больных СРК распределяется следующим образом: подавляющее большинство, 55 % пациентов, впервые обращаются к участковым терапевтам, составляя 12 % от всего числа амбулаторных больных; 25 % пациентов сразу попадают к гастроэнтерологу, составляя 28 % контингента больных, наблюдающихся у него. При этом 50 % рабочего времени врача-гастроэнтеролога уходит на лечение больных СРК. Около 15 % больных изначально обращаются к психиатру по поводу той или иной психопатологии, сопровождающей течение СРК, и наконец 5 % пациентов попадают к врачам других специальностей – чаще всего к гинекологам, хирургам, эндокринологам.
В соответствии с Римскими критериями III СРК – функциональное кишечное расстройство, при котором абдоминальная боль или дискомфорт ассоциируется с дефекацией или изменением частоты и характера стула или другими признаками нарушения опорожнения кишечника. Диагностическим критерием СРК является боль или дискомфорт в животе, отмечаемые в течение не менее 3 дней в месяц в последние 3 месяца, связанные с двумя или более из следующих симптомов: 1) боль или неприятные ощущения ослабевают после дефекации; появление боли и дискомфорта по времени совпадает с изменением 2) частоты или 3) формы (внешнего вида) стула. Диагноз ставится при условии, что соответствующие симптомы появились не менее 6 месяцев назад и сохраняются в течение последних 3 месяцев.
Истинная природа СРК остается не до конца установленной. Согласно современным представлениям, СРК является биопсихосоциальным расстройством, в основе развития которого лежит взаимодействие двух основных патологических механизмов: психосоциального воздействия и сенсорно-моторной дисфункции, т. е. нарушения висцеральной чувствительности и двигательной активности кишечника [2]. Важную роль в патогенезе СРК отводят и стойким нейроиммунным повреждениям, которые развиваются после инфекционных заболеваний кишечника и рассматриваются как возможная причина сенсорномоторной дисфункции.
Несколько десятилетий первичное нарушение двигательной функции кишечника рассматривалось как патофизиологическая основа СРК. Однако выявить специфичные для СРК нарушения моторики не удалось; наблюдаемые изменения регистрировались и у пациентов с органическими заболеваниями, плохо коррелировали с симптомами СРК, в связи с чем в настоящее время исследования двигательной функции кишечника самостоятельного диагностического значения не имеют [10, 11].
В последние годы детально разрабатывается концепция “висцеральной гиперчувствительности” (ВГЧ) толстой и особенно прямой кишки. Впервые феномен ВГЧ в 1980 г. обнаружил Whitehead с помощью баллонно-дилатационного теста. ВГЧ – это повышенная чувствительность к периферическим стимулам (механическим, термическим, химическим и др.), проявляющаяся возникновением болевых ощущений, моторных и секреторных расстройств в ответ на допороговые стимулы. Одним из проявлений ВГЧ является висцеральная гипералгезия. Интересно, что ВГЧ может затрагивать и пищевод, проявляясь в таком случае в виде общей дисфункции желудочно-кишечного тракта или его иннервации. Гипералгезия не распространяется на восприятие соматической боли.
Было обнаружено два вида ВГЧ: 1) снижение порога восприятия боли и 2) более интенсивное ощущение боли при нормальном пороге восприятия. При СРК отмечается диффузный характер нарушения восприятия боли на всем протяжении кишечника.
Некоторые специалисты считают наличие ВГЧ абсолютным патофизиологическим маркером СРК [18]. По их мнению, отсутствие у больного висцеральной гипералгезии исключает диагноз СРК. Однако другие авторы утверждают, что у многих больных с типичной клинической картиной СРК висцеральная гипералгезия отсутствует [17]. Именно ВГЧ в настоящее время рассматривается в качестве первичного механизма, формирующего возникновение, интенсивность болевого синдрома и двигательных нарушений кишечника при СРК [1, 16].
Патогенез ВГЧ полностью не изучен. Важнейшую роль в ее механизмах придают нейромедиаторам, в частности серотонину. При повышении внутрипросветного давления в толстой кишке энтерохромаффинные (тучные) клетки выделяют серотонин, который через активацию 5-HT3-рецепторов, локализующихся на первичных афферентных (чувствительных) нейронах блуждающего и спинномозговых нервов, вызывает появление периферических восходящих сенсорных импульсов. В коре головного мозга эти импульсы формируют различные ощущения (в т. ч. болевые). Активация 5-HT1- и 5-HT4-рецпторов, локализующихся на чувствительных нейронах подслизистых нервных сплетений, приводит к усилению кишечных перистальтики и секреции [19] Значительную роль серотонина в формировании ВГЧ подтверждает и ряд исследований, показавших увеличение количества тучных клеток в слизистой оболочке кишечника при СРК. Так, например, J.H. Park и соавт. показали, что усиление ректальной чувствительности у больных СРК с диареей сопровождается умеренным увеличением числа тучных клеток в слизистой оболочке, причем выраженность симптомов напрямую связана с количеством данного типа клеток [15].
Помимо серотонина определенную роль в патогенезе ВГЧ могут играть и другие биологически активные вещества. Имеются немногочисленные данные о возможном значении в формировании ВГЧ мелатонина, синтезирующегося главным образом в желудочно-кишечном тракте и действующего в основном местно, выполняющего важную роль в регуляции моторики, секреции и микроциркуляции, обеспечивая баланс гастроинтестинальных гормонов.
Условием формирования ВГЧ часто является наличие т. н. сенсибилизирующих факторов (например, перенесенной кишечной инфекции, психоэмоционального стресса, физической травмы и др.). Эти факторы, вызывая изменения двигательной функции кишечника, способствуют активации спинальных нейронов и в дальнейшем приводят к развитию феномена спинальной гипервозбудимости, когда обычные по силе раздражители (например, растяжение кишечника небольшим количеством газа) вызывают усиленный болевой ответ.
Если исходить из постулата, что ВГЧ является причиной моторных нарушений и возникновения болевых ощущений у больных СРК, эффективный препарат для лечения СРК должен уменьшать ее.
В настоящее время проблема выбора оптимального лечения СРК сохраняет свою актуальность. К сожалению, отсутствует четкая стратегия терапии СРК, на что указывают значительный разброс в предпочтениях выбора базисных препаратов и назначение лекарственных средств, эффективность которых в отношении коррекции проявлений данного заболевания сомнительна. Наиболее популярными медикаментами в лечении СРК, рекомендуемые терапевтами своим пациентам, являются спазмолитики (75 %), седативные средства (62,5 %), ферментные препараты (60,4 %) и пробиотики (54,1 %). Независимо от возраста и стажа работы большинство врачей обосновывали свой выбор ссылками на международные рекомендации (66,6 %) или журнальные публикации (52 %). Спектр лекарственных средств практически не зависел от клинического варианта СРК. Среди назначений врачей поликлиник лидируют ферменты (76 %), далее идут спазмолитики (64 %), прокинетики (60 %) и пробиотики (60 %).
Поводом к обращению больных СРК за врачебной помощью в 80 % случаев является болевой синдром. Абдоминальная боль является обязательным компонентом клинической картины СРК. Она имеет широкий спектр интенсивности от легкого дискомфорта, терпимой ноющей боли до постоянной схваткообразной и даже нестерпимой острой боли, имитирующей клиническую картину синдрома кишечной псевдообструкции (синдром Огилви).
Как уже отмечалось выше, наиболее распространенным средством купирования болевого синдрома у больных СРК являются спазмолитики. В настоящее время в арсенале врачей представлены спазмолитики различных фармакологических групп. До настоящего времени не существует стандартизированного препарата выбора, доказавшего свою эффективность в протоколах исследований и по отдаленным результатам наблюдения [5]. Следует отметить также, что СРК является гетерогенной нозологической единицей и включает несколько форм: с преобладанием диареи, с преобладанием запора, с преобладанием боли и метеоризма.
Одним из часто используемых в практике спазмолитиков является пинаверия бромид (Дицетел®). Он представляет собой спазмолитик миотропного действия, избирательно блокирует потенциал-зависимые кальциевые каналы L-типа гладкой мускулатуры кишечника и препятствует избыточному поступлению кальция внутрь клетки. В отличие от других антагонистов кальция Дицетел® проявляет одинаковое сродство к каналам в активном и инактивированном состоянии, с чем связаны его высокая эффективность и отсутствие привыкания. Антихолинергическим действием препарат не обладает, не активен в отношении вегетативного аппарата кишечника, не имеет вазодилататорного и антиаритмического эффектов. Кроме того, Дицетел® оказывает большее влияние на гладкую мускулатуру кишечника, чем на сердечную мышцу, т. е. обладает тканевой селективностью.
Несмотря на широкую известность Дицетела, нет данных о его влиянии на ВГЧ при различных клинических вариантах СРК. В связи с этим целью настоящего исследования стало изучение влияния пинаверия бромида (Дицетела) на клинические симптомы и висцеральную чувствительность у больных с разными вариантами СРК.
Материал и методы
В исследовании принимали участие 60 пациентов, которым был выставлен диагноз СРК в соответствии с Римскими критериями III. Средний возраст больных составил 37,6 ± 12,6 года. В большинстве своем это были женщины – 71,6 %. Двадцати пациента поставлен диагноз СРК с преобладанием боли и метеоризма, 20 – СРК с преобладанием запоров и 20 – СРК с преобладанием диареи.
Всем больным до начала терапии Дицетелом проведено физиологическое исследование (баллонно-дилатационный тест) для определения висцеральной чувствительности. Дицетел® назначен по 300 мг/сут в качестве монотерапии. Курс лечения составил 2 недели. В конце курса терапии всем больным повторно определен порог висцеральной чувствительности.
Наличие ВГЧ у больных СРК выявлено по снижению болевого порога при выполнении баллонно-дилатационного теста. Болевым порогом считали давление 40 мм рт. ст. [1].
Всем больным до и после терапии было предложено оценить интенсивность болевого синдрома с помощью визуально-аналоговой шкалы (ВАШ) абдоминальной боли. Шкала представляет собой градуированную линию 200 мм, где 0 соответствует отсутствию боли, а 200 – нестерпимой боли. После предварительного объяснения врачом назначения шкалы пациент самостоятельно отмечал тот уровень интенсивности болевого синдрома, который по его ощущениям у него присутствовал в течение нескольких предыдущих дней. Таким образом, мы получали субъективные данные об интенсивности болевого синдрома у пациентов с СРК.
Результаты и обсуждение
В нашем исследовании у всех больных СРК до лечения была выявлена ВГЧ. Наиболее низкие значения порога болевой чувствительности наблюдались среди пациентов с преобладанием диареи – в среднем 25,42 мм рт. ст. В группах больных с преобладанием запоров и боли с метеоризмом порог болевой чувствительности составил 34,6 и 30,61 мм рт. ст. соответственно.
После проведения терапии Дицетелом в течение 2 недель показатели висцеральной чувствительности определены повторно. Полученные данные представлены в таблице.
Примечание. СО – стандартное отклонение, СОС – стандартная ошибка среднего, р – различие с исходным уровнем.
После курса терапии Дицетелом уровень болевого порога повысился во всех трех группах больных. Наиболее выраженный эффект отмечен среди больных СРК с преобладанием боли и метеоризма. В этой группе порог болевой чувствительности максимально приблизился к норме, составив в среднем 39,75 мм рт. ст. Нормальный порог болевой чувствительности также был достигнут максимальным числом пациентов – 12 (60 %). В группах больных СРК с преобладанием диареи и запора повышение болевого порога было не столь значительным: оно составило в среднем 35,91 и 36,03 мм рт. ст. соответственно. Нормальное значение болевого порога в этих группах было достигнуто 4 (20 %) и 2 (10 %) пациентами.
Помимо относительно объективных показателей болевой чувствительности нами были получены субъективные данные от пациентов.
Согласно ВАШ, наиболее выраженный болевой синдром отмечен среди больных СРК с преобладанием боли и метеоризма. Средний балл интенсивности боли в этой группе составил 60,8 ± 12,34. Пациенты двух других групп оценивали болевой синдром значительно слабее. В группе больных СРК с преобладанием диареи средний балл интенсивности боли составил 36,65, в группе с преобладанием запора – 23,4.
После использования Дицетела в качестве монотерапии интенсивность болевого синдрома уменьшилась во всех группах больных. Наиболее выраженный эффект наблюдался в группе больных СРК с преобладанием боли и метеоризма (см. рисунок), где показатель по ВАШ снизился до 5,2 балла, причем у 65 % пациентов болевой синдром полностью купировался. В группе больных с преобладанием диареи интенсивность боли в среднем уменьшилась до 14,5, а в группе больных СРК с преобладанием запора – до 11,5 баллов. Болевой синдром полностью купировался у 30 % пациентов в группе с преобладанием диареи и у 10 % – с преобладанием запора.
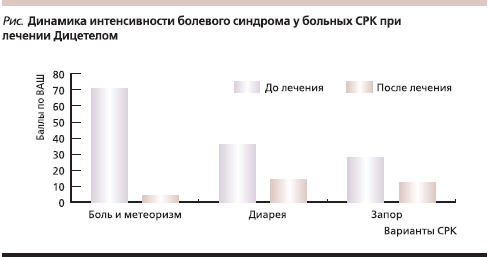
Таким образом, можно с уверенностью сказать, что при СРК Дицетел® (пинаверия бромид) оказывает выраженное влияние на висцеральную чувствительность. При его применении порог болевой чувствительности в большей степени повышается у больных СРК с преобладанием боли и метеоризма и в меньшей степени – при преобладании запоров и диареи. Болевой синдром при приеме Дицетела уменьшился при всех вариантах СРК, но если при преобладании боли и метеоризма он полностью купировался у 65 % больных, то при преобладании диареи и запора – только у 30 и 10 % пациентов соответственно. Это говорит о том, что использование спазмолитиков, в частности Дицетела, для лечения СРК в качестве монотерапии не вполне оправданно, особенно при вариантах с преобладанием запора и диареи. Лечение должно быть направлено не только на купирование боли, но и на устранение нарушений стула, психосоциальных и неврологических расстройств.


