Определение и классификация запоров
Согласно современным представлениям, запор можно определить как нарушение пассажа по толстой кишке, характеризующееся частотой стула менее 2 (или 3) раз в неделю и сопровождающееся хотя бы одним из следующих признаков: чувством неполного опорожнения, небольшим количеством и плотной консистенцией кала, натуживанием, длящимся не менее четверти времени дефекации [1–3]. Данному определению соответствуют как органические, так и функциональные запоры (ФЗ). Развитие органических запоров связано с опухолевым процессом, стриктурами толстой кишки разного генеза, дивертикулезом, анатомическими дефектами (аганглиоз, долихоколон и др.).
ФЗ может быть самостоятельной патологией или симптомом, сопровождающим разные заболевания, причем не только желудочно-кишечного тракта. В общем случае ФЗ отвечает критериям, предложенным международным консенсусом по функциональным гастроинтестинальным расстройствам (Римские критерии-III, 2006) [2].
Это следующие симптомы общей продолжительностью не менее 12 недель в течение 6 месяцев:
• натуживание > чем 1/4 времени дефекации;
• фрагментированный или твердый стул > чем при 1/4 дефекаций;
• чувство неполного опорожнения > чем при 1/4 дефекаций;
• чувство аноректальной непроходимости > чем при 1/4 дефекаций;
• ручная помощь > чем при 1/4 дефекаций (например, пальцевая эвакуация кала);
• менее 3 дефекаций в неделю.
В настоящее время нет классификации запоров, полностью удовлетворяющей клиницистов. Это обусловлено тем, что в основу разных классификаций положены разные критерии: этиология, уровень поражения, клиническая симптоматика, тип нарушения моторной деятельности кишечника или патогенетические механизмы. “Идеальная” классификация должна включать все эти параметры, но пока в рамках одной классификации все требования совместить не удалось.
Вместе с тем для правильного подхода к лечению запора необходимо учитывать все указанные характеристики:
• длительность (острый, хронический);
• этиологию;
• характер нарушений (органический, функциональный);
• топографию основного дефекта (уровень поражения):
• кологенный запор с нарушением транзита и без него;
• проктогенный запор с нарушением эвакуации;
• смешанный запор;
• тип нарушения моторики толстой кишки (гипер- или гипомоторика).
Острый запор, как функциональный, так и органический, определяется длительностью симптомов до 3 месяцев. Хронический запор можно определить как стойкое или интермиттирующее, продолжающееся более 3 месяцев нарушение функции толстой кишки с урежением частоты стула менее 3 раз в неделю и вынужденным натуживанием, занимающим более 25 % времени дефекации [2].
По топографии (уровню поражения) целесообразно выделять кологенные и проктогенные запоры, которые могут быть как органическими, так и функциональными.
ФЗ с нарушением транзита включает прежде всего группу заболеваний, связанных с нарушением функций непосредственно толстой кишки (истинные кологенные запоры), при которых запор является главным проявлением болезни. Кроме того, сюда следует отнести вторичные “симптоматические” запоры при спинальных, церебральных, эндокринных, метаболических нарушениях (инсульт, болезнь Паркинсона, демиелинизирующие заболевания, сахарный диабет, гипотиреоз и др.) [4].
Кологенный ФЗ с замедлением транзита может быть обусловлен двумя типами моторных нарушений. Во-первых, снижением мышечного тонуса и пропульсивной активности толстой кишки (гипотонический запор пожилых людей, идиопатический медленно-транзитный запор, инертная кишка). Во-вторых, спастическими сокращениями циркулярных гладких мышц и развитием спазмов (сегментарный гиперкинез при синдроме раздраженного кишечника) [4].
Проктогенный запор обусловлен нарушением процесса дефекации и эвакуации каловых масс при нормальной скорости транзита по толстой кишке. Затруднение акта дефекации происходит вследствие диссинергии мышц тазового дна (некоординированная работа пуборектальной мышцы и анального сфинктера), нарушения чувствительности анального сфинктера, нарушения кровотока в малом тазу [4–8].
Встречаются смешанные типы запора с нарушением транзита и эвакуации.
Этиологический фактор не менее важен для оценки запора и подбора терапии. Основные причины функционального запора приведены на рисунке.
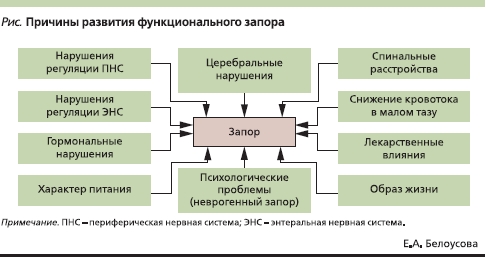
Этиология запоров
В развитии ФЗ значительную роль играют социально-бытовые факторы, включая стрессы, неправильный образ жизни и питания (гиподинамия, недостаток балластных веществ в рационе, нерегулярное питание, малый объем пищи, недостаточный суточный объем жидкости, злоупотребление слабительными) [9, 10]. Нормализация питания и увеличение физических нагрузок, как правило, приводят к нормализации функций кишечника. К этой группе относится алиментарный, или, по выражению М. Kamm, простой, запор, обусловленный дефицитом пищевых волокон. У таких больных с наступлением сезона фруктов и овощей стул обычно нормализуется без дополнительного лечения.
Нарушение гормонального фона при беременности, в период менопаузы, при гипотиреозе, сахарном диабете, гиперпаратиреозе и др. заболеваниях также приводит к ФЗ [11].
Запор развивается при приеме некоторых лекарств (холинолитики, опиаты, трициклические антидепрессанты, нейролептики, спазмолитики, блокаторы кальциевых каналов, слабительные, антациды, содержащие алюминий и кальций, ионы железа, мочегонные и др.), при церебральных и спинальных расстройствах, депрессии, рассеянном склерозе, нарушении регуляции со стороны периферической и энтеральной нервной системы [1, 11, 12]. Неврогенные запоры развиваются под действием стрессов (например, при синдроме раздраженной кишки), внезапного изменения привычного образа жизни или питания (дальние поездки, перелеты).
Лечение запора
Лечение запора независимо от его причины, механизма и возраста больных преследует всегда две цели – нормализацию консистенции стула и поддержание регулярности опорожнения кишечника.
С нашей точки зрения, алгоритм лечения запора в общем случае может выглядеть следующим образом:
Первый этап:
• установление и устранение причины ФЗ, если возможно;
• лечение основного заболевания, вызывающего запор (в случае вторичного симптоматического запора);
• коррекция негативных медикаментозных влияний;
• увеличение физической нагрузки, занятия спортом;
• правильный рацион питания и водный баланс.
У многих больных эти меры оказываются достаточными для нормализации стула.
Второй этап:
В отсутствие эффекта от указанных выше мероприятий следует назначать лекарственные препараты, в первую очередь слабительные.
Для этого необходимо:
• установление вида ФЗ (острый или хронический),
• механизма его развития (кологенный или проктогенный);
• выбор оптимального слабительного средства в соответствии с видом и механизмом развития ФЗ и механизмом действия лекарственного препарата.
Третий этап:
В случае неэффективности слабительных к лечению следует добавить препараты, нормализующие моторную функцию толстой кишки, для чего необходимо определить тип моторных нарушений:
• прием прокинетиков (тримебутин, прукалоприд) в случае гипо- и атонического хронического ФЗ;
• прием спазмолитиков при гипертонусе толстой кишки и/или ее спастических сокращениях (селективные миотропные спазмолитики – мебеверин или пинаверия бромид, коротким курсом можно использовать гиосцина бутилбромид);
• при необходимости дополнительной мерой может быть адекватная психокоррекция.
Для правильного выбора слабительного нужно знать не только указанные выше характеристики ФЗ, но и механизмы действия лекарственных средств.
Обзор современных слабительных представлен в табл. 1 [4, 5, 12–15].
Примечание. УДХК – урсодеоксихолевая кислота.
Все слабительные средства можно разделить на три основных типа: а) увеличивающие объем кишечного содержимого, что приводит к возрастанию внутрипросветного давления и стимулирует кишечную перистальтику; б) стимулирующие – содержащие или высвобождающие раздражающие субстанции, которые увеличивают кишечную секрецию воды и электролитов, снижают абсорбцию (препараты этой группы также действуют непосредственно на уровне энтеральной нервной системы, вызывая выделение из нервных окончаний слизистой оболочки веществ, усиливающих пропульсивную активность кишечника); в) любриканты – препараты, размягчающие фекалии (почти не используются в клинической практике).
Пищевые волокна (балластные вещества) в виде лекарств (псилиум), добавок к рациону (отруби, пектины, различные продукты питания с высоким содержанием растворимых и нерастворимых волокон) являются основой лечения хронического ФЗ, но могут быть рекомендованы не всем пациентам. Пищевые волокна в качестве послабляющего средства по механизму действия представляют собой гидрофильные коллоиды, которые в жидкой среде создают устойчивые мицеллы, значительно увеличивающие объем кишечного содержимого и стимулирующие перистальтику. Для успешного действия пищевых волокон необходим суточный объем жидкости не менее 1,5–2,0 литров, в противном случае пищевые волокна выполняют функцию сорбентов, поглощая жидкость из кишечника, что усиливает запор. Соблюдение водного баланса – обязательное условие применения пищевых волокон, однако его часто невозможно выполнить по разным причинам (сердечная недостаточность, трудности передвижения по квартире или постельный режим у одиноких больных, забывчивость и др.). Поэтому пищевые волокна в качестве добавок к рациону питания можно рекомендовать таким людям с большой осторожностью, причем необходимо контролировать их применение.
Многоатомные спирты (макроголи), как и пищевые волокна, относятся к гидрофильным коллоидам. Кроме того, они обладают умеренно-выраженным осмотическим действием. За счет двух этих эффектов увеличивается объем кишечного содержимого. Недостатком этой группы слабительных следует считать медленный эффект, развивающийся через 10–20 дней. Кроме того, у некоторых больных с выраженной гипотонией кишки препарат неэффективен.
Осмотические слабительные, несмотря на общий механизм, отличаются друг от друга зоной действия. Так, спирты с относительно короткой цепью из 3–6 углеродных атомов (сорбитол, маннитол) и солевые слабительные действуют на уровне тонкой кишки и способствуют выделению в ее просвет больших количеств жидкости, что сопровождается разжижением кала – часто до степени диареи. При длительном приеме могут развиваться дегидратация и гиповолемия.
Олигосахара, прежде всего лактулоза, не всасываются в тонкой кишке, т. к. там отсутствуют расщепляющие их ферменты. Препараты действуют только в толстой кишке. Лактулоза представляет собой синтетический дисахарид, состоящий из фруктозы и галактозы, который подвергается бактериальной ферментации и гидролизу в толстой кишке главным образом бифидобактериями, в меньшей степени –лактобактериями, что приводит к увеличению их биомассы. Конечным продуктом метаболизма лактулозы являются короткоцепочечные жирные кислоты (КЖК), которые среди прочих биологических эффектов (гипохолестеринемическое, гиполипидемическое, антипролиферативное действие) обладают осмотическим действием. Осмолярность КЖК ниже, чем у других осмотических слабительных, а влияние только на уровне толстой кишки обеспечивает быстрый, но более мягкий, предсказуемый эффект без излишней потери жидкости. Таким образом, лактулоза и другие олигосахара (лактитол, инулин) обладают двойным механизмом действия – восстанавливают толстокишечный микробиоценоз, являясь бифидо- и лактогенными пребиотикоми, и увеличивают объем кишечного содержимого за счет осмотического действия и увеличения бактериальной биомассы, что способствует возрастанию объема фекалий и стимуляции перистальтики [5, 13, 14, 16]. Аналогичный эффект в отношении увеличения биомассы и образования КЖК наблюдается и при приеме пищевых волокон. Механизмы этих явлений такие же, как и при использовании олигосахаров.
Стимулирующие слабительные (антрахиноны, производные дифенилметана) очень эффективны и являются наиболее распространенной среди больных, доступной и часто рекомендуемой группой препаратов. Однако эти средства не лишены недостатков, основной из которых – привыкание, т. е. снижение чувствительности к препарату и потеря терапевтического эффекта. Из-за развития привыкания слабительные стимулирующего действия, особенно препараты сенны, имеют не очень хорошую репутацию. Многие пациенты жалуются на необходимость постоянного увеличения дозы для получения ожидаемого эффекта. Однако положение о привыкании требует систематизированной доказательной базы, которой в настоящее время нет. Есть наблюдения, в которых прием бисакодила длительностью 2–34 года у больных со спинальными расстройствами не приводил к привыканию [15]. Для правильного, эффективного использования препаратов этой группы необходимо применять их строго по показаниям и понимать механизмы развития как основного, так и побочных эффектов.
Эффективность этих лаксативов обусловлена двойным эффектом – секреторным и местно-раздражающим. Секреторное действие определяется взаимодействием с эпителиальными структурами кишечника, стимуляцией активности аденилатциклазы на мембране энтероцитов и увеличением синтеза внутриклеточного цАМФ, что приводит к активной секреции жидкости и электролитов в просвет кишки с одновременным уменьшением всасывания. Фактически все эти средства вызывают кратковременную, а при длительном приеме постоянную секреторную диарею, приводящую к излишней потере жидкости и электролитным нарушениям, прежде всего к гипокалиемии. Ионы калия, среди прочих механизмов, поддерживают тонус гладкой мускулатуры кишечника, поэтому снижение его концентрации в крови неизбежно приводит к гладкомышечной релаксации и усилению запора. Нарушение жидкостного гомеостаза способствует развитию вторичного гиперальдостеронизма, что в свою очередь сопровождается потерей калия – и порочный круг замыкается. Указанный механизм является одним из основных, вызывающих привыкание и усиление запоров при длительном использовании всех секреторных слабительных [13].
Второй механизм, местно-раздражающий, обусловлен прямой стимуляцией синтеза или высвобождения из нервных окончаний подслизистого сплетения ряда субстанций, усиливающих перистальтику (серотонин, субстанция Р и др.). С теми же процессами связан второй механизм привыкания, показанный для антрахинонов и дериватов дифенилметана. Он состоит в том, что эти препараты, действуя на уровне нейронов подслизистого сплетения, вызывают образование не только стимуляторов моторики, но и оксида азота, который расслабляет гладкие мышцы и ингибирует перистальтику. При длительном применении указанных препаратов развиваются дегенеративные изменения энтеральной нервной системы [7, 13, 16].
Существуют также данные о том, что сеннозиды (лаксативы на основе сенны) обладают мутагенным действием и генотоксичностью [14]. Однако в других исследованиях эти данные не подтвердились [12]. Для сеннозидов описано также формирование псевдомеланоза толстой кишки (пигментированные участки слизистой оболочки вследствие отложения в ней антрахинонов, что не имеет, однако, злокачественного потенциала.
При всех указанных недостатках стимулирующие слабительные являются эффективными средствами. В рекомендуемых дозах и при соответствующих показаниях, а также соблюдении длительности лечения (короткие курсы – не более 10 дней) они достаточно безопасны для толстой кишки и организма в целом. Конечно, их не следует рекомендовать для длительного, тем более постоянного, использования, т. е. для лечения хронического ФЗ. Для применения этой группы лаксативов существует определенная “ниша”, в которой они вне конкуренции. Эта ниша включает людей с ФЗ, но не хроническим, а острым. У некоторых групп больных развивается острый ФЗ и имеются четкие показания к назначению стимулирующих слабительных, т. к. пациентам противопоказано натуживание и повышение внутрибрюшного давления, но необходимо получить быстрый и управляемый эффект. К ним относятся больные сердечно-сосудистыми заболеваниями (инфаркт миокарда, тяжелая артериальная гипертензия, аневризма, инсульт, венозные тромбозы), отслойкой сетчатки, ретинопатией, пациенты с различными грыжами, ректальными трещинами, геморроем или ректальным пролапсом, больные после операций на прямой кишке и брюшной полости при развитии постоперационной кишечной атонии. Короткие курсы стимулирующих слабительных рекомендуются в предоперационном периоде как подготовка к операции и при подготовке к исследованиям кишечника. Прямым показанием к назначению стимулирующих слабительных является также острый ФЗ, возникающий при изменении привычного образа жизни или привычного туалета: т. н. “запор командировочных”. По мнению Singh и соавт., из-за опасности привыкания стимулирующие средства следует использовать как “терапию срочной помощи” при разных видах запоров [17].
Естественно, возникает вопрос о выборе того или иного слабительного препарата стимулирующего действия. С учетом общих достоинств и недостатков антрахинонов, дериватов дифенилметана и обсуждаемых недостатков сеннозидов предпочтение следует отдавать препаратам дифенилметана: бисакодилу (Дульколакс) и пикосульфату натрия (Гутталакс). Оба препарата являются пролекарствами и метаболизируются до активного вещества, обладающего послабляющим эффектом. С нашей точки зрения, препаратом выбора является Дульколакс – современная лекарственная форма бисакодила в виде таблеток с энтеросолюбильным рН-зависимым покрытием на основе полимеров эудрагита, которая обеспечивает высвобождение действующего вещества в начальных отделах толстой кишки при значениях рН 6,5. Оболочка таблеток Дульколакса препятствует высвобождению препарата в тонкой кишке, что в отличие от других секреторных средств (в т. ч. бисакодила без специального покрытия) позволяет избегать избыточной потери жидкости и электролитного дисбаланса. Дульколакс в виде таблеток (или ректальных суппозиториев) можно назначать эпизодически или курсами продолжительностью до 14 дней без опасности развития побочных эффектов. Результаты крупных рандомизированных исследований по эффективности и безопасности бисакодила при курсовом назначении получены для лекарственной формы с рН-чувствительной оболочкой. Последнее исследование показало, что Дульколакс в виде таблеток по 10 мг в течение 4 недель является эффективным и хорошо переносимым средством для лечения хронического запора без опасности развития привыкания и с улучшением качества жизни [21].
Необходимо помнить, что большая часть слабительных увеличивает объем кишечного содержимого, что эффективно при лечении кологенного запора, но не показано при проктогенном. При последнем можно коротким курсом использовать ректальные суппозитории бисакодила (Дульколакса) для стимуляции позыва на дефекацию и улучшения работы анального сфинктера. Могут быть также полезны свечи с глицерином. Однако, как правило, эти меры недостаточно эффективны. При классическом проктогенном запоре, обусловленном диссинергией мышц тазового дна, самым эффективным методом лечения считается “терапия биологической обратной связи” (biofeedback) [6, 17].
Указанные особенности различных групп слабительных и оценка всех факторов развития запора у каждого больного с учетом возраста и сопутствующих заболеваний позволяют выбрать оптимальный слабительный препарат. С нашей точки зрения, можно предложить схему выбора слабительного, представленную в табл. 2.
Слабительные средства, выбранные с учетом механизма их действия и всех основных характеристик запора, составляют основную группу лекарственных препаратов, применяемых для лечения запора.
Вместе с тем следует признать, что слабительные являются лишь симптоматическим, палиативным лечением и не решают проблемы запора. В 2005 г. был опубликован подробный обзор по использованию разных слабительных средств в Северной Америке (American College of Gastroenterology) [18]. Общий вывод свидетельствует о том, что для оценки их эффективности нет достаточной доказательной базы и необходимы дополнительные хорошо организованные исследования. Это согласуется с обзором Cochrane, в котором указано, что всего четыре исследования по слабительным могут считаться соответствующими строгим кокрановским требованиям.
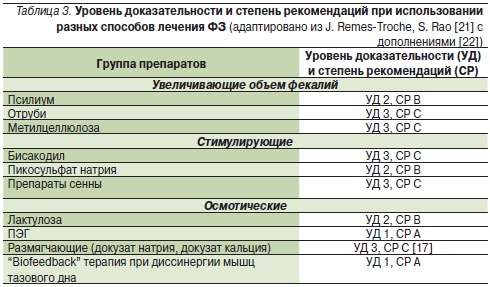
Авторы обзора считают, что все слабительные демонстрируют ограниченную эффективность [19]. В табл. 3 приведены уровни доказательности эффективности слабительных разных групп. Из нее следует, что уровню 1 и степени рекомендаций А соответствует только терапия биологической обратной связи при проктогенном запоре и ПЭГ среди осмотических слабительных (здесь ПЭГ отнесен к осмотическим слабительным, хотя в большей степени он относится к гидрофильным коллоидам). Обращает на себя внимание, что в группе препаратов, увеличивающих объем фекалий, только псилиум имеет высокие уровень доказательности и степень рекомендаций. Что касается стимулирующих слабительных, то уровень доказательности в обеих группах безусловно недостаточен и именно для них нужны дополнительные исследования. Исключение составляют бисакодил и пикосульфат натрия, эффективность и безопасность которых показана в 4-недельных двойных слепых плацебо-контролируемых исследованиях [20, 21]. Этим исследованиям присвоены уровни доказательности II и III степени рекомендаций В и С [17, 22].
Что касается использования прокинетиков, то они показаны при кологенном медленнотранзитном запоре в случае отсутствия эффекта от слабительных, т. е. являются терапией 2-й линии. На российском рынке присутствует тримебутин и ожидается прукалоприд, однако рассмотрение этих препаратов не входит в задачу настоящей работы.
Таким образом, лечение запора представляет сложную проблему и требует индивидуализации терапии, что обусловлено множественностью причин и механизмов развития запора.



