Центральный несахарный диабет (ЦНД) – нейроэндокринное заболевание, имеющее в своей основе дефект синтеза или секреции антидиуретического гормона (АДГ) вазопрессина, проявляющееся выраженной жаждой и выделением большого количества мочи низкой плотности.
Другими вариантами несахарного диабета являются нефрогенный (вазопрессинрезистентный) и психогенный (психогенная полидипсия).
Синтез и секреция АДГ
АДГ вазопрессин синтезируется в супраоптических и паравентрикулярных ядрах гипоталамуса. Далее он связывается с белком-носителем нейрофизином. Комплекс АДГ-нейрофизин в виде гранул транспортируется к терминальным расширениям аксонов нейрогипофиза и срединного возвышения, где и накапливается. Для манифестации ЦНД необходимо снижение секреторной способности нейрогипофиза на 85 % [1, 2, 4, 8].
Секреция АДГ зависит от осмоляльности плазмы, объема циркулирующей крови и уровня артериального давления (АД). На изменения электролитного состава крови реагируют осмотически чувствительные клетки, находящиеся в околожелудочковых отделах переднего гипоталамуса. Повышенная активность осморецепторов при повышении осмоляльности крови стимулирует вазопрессинергические нейроны, из окончаний которых в общий кровоток выделяется вазопрессин. Снижение осмоляльности плазмы, вызванное приемом большого количества жидкости, подавляет секрецию АДГ. В физиологических условиях осмоляльность плазмы находится в пределах 282–300 мосм/кг [5]. Ионы натрия и маннитол являются мощными стимуляторами секреции вазопрессина. Мочевина не влияет на секрецию гормона, а глюкоза приводит к торможению его высвобождения [3].
Регуляция секреции вазопрессина зависит и от изменений объема крови. При кровотечениях существенное влияние на его высвобождение оказывают волюморецепторы, расположенные в левом предсердии. В сосудах АДГ действует через V1-баро/осморецепторы, которые располагаются на гладкомышечных клетках сосудов. Вазоконстрикторное действие вазопрессина при кровопотере обусловлено сокращением гладкомышечного слоя сосуда, что препятствует падению АД. При снижении АД более чем на 40 % отмечается повышение уровня АДГ, в 100 раз превышающее значение его базальной концентрации [1, 3]. На повышение АД реагируют барорецепторы, расположенные в каротидном синусе и дуге аорты, что в конечном итоге приводит к снижению секреции АДГ.
Осмотическая концентрация – это суммарная концентрация всех растворенных частиц. Она может выражаться как осмолярность и измеряться в осмоль/л или как осмоляльность в осмоль/кг. Различие между осмолярностью и осмоляльностью заключается в способе получения данной величины. Для осмолярности это расчетный способ – по концентрации основных электролитов в измеряемой жидкости. Формула расчета для осмолярности: 2 × (Na ммоль/л + К ммоль/л) + глюкоза ммоль/л + мочевина ммоль/л + 0,03 × общий белок г/л [5].
Осмоляльность плазмы, мочи и других биологических жидкостей – это осмотическое давление, зависящее от количества ионов, глюкозы и мочевины, которое определяется с помощью прибора осмометра. Осмоляльность меньше осмолярности на величину онкотического давления.
Механизм действия АДГ
Главный физиологический эффект вазопрессина заключается в стимуляции реабсорбции воды в собирательных канальцах коркового и мозгового слоев почек против осмотического градиента давления [6]. В клетках почечных канальцев АДГ действует через V2-барорецепторы (вазопрессиновые рецепторы 2-го типа), которые располагаются на базолатеральных мембранах клеток собирательных канальцев. Взаимодействие АДГ с V2-рецепторами приводит к активации протеинкиназы А, которая стимулирует встраивание белков водных каналов, в частности аквапорина-2, в апикальную мембрану клеток, что обеспечивает транспорт воды из просвета собирательных трубочек в клетку, и далее через находящиеся на базолатеральной мембране белки водных каналов (аквапорин-3 и аквапорин-4) вода транспортируется в межклеточное пространство, а затем в кровеносные сосуды. В результате моча выделяется концентрированной. При нормальной секреции АДГ осмолярность мочи всегда выше 300 мосм/л, может увеличиваться даже до 1200 мосм/л и выше. При дефиците АДГ осмолярность мочи ниже 200 мосм/л [4, 5].
Эпидемиология ЦНД
Распространенность ЦНД варьируется от 0,004 до 0,010 %. Заболевание чаще встречается у женщин, чем у мужчин, и начинается в 20–30-летнем возрасте [17].
Этиологические факторы ЦНД
Среди первичных форм ЦНД выделяют наследственную семейную разновидность заболевания, передаваемую по аутосомно-доминантному или аутосомно-рецессивному типу наследования. Наличие заболевания прослеживается в нескольких поколениях и может затрагивать ряд членов семьи.
Болезнь обусловлена мутациями, приводящими к изменениям в строении АДГ. Врожденные анатомические дефекты развития среднего и промежуточного мозга также могут быть первичными причинами развития ЦНД. В 50–60 % случаев первичную причину ЦНД установить не удается: это т. н. идиопатический несахарный диабет [17].
Среди вторичных причин, приводящих к развитию ЦНД, отмечают черепно-мозговую травму (сотрясение головного мозга, перелом основания черепа), а также состояния после транскраниальной или транссфеноидальной операции на гипофизе [12]. Развитие вторичного ЦНД может быть связано с опухолями головного мозга – краниофарингиомой, пинеаломой, герминомой, приводящими к сдавлению и атрофии задней доли гипофиза. Воспалительные изменения гипоталамуса, супраоптикогипофизарного тракта, воронки, ножки, задней доли гипофиза также являются вторичными причинами развития ЦНД.
Причиной развития ЦНД могут также стать грипп, энцефалит, менингит, острые инфекционные заболевания (ангина, скарлатина, коклюш), хронические инфекционные заболевания (туберкулез, бруцеллез, сифилис, малярия, ревматизм) [9, 10]. Среди сосудистых причин ЦНД выделяют синдром Шиена, нарушения кровоснабжения нейрогипофиза.
В основе развития нефрогенного несахарного диабета лежат врожденные рецепторные или ферментативные нарушения дистальных канальцев почек, приводящие к резистентности рецепторов к действию АДГ. При этом содержание эндогенного АДГ может быть нормальным или повышенным,
а прием АДГ не устраняет симптомы заболевания. Нефрогенный несахарный диабет может встречаться при длительно текущих хронических инфекциях мочевыводящих путей, мочекаменной болезни, доброкачественной гиперплазии предстательной железы.
Симптоматический нефрогенный несахарный диабет может развиваться при заболеваниях, сопровождающихся повреждением дистальных канальцев почек, таких как серповидно-клеточная анемия, саркаидоз, амилоидоз. В условиях гиперкальциемии снижается чувствительность к АДГ и уменьшается реабсорбция воды.
Психогенная полидипсия развивается “на нервной почве” – преимущественно у женщин менопаузального возраста. Первичное возникновение жажды обусловлено функциональными нарушениями в центре жажды [14]. Под влиянием большого количества жидкости и увеличения объема циркулирующей плазмы посредством барорецепторного механизма происходит снижение секреции АДГ. Исследование мочи по Зимницкому выявляет у этих пациентов снижение относительной плотности, тогда как концентрация натрия и осмолярность крови остаются нормальными или пониженными. При ограничении употребления жидкости самочувствие больных остается удовлетворительным, при этом уменьшается количество мочи, а осмолярность мочи повышается до физиологических пределов [11].
Клиническая картина ЦНД
Основными симптомами несахарного диабета являются обильное учащенное мочеиспускание и жажда. Количество выпитой и выделенной жидкости при легкой форме заболевания обычно достигает 3–5 литров, при средней степени тяжести – 5–8, при тяжелой форме – 10 литров и более. Пациент может обходиться без приема жидкости не более 30 минут. Моча обесцвеченная, ее относительная плотность – 1000–1003 г/л. Обезвоживание приводит к сухости кожи и слизистых оболочек, уменьшению слюно- и потоотделения, развитию стоматитов и назофарингитов. При резком обезвоживании начинает нарастать общая слабость, быстро усиливается головная боль, появляется тошнота. Больные становятся раздражительными, у них могут быть галлюцинации, судороги, коллаптоидные состояния.
В условиях избыточного употребления жидкости у больных снижается аппетит, происходит перерастяже-ние желудка, снижается желудочно-кишечная секреция, замедляется моторика желудочно-кишечного тракта, развиваются запоры. При поражении гипоталамической области воспалительным или травматическим процессом наряду с несахарным диабетом могут наблюдаться и другие нарушения, такие как ожирение, патология роста, галакторея, гипотиреоз, сахарный диабет [3, 5].
Диагностика ЦНД
Диагностика ЦНД основана на жалобах пациентов на жажду и избыточное употребление воды, частое мочеиспускание в течение дня и ночью. При обследовании (анализ мочи по Зимницкому) подтверждение диагноза несахарного диабета основано на полиурии с выделением за сутки от 3 до 20 литров мочи с относительной плотностью 1003–1005 г/л во всех порциях. При биохимическом исследовании крови выявляется гиперосмолярность плазмы более 300 мосм/л (300–320 мосм/л), гипернатриемия более 155 мэкв/л. Моча у пациентов с несахарным диабетом гипоосмолярна
(100–200 мосм/л) [17].
На следующем этапе обследования проводят пробу с дегидратацией для исключения первичной полидипсии и тест с десмопрессином для исключения нефрогенного несахарного диабета. Пациентам с подтвержденным диагнозом ЦНД проводится магниторезонансная томография головного мозга для установления причины заболевания и выявления патологических изменений гипоталамо-гипофизарной области [5].
Лечение ЦНД
Всем пациентам с диагностированным ЦНД назначается десмопрессин – синтетический аналог вазопрессина [9]. Препарат лишен сосудосуживающей активности и обладает более выраженным и продолжительным антидиуретическим эффектом [16]. В настоящее время в России используется 2 формы десмопрессина: таблетированная форма (Минирин) и интраназальный спрей (Пресайнекс). При ЦНД средние терапевтические дозы таблетированного десмопрессина варьируются от 0,1 мг до 1,6 мг/сут, кратность приема – 2–3 раза в день. При интраназальном введении препарата доза составляет от 10 до 40 мкг в сутки, что обусловлено индивидуальной чувствительностью к препарату; кратность приема – 2 раза в день [7, 13].
При приеме таблетированной формы антидиуретический эффект наблюдается через 1–2 часа. Интраназальное введение обеспечивает более быстрое начало действия через 15–30 минут, т. к. введение препарата не связано с приемом пищи, что обеспечивает большую биодоступность. При простудных или аллергических заболеваниях возможно введение препарата сублингвально в дозах, в 1,5–2,0 раза превышающих дозы для интраназального введения [15].
Опыт ведения пациентов с ЦНД
В Эндокринологическом диспансере Департамента здравоохранения города Москвы под наблюдением находятся больные ЦНД. С таблетированной формы десмопрессина на интраназальный спрей были переведены 67 больных: 42 женщины и 26 мужчин в возрасте от 20 до 82 лет.
При переводе учитывалось, что прием 0,2 мг таблетированной формы десмопрессина эквивалентен 10 мкг десмопрессина, вводимого интраназально.
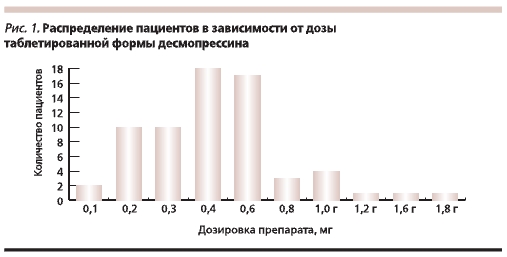
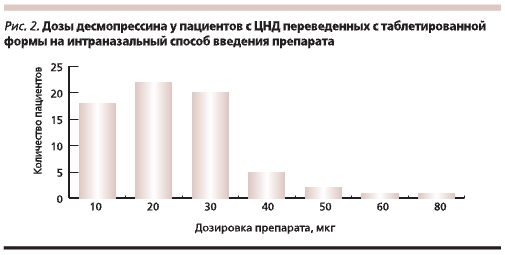
У подавляющего большинства пациентов доза перорального десмопрессина составляла от 0,2 до 0,6 мг/сут (рис. 1). При переводе на интраназальный спрей средние терапевтические дозы десмопрессина варьировались от 10 до 30 мкг/сут. У пациентов, получавших таблетированный десмопрессин в дозе от 1,0 до 1,8 г в сутки, кратность приема составила 8 раз, при переводе на интраназальную форму препарата компенсация заболевания была достигнута на дозе от 60 до 80 мкг/сут с кратностью приема 2 раза в день. Диапазон дозировок интраназального десмопрессина представлен на рис. 2. На фоне приема интраназальной формы препарата выраженных побочных эффектов не отмечено.
Клинические примеры
Больная М. 40 лет. В возрасте 17 лет стала испытывать жажду, выпивала по 8 литров воды в сутки. Впервые обратилась к врачам в 2009 г., когда объем потребляемой жидкости превысил 12 литров, стала нарастать общая слабость и утомляемость. Диагноз несахарного диабета был поставлен на основании жалоб, в анализе мочи по Зимницкому объем суточной мочи – 8550 мл, относительная плотность мочи – 1002–1005 г/л. Пациентке был назначен препарат Пресайнекс в дозе 10 мкг 2 раза в сутки. При повторном визите через месяц пациентка отметила улучшение самочувствия, объем
потребляемой жидкости снизился до 2500 мл. При контрольном анализе мочи по Зимницкому объем суточной мочи – 2350 мл, относительная плотность – 1006–1018 г/л. В дальнейшем титрация дозы не проводилась в связи с достигнутым терапевтическим эффектом препарата. За время наблюдения у пациентки отмечены острые респираторные вирусные инфекции, сопровождавшиеся отеком слизистой оболочки носа. Сублингвальное введение препарата в дозе 30 мкг в сутки было достаточным для устранения симптомов полиурии и полидипсии. Больной М. 19 лет. Диагноз несахарного диабета установлен в 14 лет после удаления герминомы пениальной области и курса химиолучевой терапии. Принимал Минирин 0,1 мг по 1 таблетке 3 раза в сутки. На фоне приема препарата отмечал боли в животе. По результатам проведенного обследования на фоне приема Минирина 0,3 мг/сут суточный диурез – 3 литра, относительная плотность мочи – 1003–1008 г/л. С мая 2010 г. переведен на интраназальное введение десмопрессина. Доза Пресайнекса составила 10 мкг 2 раза в сутки. На фоне приема препарата боли в животе не беспокоят. При контрольном анализе мочи по Зимницкому диурез – 2200 мл/сут, относительная плотность мочи в отдельных порциях составила 1012–1015 г/л. Дальнейшая титрация дозы не проводилась.
Больной Г. 56 лет. Первые признаки заболевания в виде жажды, полидипсии и полиурии до 5 литров в сутки наблюдались с 4–5-летнего возраста. При обследовании в 6-летнем возрасте выявлен несахарный диабет. У отца больного также наблюдались полиурия и полидипсия, но он никогда не обследовался и не лечился. В дальнейшем при обследовании у него также был выявлен несахарный диабет и назначено лечение хлорпропамидом 0,5 г в сутки. У дочери больного Г. с раннего возраста отмечены жажда и полиурия, после обследования у нее диагностировали несахарный диабет. Лечение десмопрессином (Адиуретин) привело к нормализации диуреза и относительной плотности мочи. В настоящее время пациент Г. переведен на препарат Пресайнекс 10 мкг 2 раза в сутки с ранее принимавшегося Минирина 0,2 мг 2 раза в сутки. Больной переведен на интраназальный десмопрессин в связи с неудобствами при приеме Минирина. Это было обусловлено 30–40-минутными интервалами между приемом препарата и приемом пищи, а также 2-часовыми интервалами между приемом пищи и приемом препарата, что затрудняло работу пациента, связанную с частыми командировками. На фоне приема препарата Пресайнекс 20 мкг/сут диурез – 2300 мл, относительная плотность мочи – 1006–1014 г/л.
Заключение
В настоящее время для эффективного лечения пациентов с ЦНД используются препараты десмопрессина. Хороший клинический эффект, обеспечивающий длительную компенсацию заболевания, показан при назначении интраназальной формы препарата (Пресайнекс).


