Нарушения водно-солевого баланса нередко определяют симптоматику и тяжесть течения многих заболеваний [1, 13, 14]. Одним из клинических проявлений расстройств водно-электролитного обмена считается полиурия. Это непременный симптом сахарного диабета, полиурия может наблюдаться у пациентов с гиперпаратиреозом, и наконец мочеизнурение, порой невероятного размаха, остается ведущим признаком центрального несахарного диабета (ЦНД). Это редкое нейроэндокринное заболевание вызывается недостаточностью антидиуретического гормона (АДГ) и как следствие – снижается почечная реабсорбция воды, экскретируется масса мочи с низкой относительной плотностью, компенсаторно же потребляется большое количество жидкости [5, 12, 17, 29].
Антидиуретический гормон (вазопрессин) совместно с другими гормонами (предсердный натрийуретический гормон, альдостерон, ангиотензин II), а также нейрогуморальными воздействиями контролирует в организме экскрецию или задержку соли и воды почками [6, 10, 24]. Однако АДГ считается самым важным регулятором задержки и выделения воды [1, 9, 27]. Напомним, что вода составляет основную часть организма: у мужчин – примерно 60 % массы тела, у женщин – 50 %. Подобные различия связаны с относительно большей массой жировой ткани и меньшей массой мышечной ткани у женщин относительно мужчин. В мышцах содержится около половины всей воды организма, в то время как не более 30 % воды – в жировой ткани. Нормальное суточное потребление взрослым человеком воды равно в среднем 1,5 литра на 1 м² поверхности тела или примерно 40 мл на 1 кг нормальной массы тела. В течение суток у взрослого здорового человека образуется 1,0–1,5 л мочи, или диурез равен 1,0 (0,7–1,2) мл/кг/ч.
О положительном или отрицательном водном балансе можно с уверенностью говорить, если различия объемов поступивших в организм и выделенных из него жидкостей составляют 25 % и более [1, 7, 24, 25].
На фоне обычного потребления жидкости АДГ присутствует в плазме крови в очень низкой концентрации (1,4–5,6 пмоль/л). При лишении организма жидкости через 24–48 часов концентрация гормона в 3–5 раз возрастает, причем в ночное время и ранним утром она выше, чем днем, поэтому ночью выделяется меньший объем мочи с более высокой осмоляльностью [7, 26]. Период полужизни АДГ короткий и составляет всего 5–10 минут, его метаболизм осуществляется в почках и печени, примерно 7–10 % АДГ выводится с мочой в неизменном виде [10, 22].
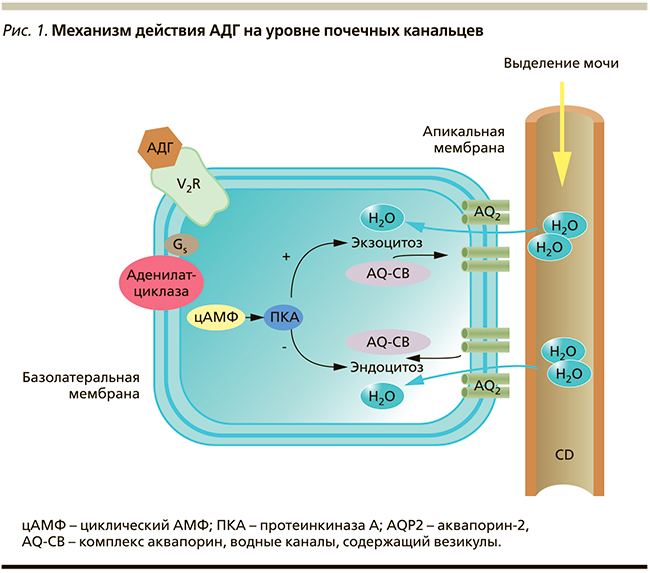
Действие вазопрессина осуществляется через V-рецепторы (VR). Связывание пептида с гладкими мышцами сосудов опосредовано V1аR, что приводит к сосудосуживающему эффекту [3, 17]. Наиболее важным физиологическим эффектом вазопрессина считается сохранение воды в организме путем снижения выделения мочи [7, 23]. Молекулы вазопрессина взаимодействуют с V2-рецепторами (V2R) на базолатеральной мембране собирательных канальцев и активируют вазопрессинчувствительную аденилатциклазу, а впоследствии – продукцию циклического АМФ и активацию протеинкиназы А (рис. 1). В свою очередь протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка, – аквапорина-2 (AQP2), активность которого зависит от АДГ. Аквапорины – семейство транспортных белков, предназначенных для облегченной диффузии воды. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в нее, образуя водные каналы [3, 15]. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство [5, 22]. В отсутствие АДГ число водных каналов невелико и эпителий практически водонепроницаем, а из организма выводится масса гипотонической мочи [20]. Иначе говоря, чем выше концентрация вазопрессина в крови, тем выше концентрация образующейся мочи; чем ниже его концентрация, тем более разбавленной становится моча.
Помимо традиционного гидроосмотического эффекта АДГ выполняет и другие физиологические функции, включая регуляцию системной гемодинамики (прессорное действие), гемостаза, высвобождение ренина, синтез простагландинов в почках и наконец – способность обучения [2, 6, 10, 13]. В норме секрецию пептида регулируют гипоталамические осморецепторы, реагирующие на колебания эффективной осмоляльности плазмы крови (ОПК) и поддерживающие ее в узких пределах. Изменяя объем осморецепторных клеток и электрическую активность нейронов, увеличение ОПК всего на 1–2 % вызывает заметные изменения секреции АДГ.
В норме начальная точка секреции АДГ (у взрослых) расположена между 280 и 290 мОсм/кг [5, 22, 24]. Секреция АДГ тормозится, когда ОПК становится ниже указанного порогового уровня, что приводит к выведению большого объема максимально разведенной мочи (осмоляльность падает до 40–60 мОсм/кг). Повышенное выведение воды предотвращает дальнейшее снижение ОПК – даже при значительном потреблении воды [7, 25, 26].
Секреция АДГ значимо усиливается в случае повышения ОПК (гиперосмия): при ее значениях 295 мОсм/кг концентрация гормона становится достаточной для обеспечения максимального антидиуретического эффекта (7,4–14,0 пмоль/л) [7, 10]. Одновременно активизируется и механизм утоления жажды, что приводит к увеличению потребления воды и препятствует дегидратации организма [6, 25, 26]. Уменьшение на 10–15 % объема циркулирующей крови существенно изменяет секрецию гормона, при этом снижается осмотический порог секреции АДГ, но сохраняется линейная связь между ОПК и концентрацией пептида. Данный механизм реализуется посредством растяжения волюморецепторов левого предсердия и легочных вен, от которых нервные импульсы по n. vagus поступают в ретикулярную формацию головного мозга, а оттуда – в супраоптическое и паравентрикулярное ядра гипоталамуса [22]. Старение значительно усиливает реакцию гормона на воздействия, повышающие ОПК, поэтому у лиц пожилого возраста возрастает риск задержки воды и натрия [7, 23].
Секреция АДГ регулируется также барорецепторами легочных артерий (барорецепторами системы низкого давления). Барорецепторная система регуляции несколько менее чувствительна, чем осморецепторный механизм регуляции: для стимуляции секреции АДГ необходимо изменение объема крови или давления крови на 5–10 % [2]. При этом максимальная барорецепторная стимуляция обусловливает гораздо более высокую концентрацию пептида в крови, нежели осмотический стимул любой интенсивности [7, 22]. Иначе говоря, резкое снижение объема циркулирующей жидкости и артериальная гипотензия опережают гипоосмотическое подавление секреции АДГ.
Тошнота, боль и стресс, возникающие в послеоперационном периоде, служат очень мощным стимулятором высвобождения АДГ, и если в организм поступает избыточное количество свободной воды, может сформироваться угрожающая жизни гипонатриемия [1, 23]. Прием алкоголя тормозит секреторную функцию нейрогипофиза и повышает диурез. Стимуляция АДГ происходит при болевых раздражениях, которые могут приводить к рефлекторной анурии при эмоциональных возбуждениях [6, 7, 10].
Этиопатогенез центрального несахарного диабета
Центральный несахарный диабет возникает при недостаточности синтеза или секреции АДГ, при этом конкретные причины заболевания весьма разнообразны. Кроме того, ЦНД может быть генетическим и приобретенным [5, 17, 19]. Ведущим фактором возникновения органической формы заболевания является инфекция. Среди острых инфекций следует отметить грипп, ветряную оспу, эпидемический паротит, менингит, коклюш, а среди хронических – тонзиллит и другие очаговые инфекции носоглотки [16, 17, 29]. Почти у половины детей и трети взрослых больных развитие ЦНД связано с наличием первичной или метастатической опухоли в гипоталамо-гипофизарной области (например, краниофарингиома). Аденомы гипофиза, сопровождающиеся развитием ЦНД, как правило, имеют значительный супраселлярный рост [5, 17].
Заболевание возникает и в результате хирургического или лучевого вмешательства по поводу опухолей в гипоталамо-гипофизарной области; не менее частая причина у взрослых (17 % случаев) – черепно-мозговые травмы (травма головы, глазницы, переломы костей черепа) [5, 16, 19]. Указанные причины могут вызывать отек вокруг аксонов, вазопрессинсодержащих нейронов, приводя к транзиторному (ремиссия возможна в 60 % случаев) или стойкому ЦНД.
Лимфоцитарный инфундибуло-нейрогипофизит может объяснить ЦНД у более чем половины пациентов с идиопатической формой заболевания, при этом возможна его ассоциация с другими аутоиммунными заболеваниями [16, 21, 27]. Среди более редких причин ЦНД необходимо отметить системные инфильтративные заболевания (саркоидоз, гистиоцитоз Х, туберкулез), гемобластозы (лейкоз, лимфогранулематоз и др.). Известны случаи ЦНД, вызванные сосудистой патологией: центральные аневризмы, геморрагический инсульт, послеродовый некроз гипофиза [5].
Иногда причиной ЦНД могут быть генетические дефекты, существование которых подтверждается наличием семейных форм этого заболевания (5 % случаев заболевания) [16, 23]. Например, синдром Вольфрама – сочетание сахарного и несахарного диабетов, нейросенсорной тугоухости и атрофии зрительного нерва. Считается, что в основе дефицита АДГ лежит аплазия нейросекреторных клеток [29].
В зависимости от степени поражения ЦНД может осложниться другими проявлениями гипоталамо-гипофизарных нарушений, равно как последние могут включать на определенном этапе их развития понижение секреции вазопрессина. Так, ЦНД может развиться после родов, при синдроме Шихана [5, 15].
Клиническая картина и диагностика
Клиническая манифестация заболевания, как правило, возникает при значительном снижении секреторной активности нейрогипофиза (на 80–90 %) [5, 29]. Начало заболевания обычно острое, внезапное, гораздо реже его симптомы проявляются постепенно и нарастают по мере интенсивности. Центральный несахарный диабет, возникающий в результате инфекции, травмы, обычно проявляется непосредственно вслед за воздействием патогенного фактора или спустя 2–4 недели. В свою очередь хронические инфекционные заболевания вызывают ЦНД, как правило, спустя 1–2 года [16, 17].
Непременными проявлениями заболевания служат патологически повышенное выделение разведенной мочи (гипотоническая полиурия), равно как и выраженная жажда (полидипсия), превышающая 2 л/м²/сут. При этом осмоляльность мочи (менее 290 мОсмоль/кг) ниже, чем сыворотки крови, а ее цвет почти не отличается от воды [29]. Гиперосмоляльность плазмы в связи с выраженной полиурией стимулирует жажду: больные очень много пьют жидкости (от 5 до 15 л/сут), предпочитая холодные напитки. После приема жидкости жажда появляется вновь, не прекращаясь даже ночью, что способствует нарушению сна. В отдельных случаях, судя по литературным данным, объем выделяемой за сутки мочи бывает невероятным (до 20 литров и более), потребность в мочеиспускании возникает каждые 30–60 минут как днем, так и ночью. Чаще объем мочи увеличивается не столь значительно (в среднем до 3–6 л/сут) [5, 16]. При легких формах ЦНД больной привыкает много пить и часто мочиться, может не предъявлять жалоб. Нередко наблюдается уменьшение пото- и слюноотделения. Примечательно, что потливости не бывает, даже когда потеря воды с мочой полностью компенсируется обильным приемом жидкости. Часто снижены секреторная деятельность органов желудочно-кишечного тракта и аппетит. При поздней диагностике заболевания вследствие систематического употребления больших количеств жидкости может наблюдаться растяжение и опущение желудка, а из-за выведения больших объемов мочи – расширение мочевыводящих путей, гидронефроз. Возможны психоэмоциональные нарушения – головные боли, бессонница, эмоциональная неуравновешенность вплоть до психозов, снижение умственной активности. В связи с полиурией и полидипсией появляется бессонница, чему сопутствует физическая и психическая астенизация: резко ухудшается качество жизни [16, 17].

Если потеря жидкости адекватно не возмещается, то при почти неснижающемся большом диурезе появляются признаки обезвоживания – слабость, лихорадка, нарушение сознания, головная боль, сухость слизистых и кожи, тошнота, тахикардия, падение артериального давления [16, 29]. При тяжелой дегидратации развивается коллапс, падает фильтрационная способность почек, быстро снижается масса тела пациента, нарушается микроциркуляция и наступает сгущение крови. Организм человека крайне чувствителен к обезвоживанию: потеря 20 % общего количества воды ведет к шоку и смерти.
Для большинства больных причину полиурии удается установить при клиническом обследовании.
В типичных случаях подтверждением диагноза ЦНД служит наличие полиурии с низкой относительной плотностью (< 1005–1010), полидипсии. Лабораторные исследования также обнаруживают гиперосмоляльность плазмы (более 290 мОсм/кг), гипернатриемию и сопутствующую гипоосмоляльность мочи (100–200 мОсм/кг) с низким удельным весом [6, 16, 17, 29]. Напомним, что в физиологических условиях ОПК составляет 275–290 мОсм/кг, немного увеличивается в пожилом и старческом возрасте. Этот показатель можно легко определить, зная концентрацию основных осмотических компонентов внеклеточной жидкости: натрия, глюкозы и мочевины [1, 7].
В клинической практике наиболее успешно используется дифференциально-диагностический тест с сухоедением (или концентрационный тест), который позволяет дифференцировать ЦНД от первичной полидипсии, когда нет изменений секреции АДГ и чувствительности к нему [5, 16]. При наличии гипернатриемии проведение пробы противопоказано. Больные под обязательным постоянным наблюдением (во избежание приема жидкости тайком) лишаются любой жидкости на 6–14 ч. До и каждые 1–2 часа теста измеряются масса тела, объем мочи, осмоляльность крови и мочи, содержание натрия в плазме. Рекомендуется прекращение пробы с сухоедением в случае потери более 5 % массы тела, невыносимой жажде, нарастания содержания натрия, повышения ОПК выше границ нормы и осмоляльности мочи более 650 мОсм/кг [17, 29].
Результаты пробы свидетельствуют об отсутствии стимуляции эндогенного АДГ, если за время ее проведения больной потерял более 3 % массы тела, осмотическое давление плазмы превысило 300 мОсм/кг, осмоляльность не увеличивается более чем на 30 мОсм/кг на протяжении 3 последующих часов, а ее объем существенно не уменьшается (табл. 1). При центральном или нефрогенном несахарном диабете на фоне теста ОМ остается ниже ОПК [16].
Тест с десмопрессином проводится для дифференциальной диагностики центрального и нефрогенного несахарного диабета: пациенту вводят п/к, в/в или в/м 2 мкг десмопрессина или интраназально 10 мкг или 0,1 мг перорально того же препарата, через 2 и 4 часа определяют объем и осмоляльность. Результаты пробы свидетельствуют о ЦНД, если после введения десмопрессина осмоляльность мочи увеличивается более чем на 50 %, если же эффект препарата отсутствует (т.е. прирост менее 50 %), имеет место нефрогенный несахарный диабет [16, 29].
Тяжесть ЦНД зависит от степени недостаточности секреции АДГ, и на практике точная диагностика полиуритического состояния не всегда столь проста и ясна [2, 10]. Так, при неполном дефиците клиническая симптоматика может быть не столь отчетливой, а результаты пробы не столь очевидными для дифференциации ЦНД и первичной полидипсии. Известно, что у пациентов с частичными формами ЦНД сохраняется некоторая остаточная способность повышать секрецию АДГ в ответ на гипертоническую дегидратацию. Для преодоления этой диагностической сложности предложено назначение низких доз десмопрессина [5, 16] в течение 5–7 дней: десмопрессин интраназально 10 мкг 1–2 раза в сутки или перорально 0,1 мг 2–3 раза в сутки. Также необходимо оценивать общее самочувствие пациента. У больных с ЦНД наблюдается исчезновение симптомов; в отличие от этого у пациентов с первичной полидипсией состояние в целом не меняется [18, 29].
С целью выявления и последующего специализированного лечения патологии, лежащей в основе развития ЦНД, используется МРТ головного мозга (исключение органической природы заболевания) [16, 22]. Метод позволяет распознавать структурные особенности селлярной и параселлярной области. Отличительная особенность – отсутствие изображения нейрогипофиза или визуализация более тусклого свечения вследствие сниженного синтеза АДГ при центральной форме заболевания [17, 27].
Лечение центрального несахарного диабета
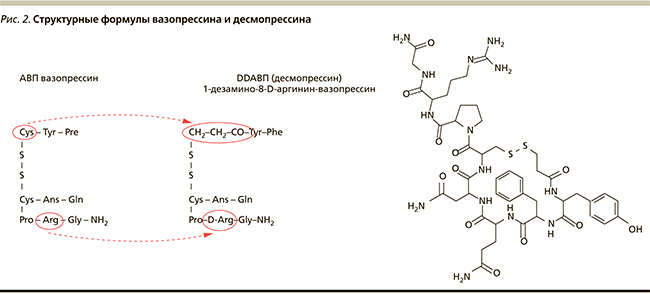
При всех формах заболевания с недостаточностью продукции АДГ жизненно необходима заместительная терапия. Перед врачом стоит задача быстро купировать нарушения водно-минерального обмена и избегать нежелательных побочных эффектов терапии. Наибольшей антидиуретической активностью и устойчивостью молекулы к разрушению обладает синтетический аналог гормона 1-дезамино-8-D-аргинин-вазопрессин (десмопрессин), имеющий наилучший профиль соотношения эффективности и безопасности (рис. 2) [5, 28, 29]. Фармакологический эффект десмопрессина реализуется после взаимодействия со специфическими V2R почечных канальцев. Важно, что препарат не влияет на V1R гладкой мускулатуры кровеносных сосудов и внутренних органов [9, 15, 17]. Замещение L-аргинина в положении 8 D-аргинином придает лекарственному средству пониженную сосудосуживающую активность (отношение антидиуретической активности к прессорной составляет примерно 2000 : 1 против 1 : 1 у природного пептида) [17, 23]. Дополнительное дезаминирование цистеина в 1-м положении не только еще больше повышает отношение антидиуретической активности пептида к прессорной, но и увеличивает продолжительность действия препарата. Более того, способность десмопрессина активировать V2R в 1,6 раза выше, чем у вазопрессина [16, 29]. Итак, по сравнению с природным АДГ антидиуретическое действие десмопрессина выражено в наибольшей степени как по силе, так и по продолжительности; кроме того, препарат практически лишен сосудосуживающей активности.
Заместительная терапия ЦНД может осуществляться различными лекарственными формами десмопрессина: интраназальным дозированным спреем и таблетированной формой; при любом варианте терапевтическая доза для пациента подбирается индивидуально [8, 18, 29]. Таблетированная форма десмопрессина позволяет эффективно осуществлять контроль диуреза у пациентов с ЦНД, что обеспечивается приемом препарата натощак, за 30–40 минут до или через 2 часа после еды. Для большинства пациентов оптимальным считается прием 0,1–0,2 мг десмопрессина 3 раза в сутки. Однако титровать таблетированный препарат десмопрессина не всегда легко: есть неудобство в соблюдении режима приема, к тому же случайный прием препарата с пищей снижает его абсорбцию, а антидиуретический эффект наблюдается не быстро – через 1–2 часа [8, 9].
Хороший клинический эффект обеспечивает удобная для пациента форма в виде интраназального спрея (вазомирин). Вазомирин при вспрыскивании в нос распределяется по передней поверхности слизистой носовых ходов и хорошо фиксируется на ней, что обеспечивает длительный терапевтический эффект препарата. Лекарственное средство не имеет особых сложностей в применении и легко дозируется (в одной дозе – 10 мкг действующего вещества). Это особенно важно в лечении транзиторной полиурии и полидипсии после нейрохирургических вмешательств в области гипофиза [19, 23]. Приверженность пациентов к использованию препарата объясняется простотой и удобством его применения, кратностью введения (1–2 раза в сутки) независимо от приема пищи. При выборе средства терапии ЦНС врач должен учитывать, что оригинальная форма выпуска позволяет использовать вазомирин не только при различных заболеваниях органов ЖКТ, но и больным с неотложными состояниями, а также в ситуациях, когда необходимо более точно подбирать и контролировать дозу.
Антидиуретический эффект вазомирина начинается быстро – через 15 минут после интраназального введения дозы. Клинически значимая концентрация действующего вещества достигается через час, максимальная – через 4 часа, далее начинает снижаться через 14 часов, возвращаясь к исходному уровню через 24 часа. Начальная доза для взрослых составляет по 10 мкг 1–2 раза/сут; в последующем контролируя выделительную функцию почек (объем и удельный вес мочи), ОПК, дозу вазомирина изменяют для достижения терапевтического эффекта.
В итоге суточная доза препарата индивидуальна: в среднем это 10–40 мкг/сут десмопрессина в один или несколько приемов.
В ряде случаев возникает необходимость замены одной лекарственной формы десмопрессина на другую, тогда следует воспользоваться следующим ориентировочным пересчетом дозы: 0,2 мг таблетированной формы десмопрессина эквивалентно 10 мкг вазомирина.
Клинический пример
Больной П. 39 лет. Жалобы на слабость, жажду, частое мочеиспускание, в т.ч. в ночное время, снижение массы тела. Известно, что первые проявления заболевания появились через 6 недель после тяжелого гриппа, протекавшего с расстройством сознания. После выписки из стационара сохранялась утомляемость, нарастала слабость, появилась раздражительность, жажда, из-за которой стал ежедневно выпивать до 5–6 литров жидкости, похудел на 4 кг. Наследственность не отягощена.
При обследовании патологии внутренних органов не выявлено. Центральный несахарный диабет был установлен на основании вышеуказанных жалоб, анамнеза и следующих результатов. Исследование мочи по Зимницкому: суточный диурез – 7,5 литров при относительной плотности мочи 1001–1005 г/л. Было начато лечение минирином; на фоне дозы 0,3 мг/сут количество ночных мочеиспусканий снизилось до 2–3 раз (действия препарата не хватало на вторую половину ночи), суточное количество мочи – до 3 литров. Относительная плотность мочи повысилась до 1013 г/л.
Увеличение дозы минирина до 0,4 мг/сут сопровождалось головными болями, тошнотой и повышением артериального давления. В дальнейшем пациент был переведен на интраназальное введения десмопрессина с подбором оптимальной терапевтической дозы. Терапевтическая доза вазомирина составила 30 мкг/сут, диурез снизился до 1,6 л/сут. Быстрый регресс симптомов заболевания позитивно сказался на психоэмоциальном состоянии пациента. Общее самочувствие улучшилось, повысилась физическая работоспособность, нормализовался сон, поскольку прекратились пробуждения в середине ночи и под утро. В анализе мочи по Зимницкому колебания относительной плотности мочи – 1007–1018 г/л. Обследование пациента через 6 и 12 месяцев свидетельствовало о поддержании компенсации ЦНД на фоне применения вазомирина.
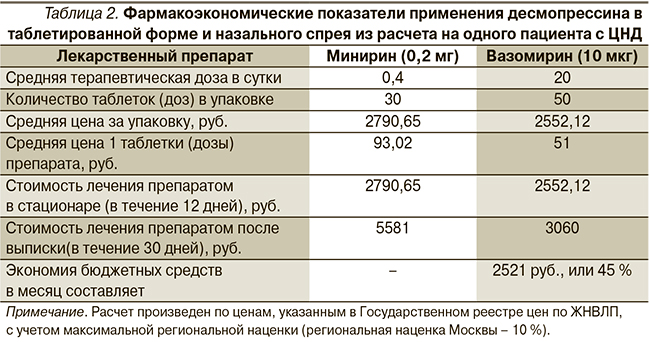
В наши дни фармакоэкономический анализ представляет собой немаловажный компонент эффективного лечения, учитываемый при выборе того или иного лекарственного средства, что позволяет оптимизировать расходы системы здравоохранения. Сравнительный анализ применения двух лекарственных форм десмопрессина с моделированием их стоимости представлен в табл. 2.
Как видно, спрей назальный – не только наиболее удобная, но и экономически выгодная форма десмопрессина. К его главным преимуществам относятся высокая точность дозировки, быстрое достижение эффекта и удобная форма выпуска.


