Введение
Помимо межлекарственных (МЛВД) известны взаимодействия между лекарственными средствами (ЛС) и пищевыми продуктами, напитками, травами, биологически активными добавками.
В группе риска развития МЛВД, как следствие – лекарственно-индуцированных заболеваний (ЛИЗ), находятся пожилые люди, т.к. на них приходится более 30% от всех назначений ЛС. Вероятность возникновения МЛВД зависит от факторов, связанных как с пациентом (возраст, пол, сопутствующие заболевания и т.д.), так и с ЛС (доза, время приема, фармакокинетические и фармакодинамические свойства ЛС) [1].
МЛВД – изменение эффективности и безопасности одного ЛС при одновременном или последовательном его применении с другим ЛС [2]. По механизму возникновения МЛВД принято выделять фармакокинетические или фармакодинамические взаимодействия [2–5]. Развитие МЛВД может произойти в результате одновременного действия нескольких механизмов, из-за чего МЛВД иногда трудно идентифицировать, поэтому они по-прежнему остаются одним из самых важных факторов риска ЛИЗ [2].
МЛВД служат причиной 26% всех госпитализаций, связанных с развитием нежелательных реакций (НР) на фоне приема ЛС [2] и 1% госпитализаций среди населения в целом [6]. НР как результат МЛВД составляют 19,8% от всех спонтанных сообщений, полученных Росздравнадзором (72,6% из этих НР оцениваются как серьезные) [7]. Анализ смертельных исходов от НР показал, что в каждом третьем случае применялись потенциально опасные комбинации [2].
Риск возникновения опасных МЛВД зависит от многих факторов, которые принято разделять на факторы, связанные с пациентом (клиренс препарата у конкретного пациента, возраст, генетические факторы, пол, сопутствующие заболевания, факторы окружающей среды и характер питания), и факторы, специфичные для ЛС (фармакокинетические и фармакодинамические свойства ЛС, количество принимаемых ЛС, доза, время приема, последовательность, форма и способ применения ЛС) [8, 9].
В основе фармакокинетических МЛВД, повышающих риски развития НР и ЛИЗ, лежат изменения абсорбции, распределения, метаболизма и выведения ЛС [6, 10, 11].
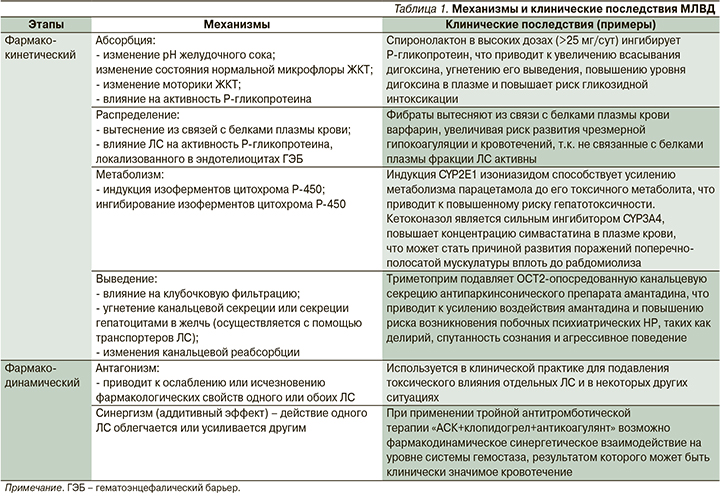
Абсорбция ЛС. Благодаря МЛВД на уровне абсорбции может изменяться биодоступность ЛC [12]. На всасывание ЛС через слизистую оболочку желудочно-кишечного тракта (ЖКТ) может влиять несколько факторов: изменение pH желудочного сока, образование невсасывающихся комплексов, нарушение моторики ЖКТ, изменение активности P-gp в ЖКТ [2]. Например, прием ЛС, снижающих рН желудочного сока (например, пентагастрина), может повышать биодоступность таких ЛС, как цефподоксим, ампициллин, кетоконазол, атазанавир, ралтегравир, клопидогрел, диазепам, метотрексат и др. [4]. Метоклопрамид может ускорять опорожнение желудка, тем самым ускорять абсорбцию алкоголя, ацетилсалициловой кислоты (АСК), ацетаминофена, тетрациклина и леводопы [4, 13]. Ингибирование P-gp может значительно увеличивать биодоступность плохо всасываемых ЛС, тем самым вызывать развитие НР или ЛИЗ [14]. Важным МЛВД, связанным с ингибированием P-gp в ЖКТ, является взаимодействие дабигатрана этексилата при одновременном приеме с ингибитором P-gp верапамилом: концентрация дабигатрана в сыворотке крови повышается [15], увеличивая риск больших кровотечений на фоне терапии дабигатраном [16, 17].
Распределение ЛС. Примером МЛВД на уровне распределения ЛС служит, например, взаимодействие гемфиброзила с варфарином: он вытесняет варфарин из связи с белками плазмы крови, увеличивая риск развития чрезмерной гипокоагуляции и кровотечений [3]. Данный механизм взаимодействия имеет наибольшее клиническое значение для ЛС, связывающихся с белками плазмы более чем на 90% [3].
Метаболизм ЛС. Изменение активности ферментов метаболизма ЛС – наиболее распространенный и широко изученный механизм развития МЛВД. Клинически значимые МЛВД реализуются вследствие ингибирования или индукции ряда изоферментов CYP: CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5, при этом МЛВД, основанные на ингибировании CYP, составляют основную долю клинически значимых МЛВД [18–20]. Так, при одновременном применении метопролола и пропафенона клиренс метопролола снижается в 2 раза, что ведет к повышению риска его развития НР [21]. Ингибиторы протеазы вируса иммунодефицита человека (ВИЧ) увеличивают концентрацию силденафила в сыворотке до 11 раз(!) [20]. Совместное применение ингибиторов 3A4 со статинами, например симвастатином, аторвастатином, может увеличивать риск миопатии и рабдомиолиза [3, 21–27]. Индукция CYP2E1 изониазидом приводит к усилению метаболизма парацетамола до его токсичного метаболита, способствуя повышению риска гепатотоксичности [28, 29].
Выведение ЛС. МЛВД могут потенциально влиять на выведение ЛС, следовательно, повышать риски развития ЛИЗ с помощью четырех различных механизмов [30]: подавления канальцевой секреции, изменения pH мочи, снижения почечного кровотока, подавления метаболизма ЛС в почках.
МЛВД могут происходить по механизму конкуренции на уровне активной канальцевой секреции, когда ≥2ЛС используют одну и ту же транспортную систему. Примером могут служить нестероидные противовоспалительные средства, применение которых приводит к появлению токсических эффектов метотрексата: блокируется почечная экскреция антипролиферативного препарата [31]. Также было продемонстрировано, что почечный клиренс метотрексата снижает действие амоксициллина [32].
Некоторые препараты могут нарушать канальцевую секрецию других ЛС. В частности, циметидин – H2-блокатор, может влиять на канальцевую секрецию различных молекул [33]. Например, триметоприм с сульфаметоксазолом или без него подавляет OCT2-опосредованную (ОСТ – organic cation transporters, русск.: транспортеры органических катионов) канальцевую секрецию антипаркинсонического препарата амантадина, что приводит к усилению воздействия амантадина и возможности возникновения побочных психиатрических симптомов, таких как делирий, спутанность сознания и агрессивное поведение [30, 34].
Гемфиброзил, являясь ингибитором белков-транспортеров органических анионов (ОАТР – organic anion transporting polypeptides) и SLCO1B1 (Solute carrier organic anion transporter family member 1B1, транспортер органических анионов – носителей растворенного вещества член семейства 1B1), способствует повышению концентрации симвастатина в крови и тем самым увеличивает риск развития рабдомиолиза [3].
Фармакологически индуцированные изменения pH мочи влияют на состояние ионизации некоторых ЛС, следовательно, могут влиять на их реабсорбцию из почечных канальцев [35]. Диуретики способны изменять pH мочи и могут влиять на выведение некоторых ЛС [36], что будет иметь негативные последствия для пациента. Так, литий – это одновалентный катион, на выведение которого влияет уровень натрия в сыворотке крови. Следовательно, интенсивное выведение натрия, вызванное длительным лечением некоторыми диуретиками (например, тиазидными), может увеличивать реабсорбцию лития, вызывая развитие серьезных токсических эффектов вследствие относительной передозировки [37, 38].
Механизмы фармакодинамического взаимодействия ЛС, влияющие на развитие НР и ЛИЗ
В основе фармакодинамических МЛВД лежат изменения фармакологических мишеней, усиливающие или ослабляющие физиологический ответ, именно таким образом фармакодинамические МЛВД могут повышать риск НР и ЛИЗ [39, 40].
При одновременном применении двух ЛС с одинаковым действием существует вероятность суммации эффектов. Если эффект комбинации ЛС представляет собой арифметическую сумму индивидуальных эффектов двух препаратов, это называется аддитивным эффектом [41, 42]. Аддитивные фармакодинамические эффекты служат очень частой причиной ЛИЗ [3]. Клинически значимые примеры аддитивных фармакодинамических МЛВД включают, например, артериальную гипотензию у пациентов с сердечной недостаточностью в результате совместного применения нескольких ЛС с гипотензивным действием (ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II, β-адреноблокаторы, антагонисты альдостерона, тиазидные и/или петлевые диуретики и др.). Другим примером фармакодинамического МЛВД, который может приводить к ЛИЗ, является совместное применение нескольких ЛС, удлиняющих интервал QT на электрокардиограмме, увеличивая риск развития тахикардии типа «пируэт», например совместный прием антибиотика группы фторхинолонов левофлоксацина с нейролептиком галоперидолом [38–45].
Примеры МЛВД и их клинические последствия представлены в табл. 1 [3, 30, 34, 40, 46, 47].
Взаимодействие «лекарственные средства–пища»
Взаимодействие ЛС и пищевых продуктов – один из модифицируемых факторов риска развития ЛИЗ, поскольку оно повышает вероятность развития НР, в т.ч. серьезных НР, также подобное взаимодействие может снижать эффективность фармакотерапии [3]. Прием как пищи в целом, так и определенных продуктов питания одновременно с некоторыми ЛС может оказывать влияние на их фармакокинетику и фармакодинамику, следовательно, на терапевтическую эффективность и вероятность развития НР и ЛИЗ [48, 49].
Эпидемиология
Хотя точных данных о распространенности случаев взаимодействия ЛС и продуктов питания в клинической практике нет, а литературные данные ограниченны, имеющиеся результаты исследований, посвященных этой проблеме, позволяют говорить о высокой актуальности данного фактора риска ЛИЗ. Так, по данным M. Abdollahi et al. [50], у госпитализированных пациентов из 19 наиболее часто назначаемых ЛС (амиодарон, АСК, диклофенак, железа сульфат, изосорбида динитрат, каптоприл, карведилол, ко-тримоксазол, ловастатин, метопролол, метронидазол, магния гидроксид, нитроглицерин, омепразол, пропранолол, ранитидин, спиронолактон, комбинация гидрохлоротиазид+триамте-рен, комбинация клидиния бромид+хлордиазепоксид) 17 (кроме магния гидроксида и АСК) назначались без учета времени приема пищи, что обусловливало наличие высоких рисков взаимодействия, как следствие – изменение профилей эффективности и безопасности данных ЛС. Лидерами по числу назначений без учета потенциальных взаимодействий с пищей были нитроглицерин, метронидазол, каптоприл и сульфат железа [50]. Среди пациентов пожилого и старческого возраста распространенность потенциальных взаимодействий «ЛС–пища» составила 58,5%, по данным S.J.F. Neves et al. [51], при этом максимальные риски развития НР вследствие подобного взаимодействия присутствовали у больных, принимавших одновременно с пищей несколько ЛС. Среди назначений чаще других встречались следующие группы ЛС с высоким потенциальным риском взаимодействия с пищевыми продуктами: cахароснижающие ЛС, антигипертензивные препараты, в т.ч. диуретики, блокаторы ренин-ангиотензин-альдостероновой системы (РААС), β-адреноблокаторы, анальгетики; а среди конкретных ЛС с высокими рисками развития потенциальных НР вследствие взаимодействия с продуктами питания по частоте назначений лидировали каптоприл, пропранолол, метформин, алендронат и фуросемид [51].
Факторы риска
К факторам риска развития взаимодействий между продуктами питания и ЛС относятся пожилой и старческий возраст, женский пол, низкий уровень образования, длительность заболевания/патологического состояния, полипрагмазия, одновременный прием ЛС и пищи, отсутствие консультирования по вопросам правильного приема ЛС, наличие некоторых хронических заболеваний, например сахарного диабета [50, 51].
Изучение влияния продуктов питания или напитков на фармакокинетический профиль ЛС – неотъемлемая часть процесса регистрации нового ЛС. Как правило, оценивается биодоступность ЛС в эксперименте с участием здоровых добровольцев, в котором определяется концентрация испытуемого ЛС в плазме крови за определенный временной промежуток натощак и после одновременного приема с пищей [52]. Так как биодоступность ЛС при его приеме одновременно с пищей сильно зависит от ее количественного и химического состава, существуют специальные требования к проведениям исследований биодоступности и биоэквивалентности ЛС на фоне приема пищи, в которых стандартизирован ее качественный и количественный состав [52–54].
Ярким примером влияния пищи на фармакокинетический профиль ЛС является изменение биодоступности ингибитора тирозинкиназы лапатиниба: по сравнению с приемом натощак биодоступность лапатиниба в разовой дозе 1500 мг после приема его вместе с высококалорийной стандартной пищей увеличивается в среднем на 325% (в 4,25 раза!) [55]. Другими словами, концентрация препарата в сыворотке крови после приема одной таблетки одновременно с пищей сопоставима с приемом 4 таблеток натощак.
Типы взаимодействия «ЛС–пища»
Выделяют два основных типа взаимодействия ЛС и пищи: фармакокинетический и фармакодинамический [48, 49, 52].
Фармакокинетический тип взаимодействия. Продукты питания могут изменять абсорбцию, метаболизм и выведение ЛС (табл. 2) [48, 56, 57].
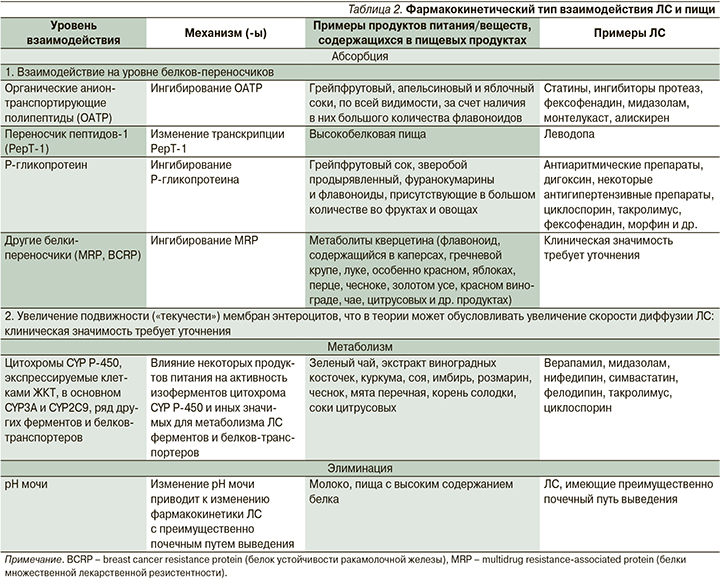
Так, например, дигидропиридиновый блокатор кальциевых каналов фелодипин претерпевает активный пресистемный метаболизм, опосредованный CYP3A4, в кишечнике и в печени, что обусловливает его низкую биодоступность (~15%). Было обнаружено, что грейпфрутовый сок снижает пресистемный метаболизм фелодипина за счет взаимодействия с CYP3A4 в стенке кишечника и таким образом приводит к увеличению системной концентрации фелодипина (AUC и Cmax); этот эффект может длиться более 24 часов. Достаточно употребления всего лишь 250 мл грейпфрутового сока, чтобы AUC и Cmax фелодипина увеличились на 267 и 345% соответственно(!) [58]. Клинически взаимодействие грейпфрутового сока и фелодипина приводило к выраженному снижению артериального давления (АД) и ортостатической гипотензии.
В литературе описаны случаи развития приапизма на фоне одновременного применения силденафила и гранатового сока [59]. Предлагаемый механизм этого взаимодействия связан с ингибированием CYP3A4 фитохимическими веществами, содержащимися в гранатовом соке: cилденафил, будучи субстратом CYP3A4, может вступать во взаимодействия с гранатовым соком [59].
У женщин, принимавших клозапин, употребляющих в большом количестве кофе, концентрация клозапина в сыворотке крови была примерно в 2,5 раза выше по сравнению с теми, кто кофе не пил [60], что может повышать риски развития НР данного ЛС.
Фармакодинамический тип взаимодействия. Классическим примером фармакодинамического типа взаимодействия пищи с ЛС служит тираминовый синдром («сырный» синдром), который проявляется гипертоническими кризами (повышение систолического АД на ≥30 мм рт.ст.) с выраженными клиническими симптомами [61]. Тираминовый синдром возникает в случае одновременного приема антидепрессантов группы ингибиторов моноаминоксидазы (иМАО, ниаламид, моклобемид, селегилин и др.) [62, 63] с продуктами, cодержащими тирамин или его предшественник тирозин (сыры, бобовые, бананы, соя, шоколад и кофеиносодержащие продукты, дрожжевые экстракты, сметана, йогурт, креветочная паста, соевый соус, соевые приправы, соус терияки и др., а также алкоголь). Первым угрожающим симптомом тираминового синдрома является сильная, пульсирующая головная боль. Кроме того, гипертонические кризы при тираминовом синдроме могут сопровождаться повышением температуры, сильными болями в области сердца, нарушениями ритма сердца, обильным потоотделением, мидриазом, нервно-мышечной возбудимостью, судорогами, светобоязнью, головокружением, тошнотой, рвотой. Могут наблюдаться отечность и багровый цвет кожи головы и лица. Как правило, тираминовый синдром развивается быстро (в течение 15–90 минут после приема соответствующих продуктов питания), а исчезает большинство симптомов примерно через 6 часов. Возможно развитие летального исхода в результате осложнений гипертонического криза (инфаркт миокарда, инсульт, острая сердечная недостаточность) [61–63]. Препараты группы иМАО тормозят активность моноаминоксидазы, что приводит к увеличению биодоступности моноаминов и усилению их действия. У пациента, принимающего антидепрессанты группы иМАО и употребляющего пищу, содержащую тирамин (вазоактивный амин), они не распадаются, напротив, попадают в кровоток и воздействуют на симпатические нервные окончания, что провоцирует выброс эндогенных катехоламинов, следовательно, тяжелый симпатоадреналовый гипертонический криз [61–63].
Одновременный прием варфарина и продуктов, обладающих антикоагулянтными/антиагрегантными свойствами (хрен обыкновенный, гинкго, имбирь, малина, чеснок, пиретрум девичий, зеленый чай и др.), могут повышать риски кровотечения [64].
Еще одной группой ЛС, эффективность которых может изменяться при одновременном приеме с некоторыми продуктами питания, являются сахароснижающие ЛС: употребление в пищу женьшеня, какао, кофе, бузины, льняного семени и некоторых других продуктов питания может усиливать секрецию инсулина β-клетками поджелудочной железы и повышать риск развития гипогликемии [65]. Потребление пациентами, получающими терапию блокаторами РААС и/или антагонистами альдостерона, большого количества продуктов, богатых калием, может приводить к развитию гиперкалиемии.
Отдельные продукты питания и напитки, вступающие во взаимодействие с ЛС
Среди отдельных продуктов питания особое значение имеют напитки, поскольку часто пациенты запивают назначенные им медикаменты не водой, а какими-либо другими жидкостями (соки, молоко, чай, кофе и др.). Во взаимодействие с ЛС могут вступать грейпфрутовый и другие соки (апельсиновый, виноградный, клюквенный, яблочный, гранатовый и др.) [48, 66], молоко [48, 67, 68], кофе и кофеинсодержащие напитки [48, 69, 70], зеленый чай [48, 71].
Так, например, прием апельсинового сока 3 раза в сутки в течение 3 дней приводит к статистически значимому снижению Cmax и AUC атенолола – на 49 и 40%, соответственно [72]. При этом данные изменения клинически значимы ввиду того, что у добровольцев, запивавших атенолол апельсиновым соком, средняя частота сердечных сокращений была значительно выше по сравнению с лицами, запивавшими препарат водой, что может потребовать увеличения дозы атенолола, следовательно, приведет к увеличению риска развития дозозависимых НР [72].
Употребление кофе, других напитков, содержащих в своем составе кофеин (энергетические безалкогольные напитки, кока-кола и др.), чая, какао, шоколада усиливает стимулирующее действие и токсическое действие на центральную нервную систему сальбутамола, салметерола, эпинефрина, аминофиллина, теофиллина, повышает токсичность дигоксина [73].
Заключение
МЛВД – потенциально опасное явление, т.к. оно может приводить как к аддитивному эффекту, усиливая действие ЛС, так и к снижению эффективности ЛС, что ведет к неэффективному лечению. Минимизация полипрагмазии, выявление факторов риска, консультирование пациентов, направленное на правильный прием ЛС, а также повышение осведомленности специалистов о возможных НР помогут снизить риск развития МЛВД и взаимодействий ЛС с пищевыми продуктами.
Вклад авторов. Д.А. Сычев, О.Д. Остроумова – концепция, дизайн исследования, редактирование. А.П. Переверзев, А.И. Кочетков, М.В. Клепикова, Е.Ю. Эбзеева, В.А. Дё – сбор и обработка материала. М.С. Черняева – написание текста.



