Фторхинолоны, впервые одобренные для медицинского применения в 1980-е гг., относятся к числу наиболее широко используемых антибактериальных препаратов. Совокупность основных фармакологических свойств (широкий спектр антимикробной активности, оригинальный механизм действия, благоприятные фармакокинетические свойства и хорошая переносимость) служит основанием для их назначения при широком круге внебольничных и нозокомиальных инфекций.
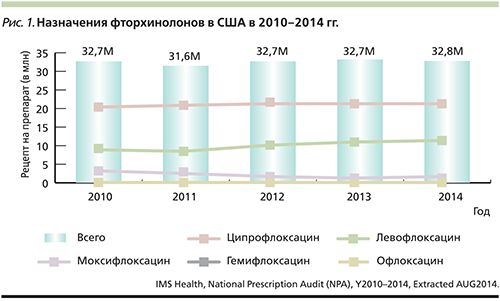
Введение различных галогенов и замещающих групп в разные позиции хинолонового ядра позволило синтезировать массу препаратов группы фторхинолонов четырех поколений с разным соотношением «польза–риск». Разработка некоторых представителей данного класса была прекращена еще на домаркетинговой стадии, другие из-за проблем с безопасностью были отозваны уже в пострегистрационном периоде, например товафлоксацин (гепатотоксичность) и грепафлоксацин (развитие угрожающих жизни сердечных аритмий). Ряд фторхинолонов, в частности ломефлоксацин и спарфлоксацин, обладающих более высоким риском фото- и кардиотоксичности, были вытеснены с рынка многих стран другими препаратами с лучшим соотношением «польза–риск». Так, на фармацевтическом рынке США осталось лишь пять фторхинолонов, причем объем их назначений в последние годы показывает, что некоторые из них также теряют свое клиническое значение (рис. 1). Единственный фторхинолон, назначения которого в течение многих лет остаются на стабильном уровне, – это ципрофлоксацин, а препарат, число назначений которого продолжает расти, – это левофлоксацин [1]. Среди примерно 33 млн рецептов на фторхинолоны, выписанных в США в 2014 г., на эти 2 препарата приходилось приблизительно 22 млн (ципрофлоксацин – около 20 млн, левофлоксацин – 11,3 млн), в то время как число назначений на гемифлоксацин составило лишь 7006, офлоксацин – 9500, а моксифлоксацин – 609 тыс. Аналогичная ситуация наблюдается и в европейских странах, где назначения ципрофлоксацина и левофлоксацина превышают 50% (медиана – 73%) от назначений всех фторхинолонов [2].
Основанием для роста потребления левофлоксацина служит его более благоприятное соотношение «польза–риск» по сравнению со многими другими фторхинолонами, о чем свидетельствуют результаты не только клинических, но и широко проводящихся в настоящее время фармакоэпидемиологических исследований.
Фармакологические свойства левофлоксацина
Левофлоксацин имеет широкий спектр антибактериального действия, включающий большое число грамположительных и грамотрицательных аэробных микроорганизмов, в т.ч. внутриклеточные бактерии (Mycoplasma pneumonia, Chlamydia pneumoniae и Legionella pneumophila), микобактерии туберкулеза и Pseudomonas aeruginosa. Он относится к числу т.н. респираторных фторхинолонов, проявляющих высокую эффективность в отношении основных возбудителей инфекций верхних и нижних дыхательных путей, в т.ч. Streptococcus pneumoniae, резистентной к пенициллинам и макролидам. Левофлоксацин активен в отношении патогенов семейства Enterobacteriacae и в отличие от большинства других препаратов своей группы проявляет антисинегнойную активность, что служит основанием для его назначения при нозокомиальных инфекциях, в т.ч. вызванных мультирезистентными микроорганизмами.
Левофлоксацин характеризуется отличными фармакокинетическими свойствами, абсолютной (100%) биодоступностью при приеме внутрь, достаточно длительным периодом полувыведения (6–8 часов), обеспечивающим высокие концентрации препарата в крови, превышающие МПК90 для многих микроорганизмов, включая основных возбудителей инфекций дыхательных путей и патогенов семейства Enterobacteriacae, на протяжении более 24 часов, большим объемом распределения (90–110 л) и хорошим проникновением в ЛОР-органы, легкие, слизистую оболочку бронхов, мокроту, бронхоальвеолярную жидкость, предстательную железу и простатическую жидкость, гинекологические органы, печень, желчевыводящие пути, кожу, кости и суставы. Выделяясь преимущественно почками, он создает высокие концентрации в моче. Препарат хорошо проникает в фагоциты и накапливается внутриклеточно [2].
Сочетание широкого спектра действия и фармакокинетических свойств обеспечивает эффективность левофлоксацина при инфекциях различной локализации, включая нозокомиальную и внебольничную пневмонии, инфекции верхних дыхательных путей, кожи и мягких тканей, мочевыводящих путей; хронический простатит и лекарственно-устойчивый туберкулез.
Безопасность и переносимость левофлоксацина
В последние десятилетия все большее значение уделяется проблемам безопасности фторхинолонов, которые оказывают существенное влияние на выбор конкретного препарата конкретному пациенту. Благодаря развитию систем фармаконадзора в разных странах и внедрению электронных баз данных пациентов значительно расширились возможности оценки безопасности и переносимости лекарственных средств не только в клинических исследованиях, но и в условиях реальной клинической практики. Ниже приведены данные о безопасности левофлоксацина по сравнению с другими антибактериальными средствами, прежде всего прочими препаратами фторхинолонов, а также факторы риска развития редких серьезных нежелательных реакций (НР) препаратов этой группы, которые необходимо учитывать для повышения безопасности пациента.
В клинических исследованиях, участниками которых были примерно 7000 пациентов с инфекциями кожи, дыхательных и мочевыводящих путей, левофлоксацин по переносимости по крайней мере не уступал амоксициллину/клавуланату, имипенему, кларитромицину, азитромицину, цефтриаксону, цефуроксима аксетилу, цефдиниру и цефаклору [3], а частота его серьезных НР в реальной медицинской практике в расчете на 1 млн назначений в первые 39 месяцев пребывания на рынке США (15 млн рецептов) составила: разрывы сухожилий – 4, нарушения вкуса – 3, судороги – 2, фоточувствительность – 1, гепатит – 1, печеночная недостаточность – 1, удлинение интервала QT – 1, пируэтная аритмия – 1, эмпиема – 1,7 [4]. Анализ базы данных Фармаконадзора Италии также показал, что относительный риск развития НР при применении левофлоксацина, ципрофлоксацина и норфлоксацина не отличался от такового для пероральных антибиотиков других классов, в то время как циноксацин и моксифлоксацин ассоциировались с более высоким риском [5].
В клинических исследованиях левофлоксацина наиболее распространенной НР была диарея, встречавшаяся с частотой 4–6%, что существенно ниже, чем при применении пероральных пенициллинов или цефалоспоринов [6]. НР со стороны ЦНС (головная боль, головокружение и нарушения сна), являющиеся классовым эффектом фторхинолнов, при лечении левофлоксацином (1%) наблюдались реже, чем при лечении гатифлоксацином и моксифлоксацином (2–3%).
Серьезные НР со стороны ЦНС, в частности судороги при использовании любых фторхинолонов, включая левофлоксацин, преимущественно встречаются у пациентов с факторами риска их развития: эпилепсией, травмой головного мозга, гипоксией, метаболическими нарушениями, и саморазрешаются после отмены препарата [7]. Фактором риска развития судорог также является сопутствующий прием нестероидных противовоспалительных средств.
Другой НР, характерной для всех фторхинолонов, является фототоксичность. Наиболее высоким потенциалом фототоксичности обладают лекарственные средства, имеющие атом галогена в 8-й позиции хинолонового ядра – флероксацин, клинафлоксацин, спарфлоксацин и ломефлоксацин [8]. Так, при применении двух последних препаратов он составляет 8–10% и более [7, 9], в то время как при применении левофлоксацина не превышает 0,1% [8].
Частота кожных сыпей при применении левофлоксацина составляет 0,2% по сравнению с 2,0% при применении моксифлоксацина, 2,8–4,8% – гемифлоксацина, 5,1% – спарфлоксацина [8, 10]. Серьезные аллергические реакции при его использовании развиваются крайне редко. За почти 20-летний период широкого применения левофлоксацина в реальной медицинской практике было опубликовано всего 4 случая токсического эпидермального некролиза [10]. Частота анафилактоидных реакций при лечении левофлоксацином сопоставима с таковой при применении большинства препаратов этой группы – 1,8–23 на 1 млн дней лечения [10], и, по-видимому, значительно ниже, чем при использовании моксифлоксацина [11, 12]. Так, по данным органов Фармаконадзора Германии, среди 166 спонтанных сообщений о развитии анафилаксии при применении фторхинолонов 54% были связаны с использованием моксифлоксацина [13]. Частота развития анафилаксии на 1 млн суточных доз составила для моксифлоксацина 3,3, в то время как для левофлоксацина – 0,6, а для ципрофлоксацина и офлоксацина – по 0,2. Следует отметить, что повышение частоты реакций гиперчувствительности на фторхинолоны, наблюдающееся в последнее десятилетие, некоторые эксперты связывают именно с внедрением в медицинскую практику моксифлоксацина [11, 12].
Гепатотоксические реакции при применении фторхинолонов преимущественно носят идиосинкразический (не зависимый от дозы и непредсказуемый) характер. Повышение уровней АСТ и АЛТ наблюдается у 2–3% пациентов, получающих препараты этой группы.
В клинических исследованиях левофлоксацина гепатобилиарные поражения (нарушение функции печени, повышение уровней печеночных ферментов и щелочной фосфатазы) встречались в 0,1–1% случаев [10]. Частота гепатита, некроза печени и печеночной недостаточности при лечении левофлоксацином, согласно данным Фармаконадзора Франции, составляет <1 5="" 14="" fda="" 2="" 1="" 10="" 58="" 10="" 6="" 6="" 6="" 0="" 15="" 9="" 16="" 2008="" ema="" 2010="" 17="" 18="" p="">
Фторхинолоны относятся к антибактериальным средствам, ассоциирующимся с наиболее высоким риском поражения опорно-двигательного аппарата, что, возможно, объясняется их способностью образовывать хелатные комплексы с двух- и трехвалентными катионами и оказывать токсическое действие на коллаген. При их применении возможны поражения сухожилий, хрящей, костей и мышц.
Диффузная мышечная боль, часто в сочетании с мышечной слабостью, обычно возникает на первой неделе лечения и в большинстве случаев саморазрешается в течение 1–4 недель после отмены фторхинолонов. Однако есть сообщения о персистировании мышечной боли на протяжении 6 месяцев и более [19]. Риск тяжелых поражений мышц, включая рабдомиолиз, повышается при одновременном приеме статинов [20, 21], а также у пациентов с исходной миопатией и миастенией [22, 23]. При применении фторхинолонов у пациентов с миастенией описаны ее тяжелые обострения, в т.ч. с летальными исходами [23]. Сравнительных данных о частоте развития поражений мышц при применении разных препаратов фторхинолонов в доступной литературе найти не удалось.
Опасения по поводу хондротоксического действия фторхинолонов основаны на результатах экспериментальных исследований, в которых были показаны необратимые поражения хряща у быстрорастущих животных в постнатальном периоде. Данные о развитии артропатий у человека противоречивы, в т.ч. в связи с отсутствием единого определения термина «артропатия» и его применения для описания различных НР со стороны мышечно-скелетной системы [6]. Результаты многочисленных магнитно-резонансных исследований неодназначны и сложны для интерпретации в связи с возможными вмешивающимися факторами, а целенаправленных рандомизированных клинических исследований по изучению хондротоксичности у детей не проводилось.
Данные эпидемиологических исследований также противоречивы. Повышение риска поражения суставов при применении фторхинолонов не наблюдалось в трех из четырех ретроспективных исследований, проанализированных Forsythe и Ernst (2007), однако в одном из этих исследований выявлена корреляция между применением пефлоксацина и развитием артропатий [24]. Пятилетнее наблюдение за детьми (n=6000), принимавшими антибиотики, показало, что частота поражений сухожилий или суставов при применении левофлоксацина, офлоксацина или ципрофлоксацина составляет <1% и сопоставима с таковой при применении азитромицина [25]. В систематическом обзоре, оценивавшем эффективность и безопасность ципрофлоксацина у новорожденных, доказательств остеоартикулярной токсичности не найдено [26]. Левофлоксацин, по результатам анализа клинических исследований с участием детей старше 6 месяцев с внебольничной пневмонией и средним отитом, чаще (1,6%) вызывал мышечно-скелетные поражения, чем β-лактамные антибиотики и макролиды (0,7%), однако на полученные результаты могло повлиять включение в эти исследования детей с исходными заболеваниями суставов [27].
Таким образом, имеющиеся данные не позволяют однозначно подтвердить наличие повышенного риска артропатий у детей при лечении наиболее широко применяемыми препаратами фторхинолонов. Тем не менее детский возраст и беременность относятся к противопоказаниям к применению фторхинолонов.
У взрослых пациентов фторхинолон-ассоциированная артралгия предположительно развивается в 1% случаев, однако ее точная распространенность не известна. Также остается не выясненной связь артралгии с наличием исходных структурных изменений у пациента. Исследований, посвященных оценке риска развития собственно артропатий у взрослых пациентов, не проводилось.
Тендинопатии (тендинит и разрыв сухожилия, преимущественно Ахиллова) описаны при лечении всеми препаратами фторхинолонов для системного применения. Cогласно результатам систематических обзоров, тендинопатии несколько чаще наблюдаются при применении офлоксацина, пефлоксацина и ципрофлоксацина, чем других препаратов этой группы [28, 29]. Риск их развития при применении офлоксацина и левофлоксацина зависит от дозы и продолжительности применения [30].
В эпидемиологических исследованиях частота развития тендинопатий при применении фторхинолонов составила 1:2000 [6], по данным FDA – 1,3-5,6 на 10 тыс. пациенто-лет [31]. Однако у пациентов с факторами риска (см. таблицу) вероятность их развития существенно повышается. Например, у лиц, перенесших трансплантацию почки, она может достигать 12,2–15,6% [32], а в возрасте старше 80 лет – увеличиваться в 20,4 раза [33]. В случае если при первых симптомах не принимаются адекватные терапевтические меры, поражение часто прогрессирует до разрыва сухожилия. Примерно у половины пациентов с разрывом сухожилий в недавнем анамнезе имелся прием глюкокортикостероидов [28].
В экспериментах на животных выявлено угнетающее действие фторхинолонов на заживление переломов костей [34]. Клиническое значение этой находки остается неясным, но до его выяснения авторы рекомендовали не применять фторхинолоны в периоперационном периоде пациентам, перенесшим эндопротезирование.
Фторхинолоны наряду с макролидами и азолами относятся к числу антимикробных препаратов, применение которых наиболее часто ассоциируется с удлинением интервала QT на ЭКГ [36]. Значительное удлинение интервала QT способствует развитию пируэтной аритмии (torsade de pointes) – потенциально фатальной полиморфной желудочковой тахикардии.
В связи с повышенным риском развития torsade de pointes с мирового фармацевтического рынка были отозваны грепафлоксацин и оригинальный препарат спарфлоксацина. Механизм удлинения интервала QT связан с блокадой калиевых каналов hERG ((human ether-a-go-go-related), прежде всего приводящей к ингибированию быстрого компонента калиевого тока замедленного выпрямления (IKr) из миоцитов, накоплению ионов калия в миоцитах и замедлению реполяризации желудочков.
Препараты фторхинолонов различаются по способности ингибировать hERG-каналы и как следствие – по способности индуцировать пируэтную аритмию [37]. По степени ингибирующего действия на hERG-каналы фторхинолоны можно расположить в следующем порядке: спарфлоксацин >грепафлоксацин >моксифлоксацин >гатифлоксацин >левофлоксацин >ципрофлоксацин >офлоксацин, что совпадает с ранжированием фторхинолонов по частоте регистрации удлинения QT на ЭКГ [10].
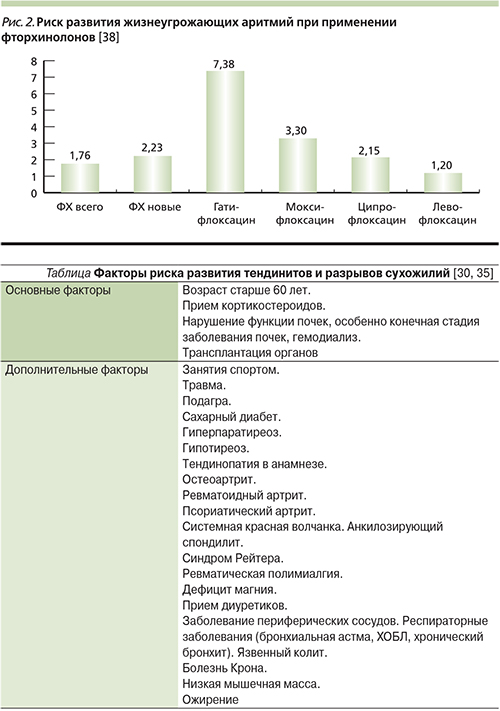
Риск развития жизнеугрожающих аритмий при применении разных препаратов фторхинолонов, согласно результатам популяционного исследования, проведенного в Канаде в 1990–2007 гг. (1838 случаев) [38], представлен на рис. 2.
Среднее удлинение интервала QT, вызываемое фторхинолонами (3–6 мс) у пациентов с нормальным интервалом QT (450–470 мс), не имеет существенного клинического значения. Однако у лиц с исходным интервалом QT >500 мс применения фторхинолонов следует избегать.
К факторам риска удлинения QT относятся:
- женский пол;
- пожилой возраст;
- гипокалиемия, выраженная гипомагниемия;
- брадикардия;
- недавняя кардиоверсия при фибрилляции предсердий, особенно препаратами, удлиняющими QT;
- хроническая сердечная недостаточность;
- гипертрофия левого желудочка;
- желудочковая аритмия;
- лечение дигоксином;
- одновременное использование 2 препаратов, удлиняющих QT;
- наследственная предрасположенность к удлинению QT [6, 40].
Поскольку степень удлинения интервала QT зависит от концентрации фторхинолонов, риск аритмии увеличивается под влиянием факторов, повышающих концентрации этих препаратов в крови или снижающих их клиренс, в т.ч. при нарушении функции почек или печени, на фоне лекарственных взаимодействий, при очень быстром внутривенном введении [6, 39].
Результаты недавно опубликованного пилотного исследования позволяют предположить, что риск влияния левофлоксацина на продолжительность интервала QT зависит от циркадианных ритмов и может быть снижен путем адаптации времени его введения к суточным колебаниям сердечно-сосудистых показателей [40]. Максимальное повышение риска удлинения интервала QT наблюдалось в случае введения препарата в 14.00, минимальное – в 6.00, однако эти данные требуют подтверждения в дальнейших исследованиях.
В ряде исследований была выявлена ассоциация между применением фторхинолонов и нарушением гомеостаза глюкозы. Максимальный риск развития гипогликемии характерен для гатифлоксацина [41, 42]. В сравнительном исследовании риск развития гипогликемии при применении гатифлоксацина в 2,81 раза превышал таковой при применении левофлоксацина [41]. Кроме того, гатифлоксацин ассоциировался с высоким риском развития гипергликемии (отношение шансов – 16,7), в то время как при применении других фторхинолонов риска развития этого осложнения не выявлено [42, 43]. Повышенный риск дисгликемии в сочетании с риском развития галлюцинаций, лекарственного поражения печени и пурпуры послужили основанием к прекращению применения гатифлоксацина в ряде стран [32].
О хорошей переносимости левофлоксацина свидетельствуют и результаты фармакоэпидемиологического исследования в США, в котором оценивалась частота обращений амбулаторных пациентов за медицинской помощью по поводу НР фторхинолонов [44]. Расчетное число посещений в год на 10 тыс. населения оказалось минимальным при применении ципрофлоксацина – 6,4 (95% доверительный интервал [ДИ] – 4,5–8,4), максимальным – при применении моксифлоксацина – 20,7 (95% ДИ – 11,9–29,5), при лечении левофлоксацином оно составило 8,9 (95% ДИ – 6,2–11,5).
Таким образом, левофлоксацин обладает широким спектром антибактериальной активности в отношении разнообразных грамположительных и грамотрицательных микроорганизмов, включая P. aeruginosa, отличными фармакокинетическими свойствами, позволяющими достигать высоких концентраций в очагах инфекции различной локализации и проявлять активность в отношении внутриклеточных возбудителей, и хорошей переносимостью, по крайней мере не уступающей таковой антибиотиков других широко применяемых групп, а во многих случаях и превосходящей ее, что определяет благоприятное соотношение «польза–риск» препарата при многих внебольничных и нозкомиальных инфекциях.
Риск развития серьезных НР при применении левофлоксацина в целом ниже, чем при применении других фторхинолонов, и может быть значительно снижен путем рационального применения препарата, подразумевающего учет факторов риска развития определенных НР у конкретного пациента. Рациональное применение левофлоксацина, как и других препаратов фторхинолонов, также позволит снизить темпы нарастания антибиотикорезистентности к ним, которое в настоящее время вызывает беспокойство у медицинской общественности. В частности, на это направлено недавно выпущенное предостережение FDA о необходимости ограничения применения фторхинолонов при острых синуситах, обострениях хронического бронхита и инфекциях мочевыводящих путей, для лечения которых существуют альтернативные опции. Кроме того, в качестве меры, потенциально позволяющей снизить риск развития резистентности, рассматривается применение коротких 5-дневных курсов левофлоксацина в высокой дозе (750 мг) [2, 45]. Данный режим терапии позволяет создавать более высокие концентрации антибиотика в крови, быстрее устранять симптомы инфекции и повышать приверженность пациентов терапии. При этом профиль безопасности и частота побочных эффектов левофлоксацина при применении в дозах 500 и 750 мг существенно не различались как в клинических, так и в фармакоэпидемилогических исследованиях.
С целью снижения стоимости лечения левофлоксацином целесообразно использовать его эффективные генерики, в частности препарат Леволет Р (Доктор Реддис Лабораторис).



