Введение
Острая респираторная инфекция (ОРИ) имеет характерную клиническую картину и, как правило, начинается с назальных или глоточных симптомов: в 42–46% случаев – с боли и першения в горле, ринореи и заложенности носа (назальной обструкции). У незначительной части пациентов (около 3% в среднем) дебют болезни сопровождается сухим навязчивым кашлем. Менее чем через 48 часов от появления первых симптомов клинические проявления болезни нарастают, и на вторые-третьи сутки до 97% больных имеют назальные симптомы: до 87% – боль в горле и до 65% – кашель [28]. Такие симптомы, как головная боль, лихорадка, миалгия, встречаются редко, могут отсутствовать или выражены незначительно. Средняя продолжительность эпизода ОРИ составляет 7,4 дня, в 25% случаев – до двух недель, летальные исходы чрезвычайно редки.
Поскольку данная группа заболеваний обладает способностью к саморазрешению, встречается ежегодно и имеет высокую сезонную распространенность в холодное время года, что привычно для большинства стран мира, естественно предположение, будто вирусные инфекции респираторного тракта, особенно его верхних отделов, не представляют большой социальной и медицинской проблемы. Однако ежегодно в США более 20 млн визитов к врачу и 40 млн потерянных школьных и рабочих дней связаны с ОРИ, а общие экономические потери могут составлять при теоретических расчетах до 40 блн долл. и более [2].
В 2015 г. средний американский домовладелец сделал 26 посещений торговых точек и потратил за год 338 долл. на безрецептурные медикаменты для лечения ОРИ [20]. Неудивительно, что в топе 10 самых дорогих заболеваний в мире ОРИ занимает первое место. Около 70% населения переносят ОРИ до 3 раз в год, дети, особенно в организованных коллективах, имеют в среднем 4–6 эпизодов в год. Известно, что истинная частота острой респираторной вирусной инфекции (ОРВИ) выше официальной статистики вследствие того, что многие вирусные инфекции протекают асимптоматически или в легкой форме и не служат причиной обращения к врачу.
Тем не менее, рассчитывая на благоприятное, без осложнений течение ОРВИ, не следует забывать о группах риска, к которым относятся дети раннего возраста, особенно первого года жизни, недоношенные, находящиеся на искусственном вскармливании, имеющие гастроэзофагальный рефлюкс, дети с бронхолегочной дисплазией, бронхиальной астмой, врожденными пороками сердца, вторичными или первичными иммунодефицитными состояниями. Причиной тяжелого течения ОРВИ могут быть различные группы вирусов, особенно с ноября по февраль, когда отмечается пик подъема заболеваемости.
В развитых странах частота бронхиолита у госпитализированных детей младше года составляет 18% [11], из них до 6% требуют госпитализации в отделение реанимации и интенсивной терапии, 2–3% детей нуждаются в искусственной вентиляции легких.
В 60% случаев бронхиолита полимеразная цепная реакция (ПЦР) выявляет респираторно-синцитиальный (РС) вирус, в 26% – риновирус, считавшийся до конца ХХ в. главной причиной сезонных инфекций верхних дыхательных путей, отличающихся благоприятным течением [3, 7, 19, 33].
Этиология ОРВИ
J.O. Wishaupt et al. (2017), исследуя назальные смывы с помощью ПЦР у детей с ОРВИ, выявили, что в 59,1% случаев имеет место моновирусная инфекция, в 22,5% определяется несколько вирусов, но при этом нет различий в клинической картине между моно- и микст-вирусной инфекциями, и нельзя говорить о клинической специфичности вирусов: она не была обнаружена. В структуре респираторной вирусной инфекции у детей младше 12 лет, по данным J.O. Wishaupt et al., ведущее место занимают РС-вирусы, затем риновирусы (см. таблицу).
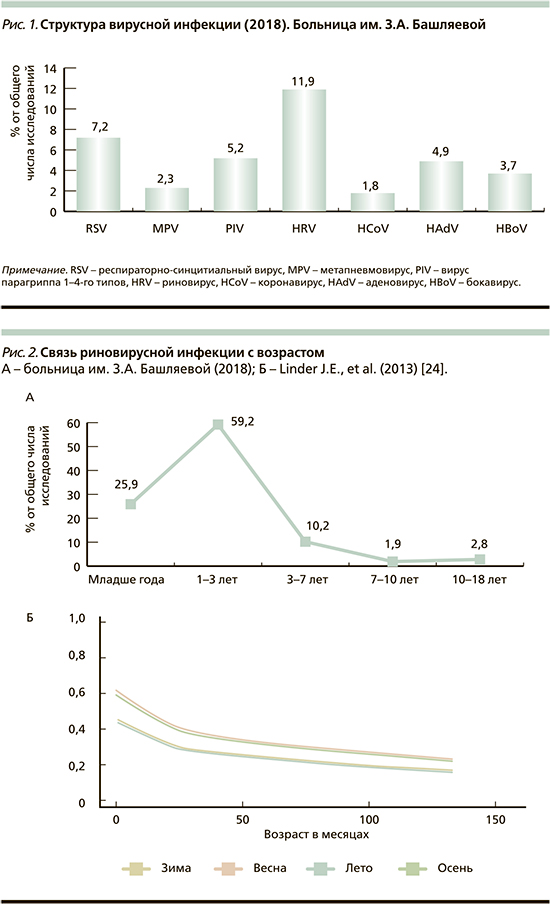
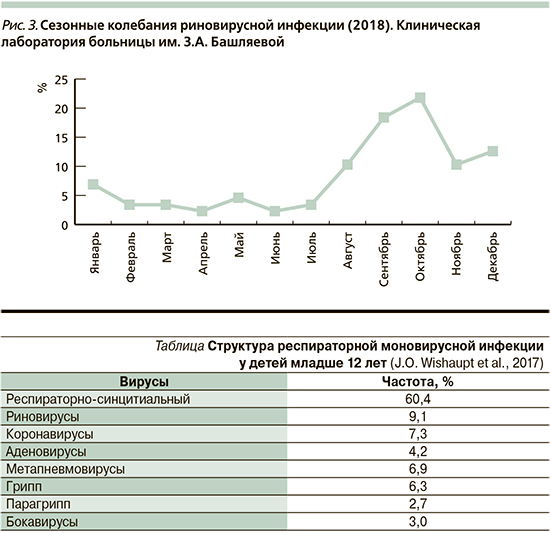
В 2018 г. в течение 12 месяцев проведено изучение структуры респираторной вирусной инфекции у детей, поступивших в клиническую больницу им. З.А. Башляевой. Согласно данным клинической лаборатории больницы, в 2018 г. у детей, поступивших в клинику с ОРИ, доминировали риновирусы, выявленные в 11,9% исследований. Выводы были сделаны на основании изучения назальных смывов у 1081 ребенка методом ПЦР с гибридизационно-флуоресцентной детекцией, вариант FRT «АмплиСенс ОРВИ-скрин-FL» (Методические рекомендации от 03.08.2015). Обнаружено, что основную группу больных риновирусной инфекцией составляли дети от года до 3 лет (59,2%), затем дети до года (25,9%), у детей старшего возраста риновирус встречался намного реже (рис. 1 и 2). Аналогичные данные ранее были получены J.E. Linder et al. [24]. Согласно проведенному 20-летнему анализу, выполненному под руководством J.E. Linder [24], риновирус чаще выявляется в сентябре [24], по данным клинической лаборатории больницы им. З.А. Башляевой, в 2018 г. пик подъема инфекции отмечался в сентябре и октябре (рис. 3).
Варианты течения риновирусной инфекции
С учетом значимой роли риновируса человека в развитии ОРИ представляется интересным рассмотрение особенностей течения риновирусной инфекции у детей. Согласно литературным данным, клинические признаки риновирусной инфекции могут быть как минимальными, так и проявляться заболеваниями нижних отделов респираторного тракта [5, 8, 9, 11, 18, 19, 25, 28, 32, 35, 40–42].
Наиболее распространенные варианты течения риновирусной инфекции:
- • асимптоматическое;
- • Common Cold («Простудные заболевания», термин принят в англоязычной литературе);
- • острый средний отит;
- • риносинусит;
- • синдром крупа;
- • бронхиолит;
- • внебольничная пневмония.
Асимптоматическое течение. Асимптоматическое течение риновирусной инфекции встречается часто, особенно у детей. Выявление HRV (Human rhinovirus) у пациентов, не имеющих симптомов болезни, может быть следствием трех причин: пролонгированной персистенции вируса после разрешившейся симптоматической риновирусной инфекции, нераспознанной инфекции вследствие неярко выраженных симптомов, инкубационного периода перед манифестацией болезни. У детей первых 4 лет жизни частота асимптоматического течения составляет от 12 до 32% [8, 18, 32, 40, 41] с тенденцией к нарастанию в раннем возрасте.
Common Cold. Common Cold, или «простудное заболевание», – это сезонное острое респираторное заболевание верхних дыхательных путей, которое обычно вызывается вирусной инфекцией и протекает с симптомами, включающими ринорею и назальную обструкцию (заложенность носа). Ринорея и назальная обструкция достигают максимальной выраженности через 48–72 часа после инокуляции вируса [19]. Common Cold нередко сопровождается болью в горле, чиханием, общим недомоганием, лихорадкой и кашлем [28].
Изучение роли риновирусной инфекции с использованием двух методов (ПЦР и культуры вируса) показало, что риновирус является этиологическим фактором в 50–66% случаев всех простудных заболеваний [1, 27]. Common Cold у лиц с хорошим иммунным статусом относится к саморазрешающимся заболеваниям со средним инкубационным периодом 2 дня и длительностью симптомов от 7 до 14 дней [6, 14, 22, 34], но возможно появление первых симптомов болезни (чихание, боли в горле и першение) в первые 2–10 часов после инокуляции вируса [15].
Острый средний отит. Осложняет течение риновирусной инфекции приблизительно у трети детей, особенно раннего возраста [42]. Кроме среднего отита могут быть дисфункция евстахиевой трубы и чувство заложенности ушей в результате изменения среднего ушного давления. При проведении проспективного мониторинга [4] у 329 детей с отитом в возрасте от 2 месяцев до 2 лет ПЦР выявила риновирусы в 41% случаев в назофарингеальном аспирате и в экссудате из полости среднего уха. Дополнительную поддержку роль риновирусов в развитии среднего отита получила при исследовании аденоидной ткани, в которой риновирус был обнаружен в 45% случаев [37].
Клиническое течение острого среднего отита может не иметь связи с выделенным вирусом [38]. Как показывает анализ эффективности терапии среднего отита у детей от 3 месяцев до 7 лет, затяжное течение болезни и рецидивирование спустя 7–30 дней после появления первых симптомов отмечаются в 18% случаев при подтвержденной риновирусной инфекции, в 21% – при коронавирусной и в 27% – при неуточненной этиологии заболевания. Коинфекция HRV с бактериями является частым спутником средних отитов. Уже в течение первых двух дней с момента манифестации среднего отита в 66% случаев возможна вирусно-бактериальная ассоциация (чаще с Moraxella catarrhalis и Streptococcus pneumoniae). У детей, склонных к частым отитам, коинфекция HRV+бактерии выявляется даже в отсутствие клинических симптомов [37, 38].
Риносинусит. У пациентов с ОРИ компьютерная и магнитно-резонансная томография часто выявляют изменения со стороны пазух, в первую очередь гайморовых и этмоидальной. Исследования аспиратов из гайморовых пазух выявляют риновирусы почти у 50% пациентов [35].
Круп. Синдром крупа не относится к частым клиническим проявлениям HRV (не более 12% всех случаев крупа). Чаще HRV у детей с крупом выявляется в период осеннего снижения температуры, с сентября по ноябрь, в то время как вирус гриппа А и РС-вирус как ведущие причины синдрома крупа превалируют в зимние месяцы, вирус парагриппа – с декабря по апрель [19].
Бронхиолит. Наиболее часто бронхиолит, вызванный HRV, встречается с ноября по февраль и в 2–6% случаев требует госпитализации в отделения реанимации и интенсивной терапии [25]. M. Ghazaly и S. Nadel [11] обнаружили, что средний возраст детей, поступавших в отделение интенсивной терапии с бронхиолитом, составлял 2 месяца [11], около 2% имели неблагоприятный коморбидный фон, летальный исход отмечался в 2,2% случаев. Самой большой возрастной группой были дети первых 42 дней жизни, дети до года в целом составили 97%.
Среди детей раннего возраста c бронхиолитом, родившихся с очень низкой массой (<1500 г), выявление риновируса отмечалось намного чаще по сравнению с РС-вирусом (40 и 7% соответственно). Общая частота выявления риновируса в этой популяции достигает 70%, риск инфицирования особенно высок у детей с бронхолегочной дисплазией и находящихся на искусственном вскармливании. Доказано, что HRV-ассоциированный бронхиолит может считаться независимым фактором риска для рецидивирования бронхообструктивного синдрома у детей 1-го года жизни и развития бронхиальной астмы в дальнейшем [30, 31]. Длительные наблюдения показывают, что риск развития бронхиальной астмы в 4 раза выше у детей, имевших в анамнезе HRV-ассоциированный бронхообструктивный синдром [21]. Поскольку развитие легких начинается на 4-й неделе гестации и продолжается весь период младенчества, HRV может оказывать прямое и непрямое выраженное отрицательное действие на ткани легких, ведущее к развитию хронических бронхолегочных заболеваний [10].
Внебольничные пневмонии. Клини-ческие исследования детей с внебольничными пневмониями обнаружили значимую этиологическую роль HRV. Как ведущая причина внебольничной пневмонии HRV выявляется у 18–26% детей, несмотря на то что очень трудно бывает установить причинную роль вируса в случаях бактериальной или вирусной коинфекции, которая встречается более чем в 60% случаев [9, 29, 44]. Клиническая манифестация HRV-ассоциированной пневмонии может быть потенциально очень тяжелой, особенно у детей с уже имеющимися хроническими заболеваниями [5]. HRV был идентифицирован у 49% детей, поступавших в отделения реанимации и интенсивной терапии с пневмонией, в то время как почти у 50% детей никаких респираторных патогенов обнаружено не было [25]. Для сравнения: у взрослых с внебольничными пневмониями HRV определялся не более чем в 5% случаев [23, 39], но при этом описаны случаи резкого ухудшения состояния и неблагоприятного исхода [16, 26].
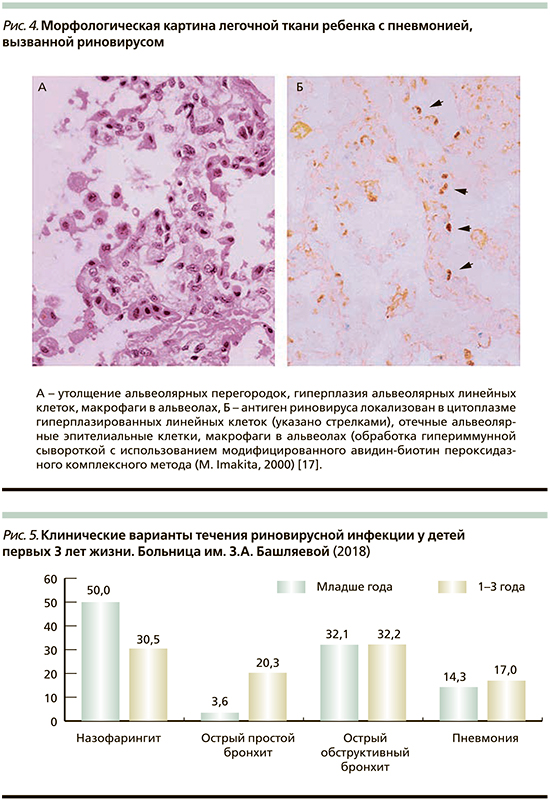
Крайне тяжелым фатальным исходом может закончиться пневмония, вызванная HRV, у больных после трансплантации стволовых клеток [13]. Изучение эндотрахеального аспирата у интубированных пациентов и жидкости, полученной при бронхоальвеолярном лаваже, выявило, что у 68% пациентов после трансплантации стволовых клеток в верхних отделах респираторного тракта определяется HRV, у 32% с HRV развивается фатальная пневмония [12]. Морфологические исследования показывают, что воспалительный инфильтрат при пневмонии, ассоциированной с HRV, скудный (рис. 4). Имеют место умеренная гиперплазия бронхиального эпителия с цитологической альтерацией, утолщение альвеолярных перегородок, выраженная гиперплазия альвеолярных линейных клеток, десквамация отечных альвеолоцитов и макрофагов в альвеолы [17].
Клиническими вариантами течения риновирусной инфекции у детей первых 3 лет жизни, поступивших в больницу им. З.А. Башляевой и составивших основную группу больных, были назофарингит, острый простой бронхит, острый обструктивный бронхит и пневмония (рис. 5). Два (7%) ребенка из 28 детей первого года жизни, возраста 3 и 4 месяцев, были госпитализированы при поступлении в больницу в отделение реанимации и интенсивной терапии с выраженным бронхообструктивным синдромом.
Значение антивирусной терапии для детей с ОРВИ
Каждые 2 года Центр по контролю за заболеваниями и их предупреждением (СТС) в США выпускает рекомендации по антивирусной терапии сезонного гриппа, из которых следует, что антивирусная терапия должна назначаться как можно раньше, не дожидаясь результатов исследования (!). Оптимальным считается назначение антивирусной терапии в первые 2 дня болезни, но и назначение в более поздние сроки (до 6-го дня с момента дебюта) позволяет уменьшить риск развития пневмонии, дыхательной недостаточности и неблагоприятного исхода. Длительность антивирусной терапии не должна быть менее 5 дней, а у пациентов групп риска может быть продлена до двух недель. Главной целью антивирусной терапии является предупреждение развития осложнений. На сегодняшний день имеются как сторонники, так и противники назначения медикаментов, способных оказывать прямое действие на вирусы. Применению антивирусной терапии препятствуют резистентность к антивирусному препарату вследствие высокого уровня мутации вирусов и феномен цитотоксичности. Тем не менее 23-я Международная конференция, организованная Международным сообществом по антивирусным исследованиям в Сан-Франциско в 2010 г., подчеркнула, что необходим поиск новых возможностей антивирусной терапии в XXI в.
К сожалению, в настоящее время в мире не существует возможности для создания вакцин ко всем группам вирусов, вызывающих заболевания респираторного тракта. В частности, имеется вероятность существования до 200 серотипов риновируса, что делает маловероятной вакцинацию для профилактики риновирусной инфекции. В результате терапия остается в основном симптоматической и базируется на безрецептурных средствах. Эффективным средством профилактики считается вакцинация против гриппа, но и ее нельзя считать совершенной вследствие того, что серопротекция достигает 60–80% у молодых людей, а у лиц старшего возраста – 40–60% [20, 37]. При всех других вариантах респираторных инфекций предупредительные мероприятия сводятся к мытью рук, ограничению контакта с больными и курящими.
Заключение
С учетом высокой частоты ОРВИ у детей в современном мире необходима разработка и внедрение антивирусных средств, не обладающих цитотоксичностью и имеющих высокую клиническую эффективность.


