Введение
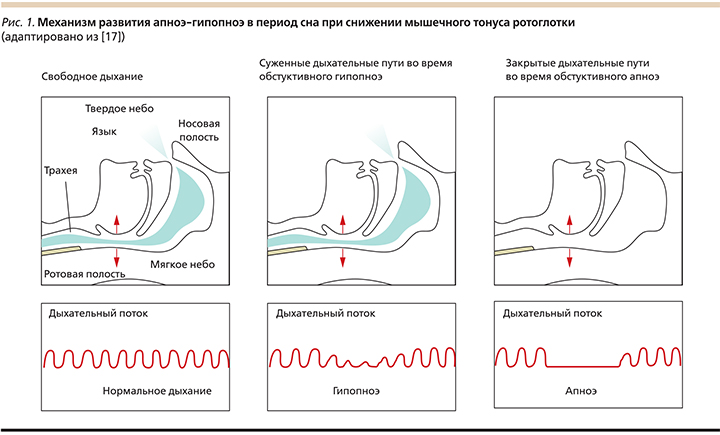
На сегодняшний день существует клиническое определение обструктивного апноэ сна (ОАС), достигнутое путем консенсуса специалистов в области пульмонологии, кардиологии, медицины сна. ОАС – гетерогенное парасомническое (сопровождающим сон) заболевание, характеризующееся глоточными коллапсами (дыхательными паузами более 10 секунд) в период сна с сохраненными респираторными усилиями, частыми ночными десатурациями (падением насыщения артериальной крови кислородом) и наличием дневных проявлений (избыточная сонливость, артериальная гипертензия, сердечные аритмии, инсулинрезистентность, метаболические нарушения), варьирующихся во времени и интенсивности, связанных с тяжестью заболевания (рис. 1) [1]. Тяжесть заболевания описывается суммарным числом событий узости (гипопноэ) и окклюзии (апноэ) глотки к 1-му часу регистрации сна (индекс апноэ-гипопноэ=ИАГ). Индекс ИАГ свыше 5 соб./ч соответствует началу болезни. ИАГ от 5 до 15 соб./ч соответствует легкому течению заболевания, ИАГ от 15 до 30 соб./ч – среднетяжелому и ИАГ свыше 30 соб./ч – тяжелому течению заболевания [2].
Связь между ОАС, факторами риска сосудистых заболеваний, метаболическими нарушениями и самими сосудистыми заболеваниями была описана в крупных проспективных клинических исследованиях [3, 4]. Более того, обнаружено, что ОАС служит независимым предиктором развития артериальной гипертензии (АГ), при этом степень тяжести ОАС коррелировала с уровнем артериального давления (АД) с поправкой на возраст, ожирение, пол [5]. В работе A.G. Logan et al. (2001) у пациентов с ожирением и апноэ впервые было верифицировано формирование резистентной АГ (РАГ). В настоящее время ОАС считается наиболее частой причиной развития РАГ, при которой изменение образа жизни и рациональная комбинированная терапия с применением адекватных доз не менее трех антигипертензивных препаратов, включая диуретик, не приводят к достижению целевого уровня АД [6, 7]. По данным современных рандомизированных клинических исследований (РКИ), процент пациентов с ОАС среди всех больных РАГ достигает 64% [8].
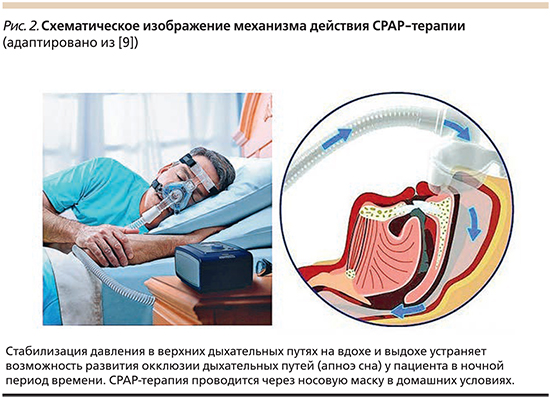
Терапия постоянным положительным воздухоносным давлением – СРАР-терапия (Continuous Positive Airway Pressure) в настоящее время cчитается патогенетическим методом терапии пациентов с ОАС (рис. 2) [9]. Особая выгода от применения СРАР-терапии установлена для пациентов с ОАС+РАГ. Мета-анализ 28 РКИ выявил значительное снижение АД на фоне СРАР-терапии даже после исключения влияния таких факторов, как степень тяжести ОАС и наличие дневной сонливости [10].
Особый интерес представляет исследование HIPARGO (рандомизированное многоцентровое открытое в параллельных группах) пациентов с ОАС+РАГ среднетяжелого и тяжелого течения. После 12 недель терапии комбинированная коррекция (лекарственная терапия+СРАР) имела достоверно выраженное снижение АД (среднесуточное диастолическое АД [ДАД] и среднее АД). Установлена нормализация циркадного ритма АД при комбинированной коррекции: доля пациентов «non-dippers» уменьшилась на 10%. Обнаружена положительная корреляционная связь между продолжительностью использования СРАР-терапии и ее гипотензивным эффектом. Линейный регрессионный анализ установил снижение АД на уровень -1,3 мм рт.ст. при каждом дополнительном часе использования СРАР-терапии [11].
Сравнение режимов лекарственной терапии с режимами комбинированной коррекции, включившими СРАР-терапию, позволило сделать вывод об очевидном преимуществе последней по нормализации цифр АД (среднесуточные ДАД и среднее АД), циркадного ритма и устранении резистентности АГ к медикаментозной терапии, что снижало риски фатальных сердечно-сосудистых событий у пациентов с ОАС+РАГ среднетяжелого и тяжелого течения [12, 13].
В настоящей публикации мы постарались на клиническом примере продемонстрировать наиболее эффективный диагностический и лечебный алгоритм лекарственной и немедикаментозной терапии коморбидного пациента с ОАС+РАГ в реальной клинической практике.
Клинический случай
Пациент 56 лет при обращении предъявлял жалобы на повышение АД, несмотря на проводимую лекарственную терапию, беспокойный сон, громкий ночной храп, ночные пробуждения с частыми посещениями туалета, «разбитость» днем и периодические засыпания за рабочим столом или при управлении автомобилем (особенно в дорожных «пробках»).
Впервые отметил повышение цифр АД до 160/100 мм рт.ст. 9 лет назад, по поводу чего неоднократно обращался к кардиологам и проходил стационарное лечение с подбором уровня лекарственной терапии, включившей двойную комбинацию ингибитора ангиотензинпревращающего фермента (иАПФ) и блокатора кальциевых каналов (амлодипин). Из факторов риска имеет активное курение с индексом 20 пачка/лет. Злоупотребление алкоголем и другие вредные привычки отрицает. В период с 2012 по 2018 г. отмечал прирост массы тела >10 кг, устойчивое повышение уровня гликозилированного гемоглобина (HbA1c) от 9,7 до 10,7%, формирование сердечной недостаточности (СН) второй Б-стадии (2Б) с сохраненной фракцией выброса левого желудочка (ФВ=50%). Основной диагноз пациента был сформулирован кардиологами: «гипертоническая болезнь 2-й стадии, 2-й степени. Метаболический синдром. Сахарный диабет 2 типа». В соответствии с ним он регулярно получал подобранную антигипертензивную, гиполипидемическую и сахароснижающую терапию современными комбинированными лекарственными препаратами – 3-компонентная терапия (рис. 3).
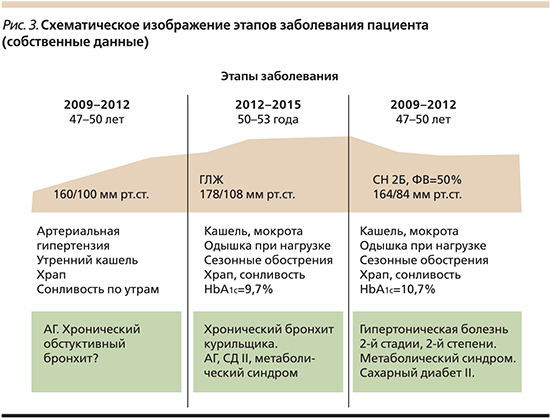
Развитие соответственно возрасту. Индекс массы тела (ИМТ)=37,6 кг/м2. Женат. По профессии инженер, производственных факторов риска нет. Из вредных привычек – табакокурение с уровнем 20 пачка/лет. Травмы, операции, переливания крови, тяжелые инфекции и любые кардиоваскулярные события (инсульты, инфаркты) отрицает.
Пронализировав клиническую картину заболевания, характер проводимой терапии, ее объем и эффективность, мы постарались сформулировать основные клинические вопросы, определившие дальнейшую лечебную доктрину.
- Почему у пациента в возрасте 56 лет, несмотря на подобранную комбинированную антигипертензивную, гиполипидемическую и сахароснижающую терапию, сохраняются жалобы на плохой контроль АД и HbA1c?
- Почему жалобы на храп, ожирение, ситуационную сонливость не нашли своего клинического обоснования?
- Какое состояние, заболевание или синдромокомплекс мешают успеху терапии и формируют устойчивую к лекарствам АГ – РАГ?
К сожалению, наши простые вопросы поставили в тупик практикующих кардиологов. Они не смогли сформировать внятной позиции в отношении низкой эффективности лекарственной терапии АГ и формирования ее резистентности – РАГ. По нашему мнению, причиной служит неправильная оценка «специфических жалоб», существующих у пациента на протяжении 9 лет, а именно: 1) беспокойный сон, 2) дневная сонливость, 3) громкий ночной храп. Кроме того, они хорошо корреспондируют с быстрым приростом массы тела (>10 кг), частыми ночными походами в туалет и увеличением уровня HbA1c. Использование в повседневной врачебной практике специализированных вопросников для таких случаев, например вопросника STOP BANG, позволяет быстро распутать «клинический клубок» симптомов/жалоб и расставить их по «клиническим полкам» (см. таблицу). Предлагаемый вопросник, имеющий русскоязычную валидизацию и высокий уровень чувствительности, позволяет достоверно предсказывать явления ОАС у терапевтических пациентов различных групп [14].
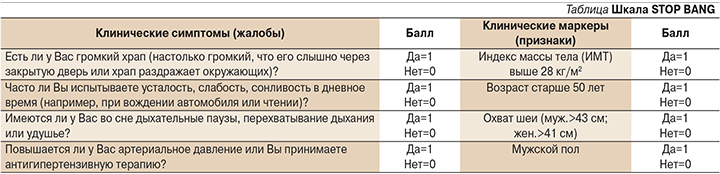
Низкая вероятность обнаружения ОАС соответствует уровню в 0–2 балла; средняя – уровню в 3–4 балла; высокая – уровню в 5–8 баллов. Чувствительность шкалы STOP BANG в верификации легкого течения ОАС (уровень ИАГ>5 соб./ч) составляет 65,6%, специфичность – 60%. Те же показатели для среднетяжелого течения ОАС (ИАГ>15 соб./ч) составляют соответственно 74 и 53%. Для тяжелого течения ОАС (ИАГ>30 соб./ч) шкала имеет чувствительность 80% и специфичность 49% [15].
После специализированного опроса по шкале STOP BANG был установлен уровень в 7 баллов, что говорило о высокой вероятности ОАС у нашего пациента. Именно ОАС выступало в качестве коморбидного заболевания, приводившего к стойкому нарушению липидного обмена, инсулинрезистентности и благодаря своим патогенетическим механизмам воздействия на ренин-ангиотензин-альдостероновую систему (РААС), формирующего РАГ с развитием СН с сохраненной фракцией выброса [16].
1. Какой диагностический метод позволил бы достоверно верифицировать тяжесть явлений ОАС у пациента?
2. Потребуется ли в нашем случае специализированная диагностика в условиях стационара, оснащенного полисомнографической техникой?
На сегодняшний день диагностика ОАС возможна в амбулаторных условиях или в условиях отделения функциональной диагностики любой больницы или поликлиники. Фактически современные диагностические комплексы представляют собой носимые портативные устройства (по типу мониторирования ЭКГ по Холтеру) с 2 легкоодеваемыми датчиками и программируемым включением и отключением. Такие устройства относят к категории полиграфии, поскольку они позволяют достоверно верифицировать ОАС. Пациент самостоятельно устанавливает датчики за 15–20 минут до сна в соответствии с имеющейся инструкцией и возвращает полиграфическое устройство по окончании диагностической ночи. Все пациенты с АГ, имеющие средний и высокий риски верификации ОАС, должны быть подвергнуты специализированной аппаратной диагностике в амбулаторных или стационарных условиях [16].
В нашем случае после одной диагностической ночи в домашних условиях нам удалось верифицировать ИАГ=58 соб./ч с явлением ночной гипоксемии (падение сатурации крови – SpO2 ниже 90% более 5 минут с одномоментным снижением ниже SpO2<85%), явлениями ночной тахибрадикардии (изменение частоты сердечных сокращений от 40 до 120 уд/мин), что объективно говорило о диагнозе «обструктивное апноэ сна, тяжелое течение, выраженная ночная гипоксемия, ночная тахи-брадикардия. Риск кардиоваскулярных осложнений 4».
3. Какая терапия ОАС приоритетная для нашего пациента?
4. Какова эффективность СРАР-терапии по контролю рисков фаталь-ных и нефатальных кардиоваскулярных событий у нашего пациента (категория жизнь-сберегающей терапии)?
СРАР-терапия в настоящее время является единственной обоснованной патогенетической стратегией терапии пациентов с ОАС [9]. В случаях пациентов с ОАС+РАГ, тяжелым течением ОАС и с выраженной гипоксемией только СРАР-терапия способна воздействовать на основные патогенетические механизмы апноэ и гипертензии. Крупнейшее клиническое исследование последних лет (мета-анализ 28 РКИ) выявил значительное снижение АД на фоне СРАР-терапии даже после исключения влияния таких факторов, как степень тяжести ОАС и наличие дневной сонливости [10]. Руководствуясь принципами добросовестной клинической практики (GCP – good clinical practice), мы выполнили подбор лечебного давления СРАР (мбар) в течение 5 ночей с установлением оптимального уровня терапии, устраняющего 95% всех событий апноэ-гипопноэ. Им стал уровень СРАР=16 мбар с функцией авто-адаптации к вдоху и выдоху пациента (A-Flex-терапия). Контролируемый СРАР-терапией уровень ИАГ составил 5,6 соб./ч, что исключало риски любых нежелательных кардиоваскулярных событий (требуемый достоверный порог ≤10 соб./ч), а значит, по своей сути выполняло требование жизнь-сберегающей терапии.
5. Какова переносимость и выполнимость СРАР-терапии в домашних условиях?
Вопросы переносимости и податливости (приверженности) пациентов с ОАС лечению являются основными при длительном выполнении СРАР-терапии. Современные аппаратные комплексы, работающие в автоматическом режиме, позволяют практикующему специалисту контролировать ряд параметров в ходе проводимой СРАР-терапии. Основные анализируемыми параметрами «приверженности пациентов»: 1) процент дней использования СРАР≥4 ч/ночь (PDU≥4) (%) – индекс, отражающий высокую эффективность СРАР-терапии; 2) среднее значение лечебного давления СРАР-терапии (CMP) (мбар) – индекс, отражающий уровень лечебного давления СРАР-терапии; 3) процент неконтролируемой воздушной утечки за 1 день использования СРАР-терапии (LDU) (%) – индекс, отражающий плохую переносимость СРАР-терапии.
Анализ динамики указанных показателей выявил несколько основных закономерностей. Во-первых, приверженность пациента СРАР-терапии напрямую зависела от уровня лечебного давления. Так, при снижении показателя CMP существенно повышался процент дней использования СРАР (PDU≥4), что приводило к лучшей повторяемости лечебной «дозы», устраняющей ночную гипоксию и стимуляцию РААС. С другой стороны, стабилизация лечебной «дозы», привела к уменьшению неконтролируемой воздушной утечки (LDU), что говорило о привыкании к лицевому интерфейсу (носовой маске) и положительно сказалось на ощущениях пациента (рис. 4).

«Переломным моментом» ответа на проводимую терапию в случае пациента с ОАС тяжелого течения с выраженной ночной гипоксемией явился 6-й месяц СРАР-терапии. На практике это означает, что кратковременные сеансы СРАР-терапии, использование ее длительностью от 3 до 6 месяцев не имеют требуемой эффективности. У таких пациентов сохраняются патогенетические связи между апноэ и РААС, формируется устойчивая РАГ. Достоверные изменения наступают не ранее 6-го месяца, достигая целевых значений к 12-му месяцу СРАР-терапии. Очевидно, что именно поэтому наилучшие показатели приверженности развиваются у пациентов с ОАС+РАГ только к 12-му месяцу терапии. Это должно стать важным мотивирующим фактором для практикующего специалиста сформировать для пациента с ОАС комплексную программу наблюдения с обязательными визитами каждый 3-й месяц и обязательным контролем гемодинамики, вязкости крови, липидного профиля и приверженности СРАР-терапии.
Заключение
Пациенты с ОАС, особенно имеющие РАГ, являются больными с многократно увеличенными рисками фатальных и нефатальных сердечно-сосудистых событий. Длительно проводимая СРАР-терапия является единственно обоснованной стратегией, особенно в случаях пациентов с ОАС среднетяжелого и тяжелого течения. Практикующие специалисты должны обратить на таких пациентов пристальное внимание, поскольку они имеют максимальные риски смертельного исхода или кардиоваскулярных осложнений.
Современные диагностические алгоритмы ОАС реалистичны и исполнимы в повседневной врачебной практике. Они позволяют выполнить достоверную диагностику ОАС в стационарных и амбулаторных условиях. Длительно проводимая СРАР-терапия пациентов с ОАС+РАГ является жизнь-сберегающей технологией с высокой приверженностью пациентов и обладает выраженным клиническим эффектом. Необходимо расширять границы раннего назначения СРАР-терапии, особенно для пациентов с ОАС c коморбидной патологией.


