Введение
Последние 30 лет развития технологического прогресса привели к значимым изменениям во всех областях жизни. Эволюция в пищевой, химической, биологической промышленности сделала доступными и дешевыми продукты питания с высоким содержанием легкоусвояемых углеводов, рафинированных масел. Также значительно увеличилось потребление животных жиров на фоне уменьшения в рационе пищи, богатой клетчаткой. Другой проблемой текущего времени является гиподинамия, снижение физической активности. Совокупность этих факторов принято называть «современным образом жизни», итогом которого является постоянный положительный энергетический баланс в организме. Излишки энергии запасаются в виде отложений жировой ткани, которая помимо функции хранения энергии принимает активное участие в патогенезе многих заболеваний, в первую очередь заболеваний сердечно-сосудистой системы, сахарного диабета 2 типа, злокачественных новообразований [1, 2]. В мире более 1,5 млрд человек имеют избыточную массу тела и 500 млн страдают ожирением, причем в ближайшее время, по прогнозам ВОЗ, ожидается прирост заболеваемости ожирением [8–12].
Негативные последствия ожирения связывают с увеличением риска развития онкологических заболеваний различных локализаций, в т.ч. колоректального рака (КРР) [12]. Подтверждением наличия связи этих нозологий служит значительное совпадение их географической распространенности и статистические данные. За последние 10 лет в мире КРР переместился с 6-го на 4-е место в структуре онкологической заболеваемости, а ежегодное число заболевших КРР приблизилось к 1,5 млн человек. При этом самые высокие показатели традиционно регистрируются в странах с развитой экономикой, таких как США, Канада, страны Западной Европы. Высокие темпы прироста числа заболевших КРР отмечаются в развивающихся странах, для которых характерен переход к «западному образу жизни» [13].
В связи с этим поиск факторов влияния жировой ткани (ЖТ) на развитие КРР является актуальным направлением научных поисков. При изучении ожирения в качестве компонента патогенеза развития опухоли было выявлено, что значение имеет не только количество накопленного жира – индекс массы тела (ИМТ; отношение массы тела к росту – кг/м2), но и его локализация [3]. Метаболическая активность висцерального жира, представленного в основном брыжеечным и забрюшинным жиром, большим сальником, значительно превосходит активность периферической подкожно-жировой клетчатки [4]. Помимо функции хранения энергетических запасов висцеральная ЖТ синтезирует адипокины и цитокины, влияющие на течение иммунологических, метаболических и эндокринных процессов путем участия в развитии инсулинорезистентности, провоспалительных реакций и патологическом синтезе различных ростовых факторов, приводящих к нарушениям роста и дифференцировки тканей. [5–7, 14, 15].

Несмотря на успехи, достигнутые в изучении факторов риска развития, патогенеза, методов диагностики и лечения КРР, у значительного числа больных прогрессирование заболевания наблюдается даже при ранних стадиях опухоли. Это послужило основанием для проведения исследования по изучению влияния степени и характера отложения ЖТ, ее метаболической активности на течение КРР после радикального хирургического лечения, результаты которого представляются важными в научном и практическом отношении.
Материал и методы
Материалом для работы послужили данные обследования и лечения 291 больного КРР (основная группа) с I, II, III стадиями заболевания, получивших лечение в ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России за период с 1996 по 2014 г. Протокол научной работы, отбор пациентов, сбор анамнеза, физикальных данных, забор биологического материала и проведение этапа лабораторных анализов, а также результаты проведенного лечения и дальнейшего наблюдения были согласованы и одобрены этическим комитетом ФГБУ РНЦРР МЗ РФ.
У всех пациентов измерялись антропометрические данные (рост, вес), производился расчет ИМТ, изучались результаты проведенного обследования и лечения КРР, послеоперационного морфологического исследования опухоли, отдаленные результаты лечения. У 75 больных основной группы, получивших лечение в РНЦРР с 2011 по 2014 г., определялся характер распределения ЖТ. Для расчета данного параметра у пациентов измерялись показатели окружности талии (ОТ) и бедер (ОБ). На основании этих показателей вычислялся тип отложения жировой клетчатки. Мужчин с соотношением ОТ/ОБ больше 1 и женщин с результатом больше 0,85 относили к группе с центральным вариантом распределения ЖТ. Результаты меньше 1 и 0,85 соответственно определяли периферический вариант распределения ЖТ. С учетом проспективного характера исследования эти больные были выделены в отдельную подгруппу – № 1.
Из подгруппы № 1 были выделены в отдельную подгруппу № 2 47 больных КРР, у которых помимо расчета вышеуказанных параметров проводилось определение гормонов, заявленных в исследовании (инсулина, адипонектина, резистина и лептина).
Все больные групп и подгрупп, участвовавшие в исследовании, были статистически сопоставимыми по основным параметрам (полу, возрасту, стадиям заболевания, локализации и морфологии опухоли, ИМТ и характеру распределения ЖТ).
Обработку полученных данных проводили в программном пакете Statistica 10. (StatSoft, USA). Статистическая обработка результатов осуществлялась с использованием методов непараметрического анализа. Различия между группами считались статистически значимыми при p<0,05.
Результаты собственных исследований и их обсуждение
При изучении связи ИМТ с прогнозом КРР была обнаружена тенденция увеличения частоты прогрессирования заболевания с увеличением ИМТ.
В группе с нормальным ИМТ прогрессирование наступило у 17,85%, при избыточной массе тела – у 24,0%, а при ожирении – у 27,85% пациентов (p>0,05; рис. 1).
При анализе по Каплан–Майеру (рис. 2) основные различия в частоте прогрессирования наблюдались в сроки после 20 месяцев. После этого срока частота прогрессирования у пациентов с нормальным ИМТ была меньше, чем у пациентов с избыточной массой тела и ожирением.
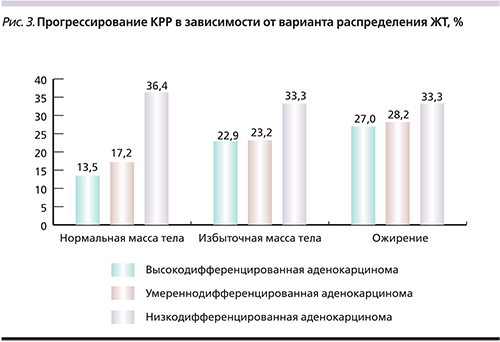
Важным факторов, влияющим на прогноз КРР, является степень дифференцировки опухоли. В исследовании был проведен анализ связи данного фактора с наличием или отсутствием избыточной массы тела. Было выявлено, что у больных с нормальной массой тела худший прогноз отмечался при низкодифференцированном варианте опухоли. С увеличением ИМТ это различие нивелировалось и наблюдалось общее увеличение частоты прогрессирования опухоли при всех формах дифференцировки. В группе с нормальным ИМТ частота прогрессирования среди пациентов с высокодифференцированной аденокарциномой составила 13,51%, умеренно дифференцированной аденокарциномой – 17,19% и низкодифференцированной аденокрациномой – 36,36%. В группе с избыточной массой тела частота прогрессирования у пациентов с высокодифференцированной аденокарциномой составила 22,86%, умеренно дифференцированной аденокарциномой – 23,21% и низкодифференцированной аденокрациномой – 33,33%. В группе пациентов с ожирением частота прогрессирования при указанных вариантах аденокарциномы составила 27,03, 28,21 и 33,33% соответственно (рис. 3). Различия были статистически недостоверными (p>0,05), однако эти результаты можно охарактеризовать как увеличение общего негативного влияния ожирения на прогноз заболевания.

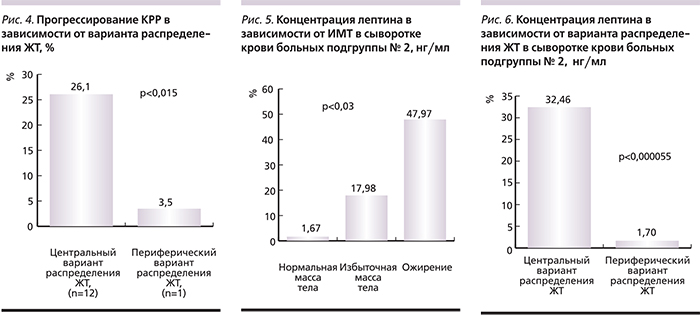
Как указывалось выше, помимо количества накопленной жировой клетчатки значение имеет ее локализация в организме. На основании проведенных исследований было установлено, что характер отложения ЖТ статистически значимо связан с прогнозом КРР. В подгруппе пациентов с центральным вариантом распределения ЖТ (n=46, средний ИМТ – 27,62) прогрессирование заболевания наступило в 26,09% наблюдений, тогда как в подгруппе с периферическим вариантом распределения ЖТ (n=29, средний ИМТ – 26,39) – в 3,45% (рис. 4). Различия статистически достоверны (p<0,015).
На лабораторном этапе исследования определялись уровни гормонов ЖТ и инсулина в сыворотке крови больных КРР. Показатели адипонектина, резистина, инсулина находились в различной зависимости от ИМТ и варианта распределения ЖТ, однако их изменения не коррелировали с частотой прогрессирования КРР (табл. 1, 2).
В то же время результаты исследования позволили установить, что уровень лептина в сыворотке крови увеличивался с ростом ИМТ, связан с центральным типом распределения ЖТ и ухудшением прогноза. Так, у больных с нормальным ИМТ средний уровень лептина составил 1,67 нг/мл. В подгруппе с избыточной массой тела он был равен 17,98 нг/мл, а при ожирении – 47,97 нг/мл (p<0,003; рис. 5).
Уровень лептина при центральном варианте распределения ЖТ был 32,46 нг/мл, тогда как при периферическом варианте – 1,7 нг/мл (p<0,000055; рис. 6).
При прогрессировании КРР уровень лептина был значительно выше – 47,97 нг/мл, чем у больных без прогрессирования – 8,52 нг/мл (p<0,0015; рис. 7).
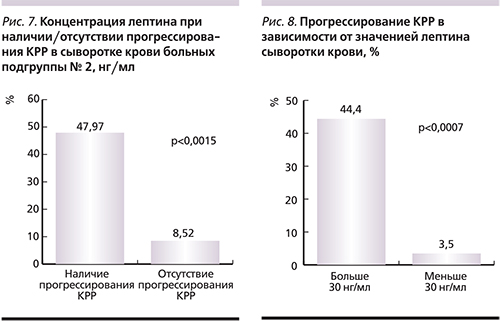
Дальнейший анализ результатов исследования позволил установить границу концентрации лептина, когда частота прогрессирования КРР значительно возрастала – 30 нг/мл. Так, прогрессирование заболевания наступило почти у половины пациентов (44,44%) с уровнем лептина выше определенной нами границы (30 нг/мл), тогда как при концентрации лептина ниже нее прогрессирование отмечалось лишь у 3,5% больных (рис. 8). У более чем половины пациентов с высоким уровнем лептина прогрессирование КРР развилось при ранних (I, II) стадиях заболевания даже при нормальном ИМТ. Таким образом, определение уровня лептина сыворотки крови может рассматриваться в качестве дополнительного фактора неблагоприятного прогноза КРР.
Заключение
Таким образом, на основании проведенного исследования выявлено негативное влияние увеличения ИМТ на прогноз КРР. Характер распределения ЖТ достоверно влияет на течение КРР: при центральном варианте распределения ухудшается прогноз течения заболевания. Наибольшее прогностическое значение для больных КРР имеет повышение уровня гормона жировой ткани – лептина, который связан с повышением ИМТ и центральным вариантом распределения ЖТ. Увеличение уровня лептина у больных КРР выше 30 нг/мл резко ухудшает результаты лечения и может быть использован в качестве дополнительного фактора при определении показаний к адъювантной терапии после радикальных хирургических операций независимо от стадии заболевания, а также для изменения частоты и полноты проведения контрольных обследований.



