Введение
Обструктивное апноэ сна (ОАС) является заболеванием, характеризующимся остановками дыхания (апноэ) и эпизодами гиповентиляции (гипопноэ) во время сна, что приводит к интермиттирующей гипоксии [1].
Терапия постоянным положительным воздухоносным давлением (от анг. Continuous Positive Airway Pressure, или СРАР-терапии) в настоящее время является патогенетическим методом терапии пациентов ОАС. Несмотря на ее высокую клиническую эффективность, соблюдение пациентами постоянства лечения (приверженность терапии) остается важной и сложной клинической проблемой. В ряде предыдущих исследований, посвященных изучению данной проблемы, приверженность СРАР-терапии оценивалась за достаточно короткие периоды терапии, а данные оказались противоречивыми [2, 3]. Более того, в случаях длительного выполнения СРАР-терапии приверженность оценивали только в начале лечения и только у пациентов, которые не выбывали из исследований [4, 5].
В настоящей работе мы постарались изучить предикторы и показатели приверженности пациентов ОАС длительно проводимой СРАР-терапии (в течение года) при наличии у них коморбидной патологии, изменяющей ответ на проводимую терапию.
Методы
В проспективное годичное исследование были включены 310 (273/88% мужчин и 37/11,9% женщин) пациентов в среднем возрасте 45 лет (45,3±10,4) с храпом, метаболическими нарушениями, ОАС, артериальной гипертензией (АГ), подписавших информированное согласие, имевших индекс апноэ-гипопноэ (AHI – Apnea-Hypopnea index)>5 соб./ч. Все пациенты находились на подобранной антигипертензивной и гиполипидемической терапии. В зависимости от тяжести ОАС пациенты были разделены на группу А (n=51, легкое течение ОАС), группу Б (n=91, среднетяжелое течение ОАС), группу В (n=168, тяжелое течение ОАС). Всем пациентам проведена таргетная СРАР-терапия в соответствии с рекомендациями Американской академии медицины сна (AASM) для достижения оптимальной коррекции ОАС уровнем AHI<10 соб./ч [6]. Контрольными точками наблюдения стали 0–3–6–12 месяцев наблюдения.
Всем пациентам проведен врачебный осмотр и комплексное медицинское обследование. Их интервьюировали на длительность и начало набора массы тела, число предшествовавших попыток ее снижения, прием лекарственных препаратов и/или биологически активных добавок для коррекции массы тела, особенности режима питания и калорийности суточного рациона, физической активности. Критерии исключения: беременность, лактация; сахарный диабет 1 и 2 типов; синдромальные формы ожирения; тяжелое сопутствующее соматическое заболевание (нарушение функции щитовидной железы, почечная и печеночная недостаточность, декомпенсированная сердечная недостаточность, тяжелые гемодинамические нарушения ритма сердца, перенесенный инфаркт миокарда и инсульт в течение последних трех месяцев до скрининга, системное воспалительное заболевание, онкологическое заболевание); прием системных глюкокортикостероидов в течение трех месяцев, предшествовавших скринингу; психическое заболевание в анамнезе и/или при клиническом обследовании; наркотическая и алкогольная зависимость; пациенты с выраженной обструкцией дыхательных путей (форсированный выдох за 1-ю секунду – ОФВ1<50%), рестриктивными нарушениями (жизненная емкость легких – ЖЕЛ<80%), с дневной сатурацией артериальной крови SpO2<90% (FiO2=21%).
Исследование проведено на кафедре фтизиатрии и пульмонологии лечебного факультета ФГБОУ ВО МГМСУ им. А.И. Евдокимова на базе Центра респираторной иедицины (ЦРМ) и Больницы Центросоюза РФ (Москва). Исследование было одобрено межвузовским этическим комитетом ФГБОУ ВО МГМСУ им. А.И. Евдокимова.
Всем пациентам проведено ночное полиграфическое исследование по стандартизированному протоколу сердечно-сосудистого мониторирования ОАС в соответствии с правилами и рекомендациями Американской академии медицины сна (AASM) [7]. Использован полиграфический комплекс «SOMNOcheck micro CARDIO» (Lowenstein Medical Ltd., Германия) с программным обеспечением «SOMNOlab 2.19» (Lowenstein Medical Ltd., Германия) и регистрацией: 1) ротоносового воздушного потока и храпа; 2) дыхательных усилий; 3) пульсоксиметрической регистрацией SpO2 и частоты сердечных сокращений (ЧСС). Апноэ идентифицировалось как снижение сигнала воздушного потока на величину >80% при сохранении дыхательного усилия продолжительностью более 10 секунд. Гипопноэ идентифицировалось как снижение сигнала воздушного потока на величину более 30% при сохранении дыхательного усилия продолжительностью более 10 секунд и последующей десатурацией на величину >4%. Тяжесть ОАС определена по индексу апноэ/гипопноэ (AHI), определяемому как общее число ОАС и гипопноэ за 1 час регистрации. Частота 5
Оценка приверженности СРАР-терапии. Оптимальный лечебный уровень A-Flex-терапии титровался в домашних условиях с использованием аппаратов для автоматического выбора СРАР (PR System One REMstar Auto CPAP Machine with A-Flex, Philips Respironics, США) в течение 7 дней после диагностического исследования. Для оценки показателей приверженности пациентов ОАС на 3–6–9–12-м месяцах СРАР-терапии нами использовалась оригинальная программа анализа приверженности Encore Pro v.2.14 (Philips Respironics, США). К основным анализируемым параметрам отнесены: 1) процент дней использования СРАР-терапии (PDU, %) – индекс, отражающий постоянство применения СРАР-терапии за все время наблюдения; 2) среднее время СРАР-терапии за все дни использования (AU, ч/ночь) – индекс, отражающий воспроизводимость СРАР-терапии при домашнем использовании; 3) процент дней использования СРАР>=4 ч/ночь (PDU>=4%) – индекс, отражающий высокую эффективность СРАР-терапии; 4) процент дней использования СРАР <4 ч/ночь (PDU<4%) – индекс, отражающий низкую эффективность СРАР-терапии; 5) среднее значение лечебного давления СРАР-терапии (CMP) (мбар) – индекс, отражающий уровень лечебного давления СРАР-терапии; 6) среднее значение пикового давления СРАР-терапии (CPP, мбар) – индекс, отражающий максимальный уровень лечебного давления СРАР-терапии; 7) процент неконтролируемой воздушной утечки за 1 день использования СРАР-терапии (LDU, %) – индекс, отражающий плохую переносимость СРАР-терапии; 8) среднее значение коррекционного индекса апноэ-гипопноэ при проведении СРАР-терапии (AHIсрар, соб./ч) – индекс, отражающий эффективность СРАР-терапии.
Данные анализировались с использованием статистического программного обеспечения версии 6.0 (AnalystSoft Inc., StatPlus). Количественные данные были выражены как среднее значение (M) и стандартное отклонение (SD) (M±SD). Различия между группами анализировались с помощью ANOVA для непрерывных переменных. Для измерения линейной связи между переменными использовался корреляционный «тест Пирсона». Проводился анализ по назначенному лечению – IТТ-анализ («intention-to-treat analysis») при финальной оценке полученных показателей. Роль пола, возраста, индекса массы тела (ИМТ), распределения жировых отложений, уровней глюкозы и липидов сыворотки крови в качестве ассоциированных переменных с AHI были протестированы методом линейной регрессии с использованием многомерных моделей. Для сравнения частот в независимых выборках использован χ2-критерий. Различия исследуемых параметров считались статистически значимыми при р<0,05. При 0,05<p<0,1 выносилось суждение о наличии статистической тенденции.
Результаты
Из 310 включенных в исследование пациентов в общей сложности 294 (94,8%) выполнили каждый визит и были включены в стандартизованный анализ, 16 (5,16%) пациентов выполнили только одно последующее посещение и были суммарно оценены лишь в IТТ-анализе. Разделение пациентов на группы выполнено на основании тяжести апноэ сна. Пациенты легкого течения выделены в группу А (5<AHI<15 соб./ч), среднетяжелого течения – в группу Б (15

При выполнении группового анализа нами установлены корреляционные связи между восьмью основными показателями (ИМТ, AHI, ODI, TSat<90, AU, CMP, PDU>=4, PDU<4) для пациентов каждой группы (рис. 1).
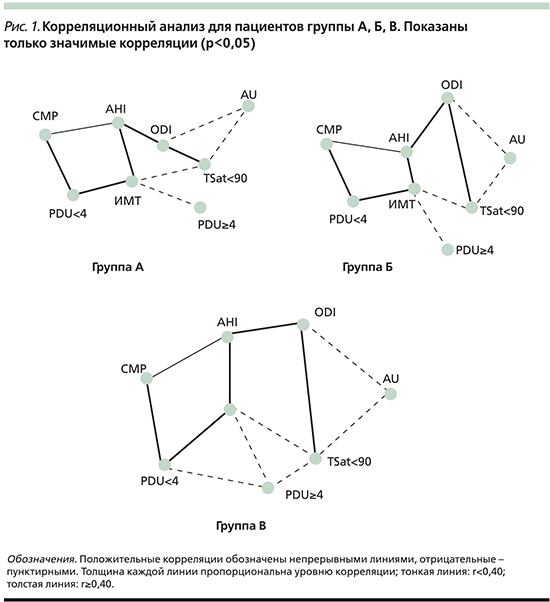
Было установлено существование сильного взаимодействия между средним значением лечебного давления СРАР-терапии (CMP) – процентом дней использования СРАР <4 ч/ночь (PDU<4), индексом массы тела (ИМТ), частотой событий апноэ сна (AHI), десатурациями (ODI), временем на сатурации менее 90% (TSat<90) в каждой исследуемой группе. Существование прямой корреляции CMP–PDU<4–ИМТ–AHI–ODI–Tsat<90, усиливающейся от легкого к тяжелому течению заболевания, подтверждает влияние гипоксических стимулов и тяжести ОАС на величину лечебного давления и длительность проведения СРАР-терапии.
Оценка показателей приверженности СРАР-терапии в «intention-to-treat analyses» (ITT). Проводился анализ по назначенному лечению (IТТ-анализ) показателей приверженности СРАР-терапии (PDU, AU, PDU≥4, PDU<4, CMP, CPP, LDU, AHIcpap) среди пациентов, успешно окончивших исследование и досрочно выбывших к 12-му месяцу терапии с поправкой на возраст, пол, ИМТ, наличие кардиоваскулярных заболеваний и проводимой антигипертензивной терапии в группе легкого, среднетяжелого и тяжелого течения ОАС. (табл. 2–4).

В группе пациентов легкого течения ОАС (группа А) изменения приверженности по трем основным параметрам, отражающим воспроизводимость терапии (PDU≥4), таргетное давление (CMP), неконтролируемую воздушную утечку (LDU), наступают на 6-й месяц СРАР-терапии: повышение PDU≥4 на +5,21% (95% доверительный интервал [ДИ] – 3,70–6,23; р=0,061), уменьшение CMP на -1,32 мбар (95% ДИ – -2,1–-0,86; р=0,082), уменьшение LDU на -4,30% (95% ДИ -6,71–-2,91; р=0,031), достинув максимальных значений к 12-му месяцу: повышение PDU≥4 на +6,23% (95% ДИ – 4,80–7,93; р=0,021), уменьшение CMP на -1,51 мбар (95% ДИ – -2,7–-0,91; р=0,032), уменьшение LDU на -5,95% (95% ДИ – -8,21–-3,98; р=0,031).
В группе пациентов среднетяжелого течения ОАС (группа Б) достоверные изменения приверженности по трем основным параметрам, отражающим воспроизводимость терапии (PDU≥4), таргетное давление (CMP), неконтролируемую воздушную утечку (LDU), наступают на 3-й месяц СРАР-терапии: повышение PDU≥4 на +16,20% (95% ДИ – 13,20–18,61; р=0,001), уменьшение CMP на -2,31 мбар (95% ДИ – -3,6–-1,91; р=0,001), уменьшение LDU на -4,41% (95% ДИ – -7,21–-3,75; р=0,01), достигая максимальных значений к 12-му месяцу: повышение PDU≥4 на +23,61% (95% ДИ – 19,30–26,13; р=0,001), уменьшение CMP на -3,51 мбар (95% ДИ – -4,12–-2,51; р=0,001), уменьшение LDU на -7,45% (95% ДИ – -9,71–-6,21; р=0,001).
В группе пациентов тяжелого течения ОАС (группа В) достоверные изменения приверженности по трем основным параметрам, отражающим воспроизводимость терапии (PDU≥4), таргетное давление (CMP), неконтролируемую воздушную утечку (LDU), наступают на 6-м месяце СРАР-терапии: повышение PDU≥4 на +17,91% (95% ДИ – 15,80–21,11; р=0,001), уменьшение CMP на -3,31 мбар (95% ДИ – -4,1–-2,91; р=0,001), уменьшение LDU на -10,69% (95% ДИ – -13,25–-8,41; р=0,001), достигнув максимальных значений к 12-му месяцу: повышение PDU≥4 на +25,91% (95% ДИ – 22,80–29,23; р=0,001), уменьшение CMP на -3,50 мбар (95% ДИ – -4,32–-2,63; р=0,001), уменьшение LDU на -15,15% (95% ДИ – -17,61–-12,41; р=0,001).
Обсуждение
Пациенты с ОАС, имеющие АГ, являются коморбидными больными с многократно увеличенными рисками фатальных и нефатальных сердечно-сосудистых событий. СРАР-терапия является единственно обоснованной «первой линии», особенно в случаях пациентов ОАС среднетяжелого и тяжелого течения. Мы обратили на них особое внимание, поскольку такие пациенты имеют максимальные риски смертельного исхода или кардиоваскулярных осложнений. Для устранения возможных искажений в интерпретации результатов изучались пациенты с ОАС, ранее получавшие подобранную антигипертензивную и гиполипидемическую терапию. Несмотря на простой дизайн, отсутствие «ослепления», плацебо контроля и рандомизации пациентов, нам удалось достичь минимального воздействия на конечный результат путем правильного формирования исследуемой и контрольной групп и применения анализа по назначенному лечению (IТТ-анализ).
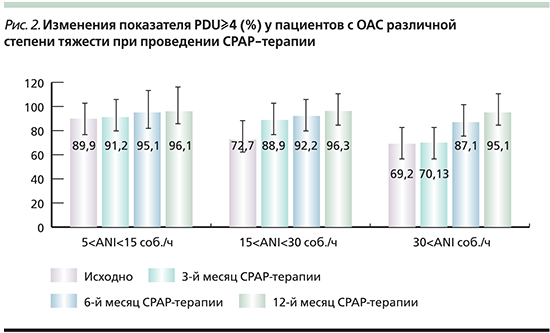
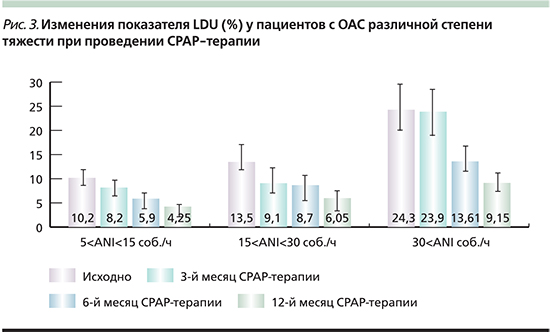
Наши данные полностью согласуются с рядом исследований переносимости СРАР-терапии пациентами различных групп [9–11]. Повышение приверженности и податливости пациентов проводимой терапии пациентов ОАС+АГ, вероятнее всего, связано с устранением фрагментации сна и ночной гипоксемии, а также правильным выбором гарнитуры и оптимизацией лечебного давления при автоматическом выборе СРАР-терапии [12]. Эта гипотеза подтверждается и в нашем исследовании, когда приверженность СРАР-терапии в течение года достоверно увеличивается с улучшением повторяемости и длительности проведения самой терапии (PDU≥4), устранением неконтролируемой воздушной утечки (LDU) до целевых значений даже у пациентов тяжелого течения ОАС (рис. 2, рис. 3).
Заключение
В заключение следует отметить, что приверженность и податливость пациентов длительно проводимой таргетной СРАР-терапии, особенно в группе среднетяжелого и тяжелого течения ОАС, достоверно зависят от ее эффективности и выбора интерфейса, позволяющего выполнить регулярную повторяемость процедуры в каждую терапевтическую ночь.



