Введение
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - самое частое заболевание желудочно-кишечного тракта (ЖКТ) [1,2]. В западных странах распространенность ГЭРБ находится на уровне 8,8-33,1%, в Российской Федерации - 11,3-23,6% населения [3, 4]. Основные нозологические формы ГЭРБ - это неэрозивная рефлюксная болезнь (НЭРБ) и эрозивный эзофагит (ЭЭ). Последний составляет примерно 30% случаев, тогда как большинство больных (около 70%) страдают НЭРБ, т.е. имеют беспокоящие симптомы в отсутствие повреждения дистального отдела пищевода [5, 6]. В эпидемиологических исследованиях продемонстрировано, что две основные формы ГЭРБ существуют независимо друг от друга, однако при длительном наблюдении трансформация НЭРБ в ЭЭ возможна в 25% случаев [7-9].
НЭРБ не оказывает негативного влияния на продолжительность жизни пациента, однако остается значимой проблемой для современной медицины с учетом высокой распространенности, трудности диагностики (необходимость проведения в ряде случаев дополнительных исследований - манометрии, суточной рН-импедансометрии пищевода), значимого ухудшения качества жизни, неудовлетворительной эффективности кислотосупрессивной терапии и высокой частоты рецидивов [10-13].
К основным факторам риска, способствующим развитию патологического гастроэзофагеального рефлюкса (ГЭР), относят возраст >50 лет, индекс массы тела (ИМТ) >30 кг/м2, курение, недостаточную физическую активность, прием некоторых лекарственных препаратов, оказывающих ингибирующее влияние на тонус нижнего пищеводного сфинктера (блокаторы кальциевых каналов, в—адреномиметики, метилксантины) [14]. В многочисленных исследованиях продемонстрирован рост распространенности ГЭРБ на фоне пандемии ожирения. Риск развития НЭРБ, ЭЭ, пищевода Барретта и аденокарциномы пищевода прямо пропорционален ИМТ и окружности талии (ОТ) [15-23].
По данным ВОЗ, в мире в 2020 г. более 1,9 млрд взрослого населения имели избыточный вес, более 650 млн страдали ожирением [24]. В РФ ожирение встречается у 29,7% россиян [25]. В работе K.J. Kim et al. продемонстрировано, что пациенты с НЭРБ абдоминальное ожирение имеют чаще, чем здоровые индивидуумы, - 28,1 против 7,9% соответственно [26]. В международных и отечественных клинических рекомендациях по диагностике и лечению ожирения указывается, что снижение веса на 5% способствует уменьшению симптоматики ассоциированных с ожирением заболеваний, в частности ГЭРБ [27]. В исследовании HUNT-3 с участием 44 997 пациентов продемонстрировано, что снижение веса сопровождается редукцией симптоматики у пациентов с ГЭРБ, уменьшением времени экспозиции кислого болюса в пищеводе с 5,6-8,0 до 3,7-5,5% времени в течение суток [28]. В проспективном когортном исследовании с участием 332 пациентов с ожирением и ГЭРБ M. Singh et al. продемонстрировали, что редукция веса на 13 кг способствовала достоверному снижению интенсивности симптомов рефлюксной болезни у 81% больных [29].
Цель исследования: сравнить эффективность изменения образа жизни (диетотерапия, интенсификация физической активности) и классической терапии ИПП для пациентов с НЭРБ, имеющих избыточный вес или ожирение.
Методы
В рандомизированном клиническом исследовании приняли участие 30 пациентов, 12 (40%) мужчин и 18 (60%) женщин среднего возраста (51,5 [45; 62] год) с НЭРБ и избыточным весом (ИМТ >25 кг/м2) или ожирением (ИМТ >30 кг/м2). В исследование не включались пациенты с заболеваниями, способными оказывать значимое влияние на течение ГЭРБ (желчнокаменная болезнь, язвенная болезнь желудка и 12-перстной кишки, сахарный диабет, ишемическая болезнь сердца и другие нозологии).
Участники исследования методом таблиц случайных чисел были рандомизированы в 2 группы: группа контроля - 15 пациентов, группа вмешательства - 15. Продолжительность исследования составила 6 месяцев. Дизайн исследования представлен в табл. 1.
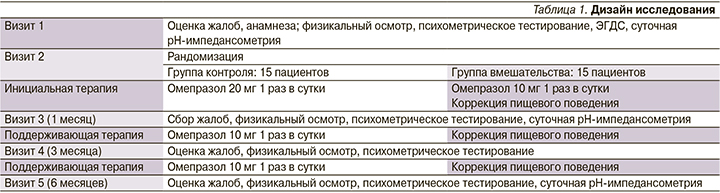
В рамках первого визита всем пациентам проведена эзофагогастродуоденоскопия (ЭГДС), при наличии ЭЭ пациенты в исследование не включались.
Выраженность и частота изжоги и регургитации оценивались в баллах:
- частота изжоги, регургитации: 0 баллов - отсутствие жалобы; 1 - менее 1 раза в неделю; 2 - 1 раз в неделю; 3 - 2 раза в неделю и более; 4 - ежедневно; 5 баллов - несколько раз в день;
- интенсивность изжоги, регургитации: 0 баллов - отсутствие жалобы; 1 - слабая; 2 - средней интенсивности; 3 - интенсивная; 4 балла - крайне интенсивная жалоба.
Функциональная активность пищевода, желудка и 12-перстной кишки оценивалась в процессе проведения суточной рН-импедансометрии аппаратом импедансоацидомонитором ИАМ-01 «Гастроскан-ИАМ». Правильность постановки рН-импедансометрического зонда (дистальный пищеводного датчика на 5 см выше уровня диафрагмы) определялась при проведении рентгенологического исследования.
Всем пациентам в динамике осуществлялось экспериментально-психологическое обследование с помощью опросников Бека (уровень депрессии), Спилбергера-Ханина (уровень реактивной и личностной тревожности) и SF-36 (качество жизни).
Опросник Бека содержит 21 вопрос: утверждение о проявлениях депрессии, для которых имеется 4 варианта ответа [30]. При заполнении опросника Бека пациенты набрали в среднем 11 (10; 14) баллов. Депрессия определялась у 8 (26,66%) пациентов: легкая депрессия - у 2 (6,66%), умеренная у 6 (20%).
Опросник Спилбергера-Ханина оценивает реактивную тревожность (состояние в данный момент) и личностную тревожность (тревожность, как устойчивая характеристика личности) [31]. По результатам тестирования опросником Спилбергера-Ханина реактивная тревожность у участников исследования составила в среднем 35 (22; 46) баллов (умеренная тревожность), личностная тревожность - 44 (35; 48) баллов (умеренная тревожность). Низкая реактивная тревожность (<30 баллов) определялась у 14 (46,66%), умеренная реактивная тревожность (31-44 баллов) у 7 (23,33%), выраженная реактивная тревожность (>45 баллов) у 9 (30%) пациентов. Низкая личностная тревожность (<30 баллов) определялась у 3 (10%), умеренная личностная тревожность (31-44 балла) у 13 (43,33%) пациентов, выраженная личностная тревожность (>45 баллов) выявлялась у 14 (46,66%) пациентов.
Опросник SF-36 состоит из 36 вопросов, оценивающих физический (4 шкалы) и психический (4 шкалы) компоненты здоровья [32]. При заполнении опросника SF-36 пациенты в среднем набрали следующее количество баллов: шкала физического функционирования (PF) - 90 (80; 100); шкала ролевого функционирования, обусловленного физическим состоянием (RP), - 75 (75; 75); шкала интенсивности боли (BP) - 84 (64; 90); шкала общего состояния здоровья (GH) - 57 (45; 72); шкала жизненной активности (VT) - 65 (50; 80); шкала социального функционирования (SF) - 75 (63; 100); шкала ролевого функционирования, обусловленного эмоциональным состоянием (RE), - 66,6 (33,3; 100); шкала психического здоровья (MH) - 72 (60; 80) балла.
Пациенты группы вмешательства участвовали в программе по снижению веса, включившую интенсификацию физической активности и диетотерапию. Программа по снижению веса базировалась на Российских национальных рекомендациях по диагностике, лечению и профилактике ожирения [33]. Привычная для пациента калорийность суточного рациона ограничивалась на 30% и составила в среднем 1500 ккал в сутки. Пища принималась пациентами 3-4 раза в день, рацион был сбалансирован по макронутриентам (жиры - 20-40%, белки - 15-25%, углеводы - 35-65%). У участников исследования интенсифицировалась физическая активность (не менее 150 минут интенсивной физической нагрузки или не менее 300 минут аэробной физической нагрузки средней интенсивности, равномерно распределенной в течение недели). Пациенты группы контроля в соответствии с графиком визитов посещали исследовательский центр. Пациенты группы вмешательства посещали исследовательский центр каждые 2 недели в течение первых 3 месяцев, каждые 4 недели с четвертого по шестой месяц исследования (оценка приверженности диетотерапии и изменению физической активности).
Полученные данные обрабатывались с использованием стандартного пакета программы Statistica 10.0. С учетом особенностей распределения большинства изучаемых признаков в процессе их статистической обработки применялись методы непараметрической статистики. Данные представлены в виде Me (LQ; HQ), где Me - медиана, LQ - нижний квартиль (отсекает от совокупности И часть показателей с минимальными значениями), HQ - верхний квартиль (отсекает от совокупности И часть показателей с максимальными значениями). Критический уровень значимости (р) нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05.
Результаты исследования
В исследовании приняли участие 30 пациентов, 12 (40%) мужчин и 18 (60%) женщин) среднего возраста (51,5 [45; 62) год] с НЭРБ. 19 (63,33%) пациентов было моложе 60 лет, 11 (36,66%) старше 60 лет; 21 (70%) пациент не курил, 9 (30%) курили на постоянной основе.
Средний ИМТ участников исследования равнялся 28,77 (27,55; 32,24) кг/м2; ОТ - 96,5 (85; 104) см; процент жировой массы, определяемый при проведении импедансометрии организма, составил 29,0 (25; 34)%. Избыточный вес (ИМТ - 25-29,9 кг/м2) имели 17 (56,66%) пациентов, 13 (43,44%) страдали ожирением (ИМТ >30 кг/м2).
Абдоминальное ожирение (ОТ >80 см у женщин, >94 см у мужчин) выявлено у 27 (90%) участников исследования - 10 (33,3%) мужчин и 17 (56,6%) женщин.
Эндоскопические признаки грыжи пищеводного отверстия диафрагмы выявлены у 8 (26,66%) пациентов.
Длительность существования ГЭРБ у пациентов в среднем составила 3 (2; 4) года. Выраженность и частота основных жалоб на момент включения пациентов в исследования: частота изжоги - 2,0 (1; 3); интенсивность - 4,0 (3; 4); частота регургитации - 3,0 (3; 4); интенсивность - 1,0 (1; 2) баллов. Внепищеводные проявления ГЭРБ (рефлюкс-ассоциированный кашель, фарингит, ларингит) имелись у 10 (33,3%) пациентов.
Всем 30 участникам исследования проведена суточная рН-импедансометрия верхних отделов ЖКТ. Результаты суточного рН-импедансометрического исследования представлены в табл. 2.
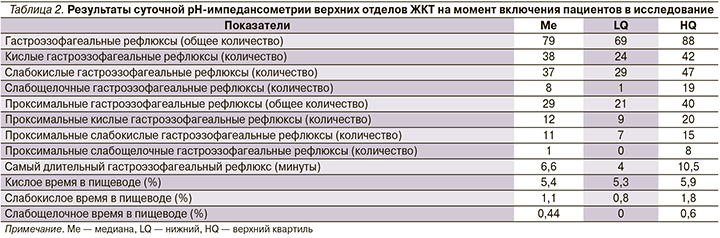
Сравнение групп контроля и вмешательства после месячной терапии
На момент начала исследования группы между собой не различались. После 4-недельной терапии между группами появились достоверные статистические различия по количеству слабощелочных ГЭР, качеству жизни по шкалам SF и RE опросника SF-36. Отличия представлены в табл. 3.
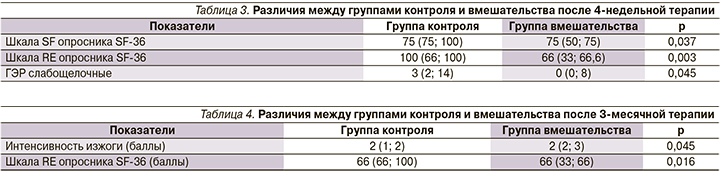
Сравнение групп контроля и вмешательства после 3-месячной терапии
Через 3 месяца терапии группы контроля и вмешательства достоверно различались только по интенсивности изжоги и количеству баллов по шкале RE опросника SF-36. Показатели были лучше в группе контроля (табл. 4).
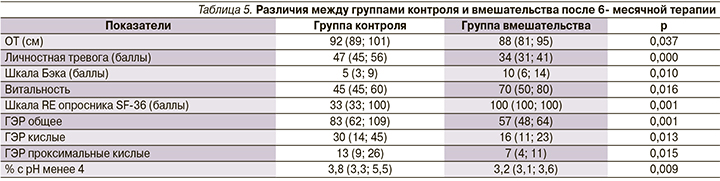
Сравнение групп контроля и вмешательства после 6-месячной терапии
К 5-му визиту группы контроля и вмешательства достоверно разтличались по ОТ, частоте регургитации, уровню личностной тревожности и депрессии, количеству баллов по шкалам VT и RE опросника SF-36, а также по общему количеству ГЭР, количеству кислых ГЭР, проксимальных кислых ГЭР, % с рН <4 в дистальном отделе пищевода (табл. 5).
Достоверность изменения показателей на протяжении 6 месяцев в группах стандартной и экспериментальной терапии сравнивалась при помощи непараметрического статистического теста ANOVA Фридмана. У пациентов группы вмешательства отмечено достоверное уменьшение ОТ и ИМТ за время участия в исследовании; при этом у пациентов группы контроля за 6 месяцев имело место достоверное увеличение ИМТ. Динамика частоты регургитации в группах вмешательства и контроля на протяжении 6 месяцев представлена на рис. 1; динамика общего количества ГЭР - на рис. 2; динамика кислых ГЭР — на рис. 3; динамика % времени в пищеводе с рН <4 в течение суток — на рис. 4.
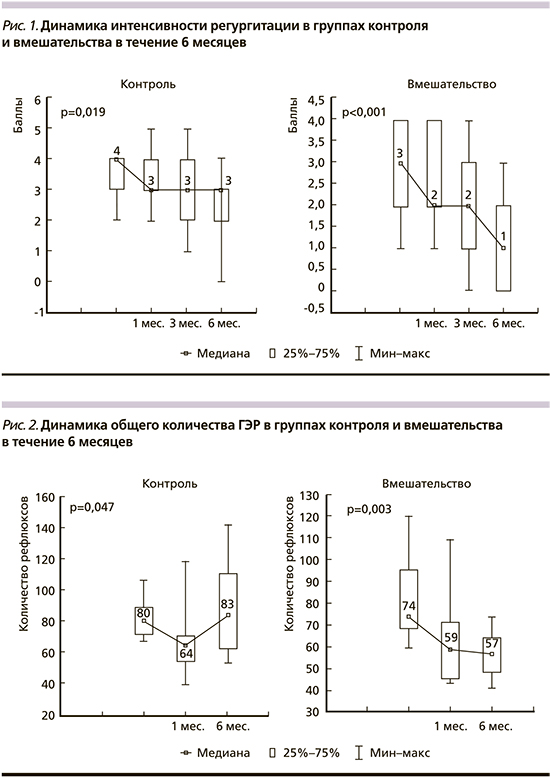
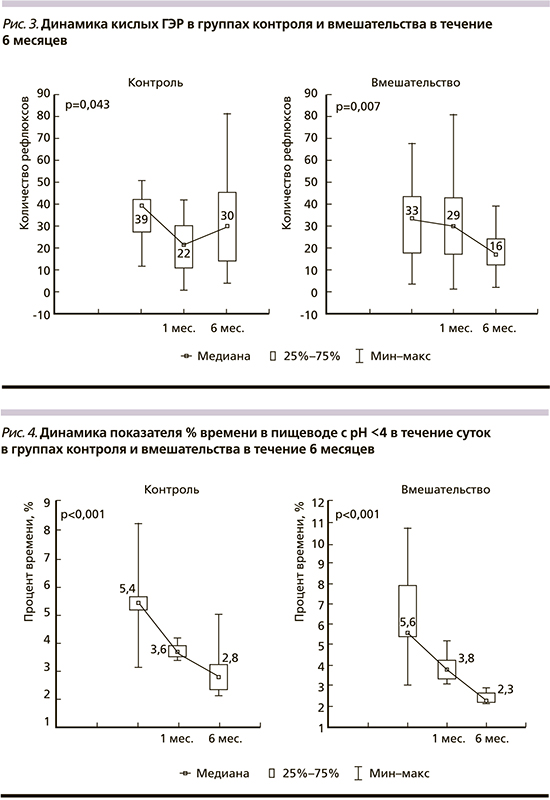
Обсуждение результатов
Проведенное исследование свидетельствует: изменение образа жизни имеет определенные преимущества перед стандартной кислотосупрессивной терапией пациентов с НЭРБ.
Четырехнедельная терапия оказывала достоверное позитивное влияние на симптомы изжоги и регургитации в группах вмешательства и контроля, однако качество жизни по шкалам социального и ролевого функционирования, обусловленного эмоциональным состоянием, у пациентов группы контроля через месяц лечения было выше.
Данный факт может объясняться тем, что мероприятия по изменению образа жизни служат стрессовым фактором, требуют определенных эмоциональных и физических затрат со стороны пациента, что может оказывать негативное влияние на качество жизни. При этом через месяц терапии в группе вмешательства выявлялены позитивные изменения моторики верхних отделов ЖКТ — количество щелочных рефлюксов в группе вмешательства было достоверно ниже, чем в группе контроля. Данный факт можно объяснить тем, что на фоне нормализации пищевого рациона и снижения веса у пациентов отмечается улучшение кинетики желчи, снижение количества дуоденогастральных и слабощелочных гастроэзофагеальных рефлюксов.
Через 3 месяца группа контроля, продолжавшая получать омепразол 10 мг/сут., имела меньшую интенсивность изжоги и лучшее качество жизни по шкале ролевого функционирования, обусловленного эмоциональным состоянием по сравнению с группой изменения образа жизни. Однако через 6 месяцев терапии на фоне достоверного снижения ИМТ и ОТ пациенты группы экспериментального лечения имели ряд преимуществ. В группе экспериментального лечения была достоверно ниже личностная тревожность, выше качество жизни по шкале витальности и шкале ролевого функционирования, обусловленного эмоциональным состоянием. При проведении суточной рН-импедансометрии выявлено меньшее общее количество ГЭР, кислых ГЭР, проксимальных кислых ГЭР, меньший % времени с рН менее 4. По всей видимости, на фоне структурирования питания и снижения веса у пациентов с НЭРБ возникают позитивные изменений моторики верхних отделов ЖКТ, что сопровождается улучшением качества жизни. Большая выраженность депрессии в группе вмешательства по сравнению с группой контроля к 6-му месяцу терапии может указывать на возникновение определенной психологической усталости от длительных диетических ограничений. При этом в соответствии с современными клиническими рекомендациями за периодом 6-месячного снижения веса должен следовать период его стабилизации [33].
Заключение
Проблеме коморбидности ГЭРБ и ожирения в настоящее время уделяется все больше внимания. Ожирение оказывает модифицирующее влияние на количество, продолжительность, компонентный состав ГЭР, обусловливает более тяжелое течение ГЭРБ, появление внепищеводной симптоматики и развития резистентности к классической кислотосупрессивной терапии ИПП.
В проведенном исследовании продемонстрировано, что нормализация структуры питания наряду со снижением массы тела обладает схожим с терапией ИПП влиянием на симптоматику ГЭРБ, при этом способствует более выраженной нормализации моторики верхних отделов ЖКТ: уменьшению количества кислых, проксимальных, слабощелочных ГЭР, % времени с рН <4 в пищеводе. Таким образом, изменение образа жизни пациентов с НЭРБ и избыточным весом имеет стратегическое влияние на течение НЭРБ. В дальнейших исследованиях при рассмотрении экономической целесообразности данного подхода целесообразна дополнительная оценка позитивного влияния снижения веса на течение ассоциированных с ожирением заболеваний - артериальной гипертензии, сахарного диабета, атеросклероза, неалкогольной жировой болезни печени и других нозологий.



