Введение
Рак шейки матки (РШМ) является наиболее часто встречаемой злокачественной опухолью женской половой системы в репродуктивном периоде [1]. В настоящее время отмечается нарастание случаев РШМ в женской популяции моложе 30 лет, нередко имеющих уже «запущенные формы» [1]. По прогнозам GLOBOCAN, к 2050 г. заболевaемость РШМ увеличится на 50%, достигнув более 1 млн новых случаев в год [1].
В настоящее время лучевая терапия (ЛТ) и хирургический метод лечения местнораспространенных форм РШМ наиболее эффективны и считаются стандартными [2]. Несмотря на доказанную эффективность, проведение ЛТ в предоперационном периоде не является оптимальным, особенно при значительных размерах опухоли. Установлено, что по мере увеличения первичного опухолевого очага уменьшается показатель эффективности ЛТ [3]. Использование повышенных доз облучения приводит к уменьшению частоты прогрессирования, но в то же время и к лучевому повреждению тканей малого таза, что обусловливает высокий уровень развития постлучевых изменений и лимитирует дальнейшее продолжение терапии [2, 3].
Вопрос о применении неоадъювантной химиотерапии (НАХТ) в комбинированном или комплексном лечении больных РШМ активно изучается в зарубежных клиниках. Данные последнего Кокрановского мета-анализа, посвященного сравнению индукционной химиотерапии (ХТ) с последующей операцией и хирургическим лечением на первом этапе при местнораспространенных формах РШМ, продемонстрировали увеличение показателей общей выживаемости (ОВ) на 23% (p=0,02), а безрецидивной выживаемости (БРВ) – на 25% (p=0,008) в группе индукционной ХТ. Кроме того, отмечена значимая тенденция к снижению частоты развития рецидивов и метастазирования в исследуемой группе [4].
В России на сегодняшний день опыт применения НАХТ к больным РШМ IВ2–IIВ-стадий FIGO (The International Federation of Gynecology and Obstetrics) невелик. С 2016 г. в НМИЦ онкологии им. Н.Н. Петрова Минздрава России инициировано исследование по изучению эффективности и токсичности НАХТ по схеме АР (цисплатин 75 мг/м2, доксорубицин 35 мг/м2) в дозоинтенсивном режиме с последующим хирургическим вмешательством в отношении больных местнораспространенным РШМ.
Цель исследования: оценить непосредственные результаты применения НАХТ доксорубицином и цисплатином к больных местнораспространенной формой РШМ IВ2–IIВ-стадий FIGO.
Методы
Одноцентровое нерандомизированное контролируемое проспективное исследование начато в апреле 2016 г. в НИИ онкологии им. Н.Н. Петрова Минздрава России. Протокол клинического испытания № 20 от 23.11.2017 одобрен этическим комитетом НМИЦ онкологии им. Н.Н. Петрова Минздрава России.
С июня 2016 г. в исследование были включены 70 первичных пациенток с морфологически подтвержденным диагнозом местнораспространенного РШМ IB2–IIB-стадий (FIGO)/T1b2-2bNх,0M0 (TNM в возрасте от 19 до 70 лет, с функциональным статусом по ECOG (Eastern Cooperative Oncology Group) 0–1; отсутствием выраженных отклонений в гематологических и биохимических показателях, с отсутствием противопоказаний к хирургическому вмешательству (в т.ч. учитывался анестезиологический риск). Общее состояние всех больных до начала терапии было расценено как «0» (ECOG-WHO – Eastern Cooperative Oncology Group/World Health Organisation).
До включения в исследование все пациентки с морфологически подтвержденным диагнозом РШМ IB2–IIB-стадий (FIGO)/T1b2-2bNx,0M0 (TNM) подписали форму информированного согласия на участие в исследовании.
Характеристика пациенток представлена в табл. 1.
Всем больным проведено обследование, включившее стандартные клинико-лабораторные анализы крови, компьютерную томографию (КТ) органов грудной клетки, брюшной полости и забрюшинного пространства, цистоскопию и фиброколоноскопию, электрокардиографию, эхокардиографию.
До начала и по завершении НАХТ проведена видеофиксация состояния опухоли шейки матки с использованием специальной видеосистемы высокого разрешения.
Всем больным было выполнено 3 курса НАХТ цисплатином в дозе 75 мг/м2 и доксорубицином в дозе 35 мг/м2 с интервалом в 10 дней.
С целью оценки эффективности неоадъювантного лечения выполнена магнитнорезонансная томография (МРТ) органов малого таза, специализированная для шейки матки. Исследование проведено дважды: до начала лечения и через 2 недели после окончания курса НАХТ.
Планирование дальнейшего этапа лечения проведено после оценки результатов контрольных исследований. При частичном регрессе опухолевого процесса выполнено хирургическое вмешательство в объеме радикальной экстирпации матки, двусторонней аднексэктомии, тазовой лимфаденэктомии (Piver III) с адъювантным курсом дистанционной ЛТ. При стабилизации и прогрессировании проведен радикальный курс сочетанной химиолучевой терапии: в качестве радиосенсибилизатора использован цисплатин в дозе 40 мг/м2 еженедельно.
Осмотр пролеченных больных проводили через каждые 3 месяца с контролем МРТ малого таза, общеклиническими анализами крови, а также временными рубежами оцениваемого безрецидивного периода (6 – 12 – 18 – 24 месяца).
Статистический анализ полученных данных на данном этапе не проводился.

На этапе скрининга всем больным было проведено детальное обследование, включившее стандартные клинико-лабораторные исследования крови, рентгенологическое исследование органов грудной клетки в двух проекциях, КТ органов брюшной полости и забрюшинного пространства, цисто- и фиброколоноскопию. До начала и в процессе лечения проведена видеофиксация опухоли шейки матки с использованием видеосистемы высокого разрешения VITOM (Karl Storz, Германия).
МРТ органов малого таза проведена на этапе скринингового отбора и через 2 недели после окончания курса НАХТ непосредственно перед хирургическим вмешательством. Исследования выполнены на МР-томографе с индукцией магнитного поля 1,5 Тл (MAGNETOM Aera, SIEMENS, Германия) с использованием поверхностной радиочастотной абдоминальной катушки (Body Coil). В специализированный протокол были включены следующие импульсные последовательности: Т2-взвешенные изображения (Т2-ВИ), полученные с помощью импульсных последовательностей турбоспин эхо (TSE); данная импульсная последовательность позволила дифференцировать опухолевую ткань и строму шейки матки. На сагиттальных (рис. 1а) и аксиальных срезах (рис. 1б) оценивали размеры опухолевого узла, распространение процесса на тело матки, своды и стенки влагалища, а также взаимоотношение опухоли со стенками прямой кишки и мочевого пузыря.
Для более детальной оценки параметральной инвазии выполнены Т2-тонкосрезовые изображения с высоким разрешением (3 мм), ориентированные строго перпендикулярно (рис. 2а) и строго параллельно длинной оси шейки матки (рис. 2б).
Оценку состояния лимфатических узлов в зоне сканирования (от уровня бифуркации аорты до лонного сочленения с захватом паховой области) производили преимущественно на аксиальных Т1-ВИ (рис. 3а) и Т2-ВИ (рис. 3б). Кроме того, для лучшей визуализации лимфатических узлов выполнены обзорные диффузионно-взвешенные изображения (ДВИ) со значением b-факторов 50 и 800, карта ИКД.
Для оценки изменения васкуляризации опухоли на фоне ХТ применяли методику динамического внутривенного контрастирования (дозировка – 0,2 мл/кг массы тела), с интервалом 20–30 секунд (сагиттальные Т1-ВИ с жироподавлением) и отсроченных сканов Т1-взвешенной последовательности.
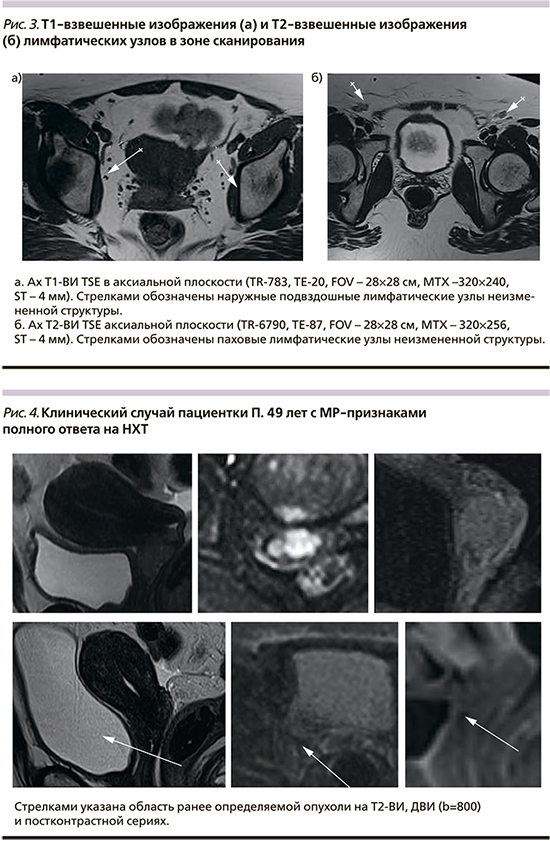
МР-критерии полного регресса опухоли на лечение: отсутствие участков повышенного МР-сигнала на Т2-ВИ, полное исчезновение гиперинтенсивного сигнала на ДВИ (b=800), а также отсутствие участков более раннего накопления парамагнетика при динамическом контрастировании в области ранее выявляемого образования (рис. 4).
Для оценки патоморфологического ответа после НАХТ проведено сравнительное исследование первичного консультативного или биопсийного материала пациентов до лекарственного лечения с операционным материалом, полученным в результате хирургического лечения.
После удаления макропрепарат поступал патологу в абсолютно интактном виде для последующего макроскопического исследования, фиксации и вырезки. С целью адекватного стадирования и полноценной оценки резидуальной опухоли шейки матки определяли размеры, глубину инвазии и степень распространения процесса, состояние параметриев и хирургического края резекции. Перед фиксацией циркулярный край резекции параметриев и влагалища маркировали гистологической краской, после чего препарат вскрывали продольно по передней поверхности. Далее производили макроскопическое описание органа, препарат раскладывали на планшете и заливали забуференным 10%-ным раствором формалина для предварительной фиксации. По истечении суток производили вырезку препарата. Шейку матки, параметрии и манжету влагалища исследовали тотально. Для получения наиболее репрезентативных срезов шейку матки отделяли от тела на уровне нижнего маточного сегмента, затем – со стороны эктоцервикса, отсекали часть стенки влагалища без макроскопических признаков поражения опухолью. Шейку матки вырезали продольно с захватом окрашенного края параметрия и стенки влагалища, с направлением разреза от цервикального канала. Толщина среза не превышала 2 мм. Готовые фрагменты сортировали по кассетам и после фиксации в течение суток отправляли в проводку и окраску по классическому варианту.
При микроскопическом исследовании определяли гистологический тип опухоли, степень ее дифференцировки, оценивали глубину стромальной инвазии и распространение опухоли на параметрий и/или влагалище. Дополнительно рассчитывали процент некротизированных опухолевых клеток, определяли наличие лимфоваскулярной инвазии в сосудах всех исследованных слоев стенки шейки матки и параметриев.
Оценку патоморфологического ответа производили на основании анализа цитологических характеристик: дистрофия, апоптоз, некроз опухолевых клеток. Изменения стромального компонента были представлены фиброзом и склерозом стромы опухоли, сформировавшими «опухолевое ложе», определялось присутствие воспалительной инфильтрации, пенистых макрофагов, кровоизлияний различной степени давности с отложениями гемосидерина, скопления гемосидерофагов.
Для полноценной комплексной оценки патоморфологического ответа опухоли на ХТ использовали данные клинико-инструментальных методов исследования. Результаты исследования оформляли в виде протоколов.

Результаты исследования
Морфологические типы опухоли были представлены в следующем соотношении: плоскоклеточный рак – в 66 (94,3%), аденокарцинома – в 4 (5,71%) наблюдениях. Степень дифференцировки плоскоклеточного рака распределилась следующим образом: высокодифференцированный – 7 (10,6%), умеренно дифференцированный – 44 (60,6%), низкодифференцированный – 19 (28,8%). Аденокарцинома в 4 (5,7%) случаях была умеренной дифференцировки.
При первичном стадировании (FIGO) больные распределились следующим образом: IB2 – 19 (27,1%), IIA – 9 (12,8%), IIB – 42 (60%).
Всем пациенткам было проведено 3 цикла НАХТ по схеме АР в дозоинтенсивном режиме комбинацией препаратов цисплатин в дозе 75 мг/м2 и доксорубцин в дозе 35 мг/м2.
Внутривенное введение препаратов выполнялось каждые 10 суток.
Данные о профиле токсичности представлены в табл. 2, оценка проведена согласно критериям CTCAE 4.0 (Common Terminology Criteria for Adverse Events v. 4.0) [5].
При дооперационной оценке эффективности дозоинтенсивной НАХТ по критериям RECIST 1.1 полный регресс опухоли был зафиксирован у 5 (7,1%), частичный ответ – у 53 (75,7%) больных. Стабилизация процесса была отмечена в 6 (8,6%) случаях. Прогрессирование заболевания выявлено у 6 (8,6%) больных.
У 62 (89%) больных, получивших НАХТ в дозоинтенсивном режиме, в сроки от 2 до 3 недель после завершения системного лечения выполнено хирургическое вмешательство в объеме радикальной экстирпации матки, двусторонней аднексэктомии, тазовой лимфаденэктомии (Piver III). Шести (8,6%) пациенткам со стабилизацией опухолевого процесса и 2 (2,8%) с прогрессированием заболевания был проведен радикальный курс сочетанной химиолучевой терапии: в качестве радиосенсибилизатора использован цисплатин в дозе 40 мг/м2 еженедельно. Остальным 4 (5,7%) больным группы прогрессирования выполнено хирургическое лечение.
При морфологическом исследовании операционного материала установлено, что хирургическое вмешательство носило радикальный характер в подавляющем большинстве случаев – 61 (87,1%). В 1 (1,4%) случае был выявлен положительный край резекции бокового параметрия и влагалища.
В исследуемой группе больных патоморфологический ответ опухоли различной степени выраженности в ответ на проводимую дозоуплотненную НАХТ по схеме АР составил 82,8% (58 больных). У 5 (7,14%) пациенток полный клинический регресс опухоли подтвержден полным патоморфологическим ответом (pCR – pathologic complete response) (рис. 5).
У 12 (17,1%) больных морфологических признаков ответа опухоли на химиотерапевтическое лечение выявлено не было.
У всех пациенток с прогрессированием и рецидивом заболевания морфологический тип опухоли был представлен низкодифференцированным плоскоклеточным раком.
Патоморфологический ответ в зависимости от стадии заболевания представлен в табл. 3.
После хирургического вмешательства всем пациенткам проведен курс дистанционной конформной ЛТ на аппарате ЛУЭ «CЛ-75-5» РОД 2 Гр, до СОД 46–50 Гр на малый таз. Больной, для хирургическое вмешательство которой оказалось нерадикальным, до курса сочетанной ЛТ было проведено 2 цикла полихимиотерапии по схеме ТС.
При продолжающемся наблюдении до марта 2018 г. у 64 (91,4%) пролеченных больных на настоящий момент признаков прогрессирования заболевания не выявлено. В 6 (8,6%) случаях зарегистрировано прогрессирование заболевания с генерализацией процесса и в 2 (2,8%) – рецидив заболевания, в связи с чем продолжена системная лекарственная терапия.
При дооперационной оценке по шкале RECIST 1.1 у больных группы прогрессирования был зафиксирован рост первичного очага и/или увеличение тазовых лимфатических узлов, у больных группы рецидива заболевания – частичный регресс. Всем пациенткам выполнено хирургическое лечение в объеме радикальной экстирпации матки, двусторонней аднексэктомии, тазовой лимфаденэктомии (Piver III). В послеоперационном материале выявлена опухоль без признаков патоморфологического ответа на лечение. Рецидивы заболевания диагностированы через 6 и 12 месяцев после завершения лечения.
Обсуждение
Исследование показало, что дозоинтенсивная НАХТ является эффективным методом лечения местнораспространенного РШМ. При анализе профиля токсичности НАХТ по схеме АР показатели трактовалась как обратимые, не было выявлено 3–4-й степеней гематологической и негематологической токсичности. Объективный ответ был зарегистрирован в 83% случаев, частота радикального хирургического вмешательства составила 89%. Полный патоморфологический регресс выявлен в 7,14% случаев.
Полученные данные коррелируют с зарубежными публикациями. С конца 1980-х гг. накоплен опыт применения платиносодержащих препаратов в качестве предоперационной терапии пациенток с местнораспространенными формами РШМ (IB–IIIB-стадий). Поиску наиболее эффективной химиотерапевтической комбинации посвящено не одно научное изыскание. Пилотное исследование комбинации цисплатина, блеомицина и метотрексата на группе больных местнораспространенным РШМ показало 75,7% клинического ответа (полный ответ – 12,1%, частичный – 63,6%) [6].
Итальянские ученые провели оценку эффективности НАХТ в комбинации с радикальным хирургическим лечением по сравнению со стандартной ЛТ. Рандомизированное исследование проведено в 14 центрах, использованы данные 441 пациента с плоскоклеточным РШМ IB2–III-стадий. Все схемы ХТ включали цисплатин в монорежиме или в комбинации с одним или двумя цитостатиками. Средняя общая доза цисплатина в исследовании составила 300 мг/м2 и варьировалась от 150 до 320 мг/м2. Средняя продолжительность индукционной ХТ составила 39 дней (16–56 дней).
В связи с токсичностью ХТ была прекращена в отношении 5% больных, отложена на 1–2 недели 15% пациенток. Редукция доз химиопрепаратов потребовалась 3% больных. Основные виды токсичности: миелотоксичность (2–4-й степеней – 87%) и нефротоксичность (6%). После индукционной ХТ хирургическое вмешательство выполнено в 78% случаев в объеме операций PIVER II–V типов. При гистологическом исследовании операционного материала у 13% больных выявлен полный регресс опухоли, микроинвазивный рак – у 8%. По результатам гистологического исследования 48 больным проведено послеоперационное лечение: 38 пациенткам – дистанционное облучение малого таза, 10 – адъювантная ХТ. Пятилетняя ОВ была достоверно выше в группе больных поле индукционной ХТ: 59,9% по сравнению с группой ЛТ 44,5% (p=0,007).
Пятилетняя БРВ имела аналогичные закономерности – 54,4 и 41,3% соответственно (p=0,02). При анализе по подгруппам показано, что у пациенток с IB2–IIB-стадиями РШМ 5-летняя ОВ и БРВ достоверно выше в группе больных после НАХТ – 64,7 и 59,7% по сравнению с группой ЛТ– 46,7% (p=0,007) и 46,4% (p=0,02) соответственно. При III стадии заболевания достоверных отличий показателей 5-летней ОВ и БРВ в исследуемых группах не получено. На основании этих результатов можно предположить, что при увеличении стадии процесса исследуемая комбинация лечения становится менее эффективной по сравнению с ЛТ. Очевидно, что на показатели выживаемости существенно влияют стадия, метод лечения, размер опухоли шейки матки и статус лимфатических узлов [8]
Оценке эффективности комбинации ХТ с ЛТ по сравнению с хирургическим вмешательством посвящена научная работа Y.S. Choi et al. (2006). В это исследование были включены 94 пациента IB–IIA-стадий РШМ, которые на первом этапе получали 2–3 курса индукционной ХТ препаратами цисплатин и 5-фторурацил с интервалом 21 день. Объективный ответ на индукционную ХТ составил 66%: частичный регресс – 50%, полный – 16%, стабилизация – 34%. Всем пациенткам с объективным ответом на втором этапе выполнена расширенная экстирпация матки Piver III типа. Из 32 больных со стабилизацией заболевания ЛТ по радикальной программе проведена 16 пациенткам, расширенная экстирпация матки Piver III типа выполнена 16 больным. Из 78 оперированных больных 23 получили адъювантную ЛТ, исходя из наличия факторов риска по данным послеоперационного гистологического заключения. В группе больных, подвергнутых хирургическому лечению (n=78), 10-летняя ОВ составила 86,3%. Среди пациентов со стабилизацией (n=32) 10-летняя ОВ после ЛТ по радикальной программе (n=16) была достоверно ниже, чем у больных после хирургического лечения (n=16) (25 и 76,4% соответственно; p=0,0111). Согласно полученным результатам, хирургическое вмешательство в отношении больных со стабилизацией опухолевого процесса после индукционной ХТ улучшает отдаленные результаты лечения [8].
Накопленный опыт стал предметом крупномасштабного Cochrane мета-анализа. Первая часть мета-анализа сравнивает последовательное применение ХТ+ЛТ с радикальной ЛТ.
В анализ включены данные о лечении 2074 пациенток IB–IVA-стадий РШМ из 18 рандомизированных исследований. Продемонстрирована всего лишь тенденция к улучшению выживаемости при проведении курсов ХТ с интервалами менее 14 дней или применении цисплатина в дозе более 25 мг/м2 в неделю. В этом исследовании снижения риска смерти, риска локо-регионарного прогрессирования и риска возникновения отдаленных метастазов при проведении индукционной ХТ показано не было. При этом показано достоверное снижение выживаемости при проведении курсов ХТ с интервалами более 14 дней (p=0,005) или при применении цисплатина в дозе менее 25 мг/м2 в неделю (p=0,002) по сравнению с группой ЛТ по радикальной программе.
Вторая часть мета-анализа посвящена сравнению НАХТ и последующей операцией с ЛТ по радикальной программе. В этот анализ включены 872 пациентки IB–III-стадий из 5 рандомизированных исследований. При использовании лечебной комбинации НАХТ+операция подтверждено статистически достоверное снижение риска смерти на 35% (p=0,00004) и увеличение 5-летней ОВ на 14% (p=0,000036). Кроме того, для этой группы больных показано снижение риска системного и локо-регионарного прогрессирования на 32% (p=0,0001), а также снижение риска развития отдаленных метастазов на 37% (p=0,00001) [9].
Таким образом, по мнению ученых, последовательное применение НАХТ+ЛТ не только не улучшает, но в ряде случаев м ухудшает отдаленные результаты лечения больных РШМ. При этом использование НАХТ и хирургического вмешательства достоверно эффективнее ЛТ по радикальной программе, а следовательно, и комбинации НАХТ+ЛТ даже в случае стабилизации опухолевого процесса.
В 2012 г. опубликованы новые данные Cochrane-мета-анализа, посвященного сравнению индукционной ХТ с последующей операцией и хирургического лечения на первом этапе при местнораспространенных формах РШМ. В анализ включены 6 рандомизированных исследований общей численностью 1078 больных. В группе индукционной ХТ ОВ была достоверно выше на 23% (p=0,02), БРВ – на 25% (p=0,008). Кроме того, отмечена тенденция к снижению частоты возникновения рецидивов и метастазирования при применении индукционной ХТ. Также было показано, что частота появления метастазов в регионарных лимфатических узлах и инфильтрации параметриев достоверно ниже после индукционной ХТ (p<0,0001 и p=0,002 соответственно). При применении НАХТ не было отмечено влияния на ОВ дозы цисплатина (≤25 мг/м2 в неделю и >25 мг/м2 в неделю), межкурсового интервала при ХТ (≤14дней и >14 дней) и стадии заболевания (только IB или IB–IIIB-стадий) [4].
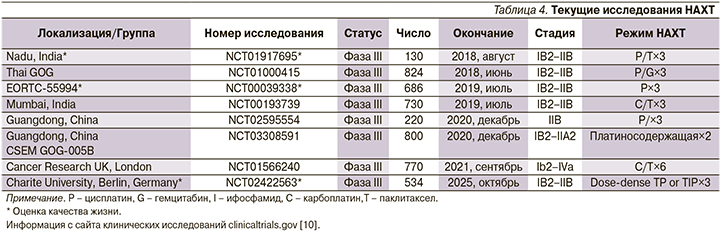
Многочисленные текущие рандомизированные исследования пытаются определить, сможет ли ХТ с последующей операцией получить преимущество над стандартным химиолучевым лечением (табл. 4). Во всех этих исследованиях используются платиносодержащие комбинации НАХТ, и большинство из них включают таксаны в терапевтическом режиме. Важно отметить, что три из текущих исследований (NCT01917695, NCT00039338, NCT02422563) оценивают качество жизни пациентов.
Заключение
Несмотря на значительные темпы развития области применения НАХТ, его роль остается спорной. НАХТ с последующей ЛТ по результативности не превосходит самостоятельного курса облучения. Применение НАХТ с последующим хирургическим вмешательством характеризуется хорошим клиническим ответом и приводит к увеличению показателей выживаемости пациентов, представляясь достойной альтернативой химиолуче-вому лечению. Большинство схем ХТ включают цисплатин; также постепенно увеличивается частота использования таксанов. Три цикла, короткий интервал между введениями и высокая доза цисплатина представляются оптимальными для НАХТ. Побочные эффекты и токсичность трактуются как приемлемые для больных РШМ. Тем не менее в настоящий момент невозможно сделать окончательных выводов о наиболее адекватном варианте индукционной лекарственной терапии. Окончательно роль НАХТ в лечении пока не определена и требует дальнейшего исследования.


