Введение
Рак желудка является второй ведущей причиной смерти от рака в мире [1] и России (13,8 % у мужчин и 12,3 % у женщин) [2, 3]. Стандартизованные показатели заболеваемости раком желудка для лиц обоего пола в России составляют 29,5 на 100 тыс. населения, при этом 70,6 % пациентов в момент установления диагноза имеют III–IV стадию заболевания [2, 3]. В России рак желудка – второй наиболее частый вид рака у мужчин (10,5 %) и пятый – среди наиболее частых видов рака у женщин (7 %) [2, 3]. Хирургическое вмешательство является единственным потенциально радикальным лечением; однако после операции у большинства больных развиваются местный рецидив или отдаленные метастазы [4]. Таким образом, большинство больных раком желудка требуют проведения системной терапии [5].
В России большинству больных раком желудка I–III стадии в момент установления диагноза проводится только хирургическое лечение (74 %), в то время как у 26 % пациентов выполняется комбинированное или комплексное лечение [2, 3]. В целом рандомизированные исследования продемонстрировали, что химиотерапия может увеличивать выживаемость и улучшать качество жизни пациентов с распространенным раком желудка по сравнению с наилучшей поддерживающей терапией [6]. Наиболее часто оценивалась комбинированная химиотерапия, включавшая фторурацил (ФУ) с цисплатином и препараты из группы антрациклинов. Стандартные режимы включают ФУ и цисплатин; эпирубицин, цисплатин и ФУ (ECF); ФУ, доксорубицин и метотрексат (FAMTX); ФУ, доксорубицин и митомицин (FAM), а также этопозид, лейковорин и ФУ (ELF). В рандомизированных исследованиях, в которых оценивались эти режимы, было продемонстрировано, что частота объективного эффекта находилась в пределах от 10 до 51 %, медиана времени до прогрессирования равнялась 3–7 месяцам, медиана общей выживаемости – 6–10 месяцам и однолетняя выживаемость составляла примерно 30 % [7–10]. Оценивались также различные новые цитотоксические препараты; однако результаты эффективности современных комбинаций не продемонстрировали достоверного увеличения показателей по сравнению с более старыми схемами лечения. В связи с этим необходимы исследования новых химиотерапевтических комбинаций, которые позволят улучшить результаты лечения пациентов с распространенным раком желудка.
Пеметрексед (Алимта®) – мультитаргетный антифолат, мишенью которого является ряд фолат-зависимых ферментативных путей метаболизма, и который ингибирует несколько ферментов, вовлеченных в синтез пуринов и пиримидинов [11–13]. Механизмы действия пеметрекседа могут объяснить его более высокую эффективность и более широкий спектр противоопухолевой активности, наблюдавшихся в доклинических исследованиях пеметрекседа, по сравнению с другими антиметаболитами, такими как ФУ, метотрексат или ралтитрексид [14]. Широкий спектр клинической активности пеметрекседа в отношении солидных опухолей, таких как колоректальный рак, рак поджелудочной железы, немелкоклеточный рак легкого (НМРЛ), мезотелиома и рак молочной железы [16], способствовал проведению ряда многообещающих исследований в рамках II фазы пеметрекседа у пациентов с распространенным раком желудка [17, 18].
Цисплатин является одним из наиболее широко используемых цитотоксических препаратов для противоопухолевого лечения и обладает широким спектром противоопухолевой активности в отношении эпителиальных опухолей [19]. На доклинических опухолевых моделях рака желудка и ксенотрансплантатах опухолей человека пеметрексед и цисплатин показали аддитивную или синергичную активность [15]. Комбинация цисплатина и пеметрекседа широко изучалась и одобрена для лечения злокачественной мезотелиомы плевры и распространенного НМРЛ [20, 21]. Рутинная профилактика фолиевой кислотой и витамином B12 достоверно улучшала профиль токсичности пеметрекседа при его использовании в монотерапии или в комбинации с цисплатином.
Недавнее исследование II фазы у больных раком желудка в Корее показало, что комбинация цисплатина (75 мг/м²) и пеметрекседа (500 мг/м²) обладает умеренной эффективностью и приемлемым профилем токсичности [22]. Другое недавнее исследование I–II фаз у пациентов с распространенным раком желудка, получавших терапию пеметрекседом в комбинации с цисплатином в фиксированной дозе 75 мг/м², определило рекомендуемую для II фазы дозу пеметрекседа – 700 мг/м² [23]. Настоящее исследование II фазы было спланировано таким образом, чтобы оценить эффективность и безопасность комбинации пеметрекседа (в рекомендованной по результатам исследования Chen J.S. дозе) и цисплатина у больных раком желудка IV стадии или рецидивирующим раком желудка, ранее не получавших химиотерапии. Первичной целью данного исследования была оценка частоты объективного эффекта при применении комбинации пеметрекседа и цисплатина в лечении рака желудка IV стадии или рецидивирующего рака желудка. Второстепенные цели исследования включали выживаемость без прогрессирования (ВБП), общую выживаемость (ОВ), длительность эффекта и безопасность.
Материал и методы
С декабря 2006-го по июль 2009 г. в 7 исследовательских центрах России в исследование были включены 53 пациента. Медиана возраста пациентов составляла 57 лет, 52,8 % среди пациентов составляли мужчины, 69,8 % пациентов имели общее состояние по шкале ECOG (Eastern Cooperative Oncology Group), равное 1; все больные относились к европеоидной расе.
Критериями включения являлись следующие условия:
• отсутствие ранее проводимой химиотерапии;
• наличие гистологически подтвержденной аденокарциномы желудка;
• IV стадия заболевания [24];
• пациенты не подлежали радикальному хирургическому лечению;
• или имели рецидив заболевания после предшествующего оперативного вмешательства и по меньшей мере один измеряемый в одном измерении опухолевый очаг в соответствии с критериями оценки эффекта при солидных опухолях (RECIST – Response Evaluation Criteria In Solid Tumors) [25].
Дополнительные критерии соответствия включали:
• общее состояние по шкале ECOG, равное 0–1 [26];
• возраст от 18 до 70 лет;
• ожидаемую продолжительность жизни не менее 12 недель;
• адекватные резервы костного мозга и функцию органов, включая расчетный клиренс креатинина ≥ 45 мл/мин на основе стандартной формулы Кокрофта и Голта [27].
Критериями исключения являлись:
• серьезные сопутствующие заболевания;
• наличие в анамнезе значимых неврологических или психических нарушений (включая судороги или деменцию);
• метастазы в головном мозге;
• неконтролируемая задержка жидкости в серозных полостях до включения в исследование;
• пациентов также исключали, если они не могли прервать прием ацетилсалициловой кислоты и других нестероидных противовоспалительных препаратов;
• или если пациенты не были способны или не желали принимать фолиевую кислоту, витамин B12 или кортикостероиды.
Протокол проводился в соответствии с Хельсинкской декларацией и Рекомендациями надлежащей клинической практики (ICH) и был одобрен этическим комитетом каждого участвующего в исследовании учреждения. До начала лечения все пациенты подписали информированное согласие.
Первичной целью данного многоцентрового несравнительного открытого исследования II фазы была оценка частоты общего объективного эффекта: полный регресс (ПР) + частичный регресс (ЧР). Второстепенные цели исследования включали выживаемость без прогрессирования (ВБП), общую выживаемость (ОВ), длительность эффекта и безопасность.
До включения в исследование у пациентов собирали анамнез, проводился физикальный осмотр и измерение опухоли с помощью визуализирующих методик (компьютерной томографии или рентгенографии). Оценку опухоли повторяли тем же методом, что и в исходном состоянии во время каждого второго цикла и каждые 6 недель после прекращения лечения до прогрессирования заболевания. Течение заболевания оценивалось в соответствии с критериями RECIST [25]. Включенные в исследование пациенты, которым были проведены исходные визуализирующие исследования, имевшие по меньшей мере одно исследование после получения по крайней мере одной дозы химиотерапии, считались подлежащими оценке в отношении противоопухолевого эффекта и анализов эффективности, включая ВБП, ОВ и длительность эффекта. Все пациенты, получившие хотя бы одну дозу пеметрекседа или цисплатина, считались подлежащими оценке безопасности. Перед каждым циклом пациенты оценивались в отношении токсичности в соответствии с общими критериями терминологии для нежелательных явлений, версия 3.0 (CTCAE v 3.0) Национального онкологического института (NCI) США.
Пациенты, соответствующие критериям включения, получали пеметрексед в дозе 700 мг/м² в виде 10-минутной внутривенной инфузии с последующей инфузией цисплатина в дозе 75 мг/м² в 1-й день 21-дневного цикла. Химиотерапию повторяли каждые 3 недели в количестве 6 циклов (если ранее не отмечалось признаков прогрессирования заболевания или непереносимости исследуемого лечения по любой причине). По усмотрению исследователя пациенты могли получить два или более дополнительных циклов лечения. Пациентам проводилась профилактика дексаметазоном в дозе 4 мг внутрь два раза в сутки – за день до, в день лечения и на следующий день после каждого 1-го дня лечения. Все пациенты получали внутрь фолиевую кислоту (350 – 1000 мкг) ежедневно и инъекции витамина B12 (1000 мкг) каждые 9 недель начиная за 1–2 недели до введения первой дозы и продолжая до 3 недель после введения последней дозы исследуемой комбинации препаратов.
Пациенты, требовавшие уменьшения (редукции) дозы пеметрекседа или цисплатина в 1-й день цикла, в течение всего оставшегося исследования получали редуцированную дозу препаратов. Пациенты, имевшие две редукции доз, с проявлениями токсичности, требующей выполнения третьей редукции дозы, прекращали исследуемую терапию. С целью восстановления от токсичности разрешались отсрочки лечебного цикла до 42 дней. Допускалось проведение сопутствующего поддерживающего лечения, например противорвотной терапии. В соответствии с рекомендациями Американского общества клинической онкологии допускалось использование препаратов, стимулирующих эритропоэз или гранулоцитарных колониестимулирующих факторов [29].
Все оценки эффективности терапии были проведены при двустороннем альфа-уровне, равном 0,05, если не указано иначе. Частота общего противоопухолевого эффекта сообщалась с использованием 95 % доверительного интервала (ДИ). При включении в исследование 50 подлежащих оценке пациентов, данное исследование имело 80 %-ную статистическую мощность, позволяющую не отвергать лечение при истинной частоте эффекта, равной 45 %, и 94 %-ную статистическую мощность, позволяющую не отвергать лечение при истинной частоте эффекта, равной 50 %. Если бы истинная частота эффекта составила 28 %, то вероятность дальнейшего исследования комбинации при данном виде опухоли равнялась бы 4,5 %. Оценка частоты общего противоопухолевого эффекта проведена по формуле:

Длительность противоопухолевого эффекта у ответивших на лечение пациентов измерялась с момента первой документации ПР или ЧР до прогрессирования заболевания; ВБП определялась как период времени с момента включения в исследование до даты прогрессирования заболевания или смерти от любой причины (в зависимости от того, что произойдет раньше); ОВ определялась как период времени с момента включения в исследование до даты смерти от любой причины. Все переменные, выраженные в виде времени-до-события, оценивались с помощью метода Каплана–Майера.
Все 53 пациента были оценены в отношении эффективности и безопасности.
Результаты
Исходные характеристики пациентов перечислены в табл. 1.
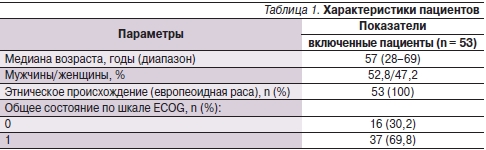
Примечание. ECOG – Восточная кооперированная онкологическая группа; N – суммарное число пациентов; n – число пациентов в группе.
Всего 53 пациентам было проведено 216 циклов лечения (табл. 2). Медиана числа циклов составила 4 (диапазон 1–8 циклов).
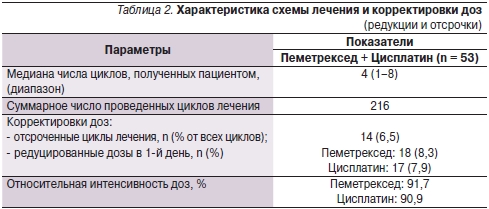
Двадцать (37,7 %) пациентов завершили по меньшей мере 6 циклов лечения. Средняя интенсивность дозы (в неделю) составила 214 мг/м² для пеметрекседа (92 % планируемой дозы) и 22,7 мг/м² для цисплатина (91 % планируемой дозы).
Тринадцати пациентам были выполнены 18 редукций дозы пеметрекседа (8,3 % назначенных доз) и 17 редукций дозы цисплатина (7,9 % назначенных доз). Сообщалось всего о 14 (6,5 %) отсрочках введения обоих препаратов в связи с нежелательными явлениями. Отсрочки введения препаратов не были связаны с неадекватной витаминопрофилактикой, ни одна из доз не была пропущена.
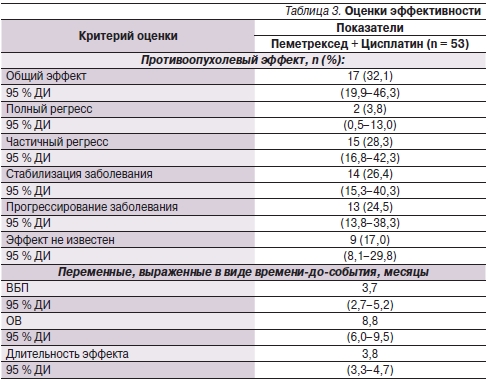
У 2 (3,8 %) из 53 пациентов, оцененных в отношении эффективности, была зарегистрирована ПР, у 15 (28,3 %) пациентов – ЧР, при этом частота общего объективного эффекта составила 32,1 % (95 % ДИ 19,9 % – 46,3 %). Кроме того, 14 (26,4 %) пациентов имели стабилизацию заболевания (СЗ), 13 (24,5 %) – прогрессирование заболевания (ПЗ) и 9 (17,0 %) пациентов были классифицированы как пациенты, у которых эффект лечения неизвестен (табл. 3). Частота случаев контроля заболевания, определенная как наилучший эффект (ПР + ЧР + СЗ), составила 58,5 %. У 17 пациентов, имевших противоопухолевый эффект, медиана длительности эффекта составила 3,8 месяца (95 % ДИ – 3,3 – 4,7). Медиана ВБП – 3,7 месяца (95 % ДИ – 2,7–5,2), а медиана ОВ – 8,8 месяца (95 % ДИ – 6,0 – 9,5). Вероятность выживаемости более 6 месяцев составила 61,4 % (95 % ДИ – 44,9–74,4 %), а выживаемости свыше 12 месяцев – 19,2 % (95 % ДИ – 5,2–39,7 %).
Токсичность в целом была слабовыраженной и обратимой или контролируемой (табл. 4). Наиболее частой лекарственно-обусловленной гематологической токсичностью III–IV степени являлась нейтропения у 29 (54,7 %) больных, из них около половины пациентов имели нейтропению III степени выраженности. Фебрильной нейтропении не было ни у одного пациента. Другими видами гематологической токсичности являлись анемия (в большинстве случаев III степени выраженности) и тромбоцитопения (в половине случаев III степени выраженности). Семи (13,2 %) пациентам проведены трансфузии: 2 пациентам – по две трансфузии, 3 – по три трансфузии и 2 пациентам – более 4 трансфузий каждому. Трое пациентов (каждый из них) имели алопецию и сыпь/реакцию гиперчувствительности I или II степени. Сообщалось о развитии лишь одного вида негематологической токсичности IV степени выраженности (почечной недостаточности). В процессе исследования отмечен один летальный исход в связи с токсичностью исследуемой терапии (внезапная смерть). Дополнительно два летальных исхода имели место в связи с нежелательными явлениями, связанными с исследуемой терапией, по оценке исследователя (панцитопенией и полиорганной недостаточностью). Пять (9,4 %) пациентов прекратили лечение в связи с нежелательными явлениями.
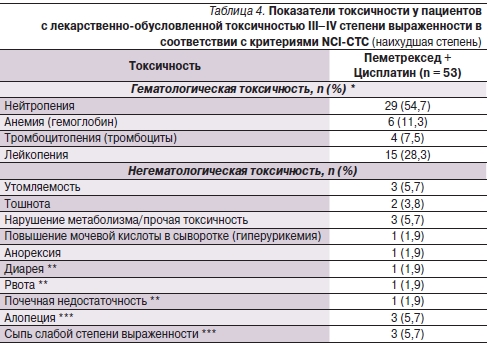
Примечание. NCI-CTC – National Cancer Institute – Common Toxicity Criteria.
* Перечислены только виды токсичности, наблюдавшиеся не менее чем у 3 % пациентов, по меньшей мере в одной группе. ** Данных три вида токсичности возникли у одного пациента. *** Токсичность I–II степени выраженности.
Обсуждение
Это было первое исследование II фазы, проведенное с участием исключительно российских пациентов, ранее не получавших химиотерапию, имевших распространенную аденокарциному желудка (IV стадии) и получавших лечение пеметрекседом с последующим введением цисплатина (700 и 75 мг/м² соответственно). Частота объективного эффекта составила 32,1 %, частота случаев контроля заболевания – 58,5 %. Медиана длительности эффекта составила 3,8 месяца, медиана ВБП – 3,7 и медиана ОВ – 8,8 месяца. В сочетании с благоприятным профилем токсичности эти результаты хорошо сопоставимы с результатами двух других недавних исследований пеметрекседа у пациентов с распространенным раком желудка.
Kim Y.H. и соавт. (2008) также выполнили многоцентровое несравнительное открытое исследование у пациентов с распространенным раком желудка с отсутствием предшествующей паллиативной химиотерапии. В исследовании оценивались эффективность и безопасность режима у 50 пациентов из Кореи, получавших стандартный дозовый режим пеметрекседа 500 мг/м² и цисплатина 75 мг/м² в 1-й день каждые 3 недели с добавлением фолиевой кислоты и витамина B12. Kim Y.H. и соавт. сообщили, что частота общего объективного эффекта составила 26 %, при этом СЗ отмечена в 30 % случаев. Медиана длительности эффекта составила 3,6 месяца, медиана ОВ – 6,6 месяца, ВБП – не сообщалась. Kim Y.H. и соавт. заявили, что наиболее частой токсичностью III–IV степени по шкале NCI-CTC была нейтропения (у 49 % пациентов), что совпадает с нашими данными. Численно лучшие результаты эффективности, сообщенные в нашей работе, по сравнению с исследованием Kim могут быть обусловлены использованием более высокой дозы пеметрекседа или характеристиками пациентов.
Однако несмотря на более высокую дозу, профиль безопасности и наблюдавшиеся виды токсичности были хорошо сопоставимы с режимом стандартных доз препаратов.
Chen J.S. и соавт. также сообщили результаты многоцентрового несравнительного открытого исследования I–II фаз у пациентов с нерезектабельным распространенным раком желудка и отсутствием предшествующей паллиативной химиотерапии [23]. Рекомендуемая доза, определенная в рамках I фазы исследования Chen J.S. по подбору дозы (n = 16), явилась основой режима, используемого в настоящем исследовании (700 мг/м² пеметрекседа и 75 мг/м² цисплатина). Вторая фаза исследования Chen J.S., в которую были включены 69 пациентов из Аргентины, Южной Кореи и Мексики, была подобной нашему исследованию, хотя демографические характеристики больных отличались от таковых у пациентов в нашем исследовании (100 % были европеоидной расы). В исследовании Chen J.S. 47 (68,1 %) пациентов были восточно-азиатского происхождения, 21 (30,4 %) являлись латиноамериканцами и 1 (1,4 %) пациент относился к европеоидной расе.
Частота общего объективного эффекта в исследовании Chen J.S. составила 23,5 %. Длительность эффекта составила 5,4 месяца, медиана ВБП – 4,9 и медиана ОВ – 11,8 месяца.
Кроме переменных эффективности и безопасности в исследовании Chen J.S. (2010) оценивалась также их связь с вариантами 5,10-метилентетрагидрофолатредуктазы (MTHFR). Интересно, что два варианта гена MTHFR, обладающие полиморфизмом (A1298C и C677T), обнаруживались в генотипе у 65 пациентов, что позволило оценить их связь с клиническими результатами. Исследование подтвердило, что частота выявления этих двух полиморфизмов варьируется в зависимости от географического происхождения пациентов, и продемонстрировало, что популяции пациентов неазиатского происхождения чаще являлись гетерозиготными по отношению к варианту A1298C, а вариант C677T чаще присутствовал в популяциях пациентов неазиатского происхождения.
Исследование Chen J.S. показало, что пациенты с A1298C-вариантом полиморфизма (главным образом пациенты неазиатского происхождения) имели медиану ОВ, равную 6,6 месяца, что достоверно меньше ОВ у пациентов с “wild type” (p = 0,001). Результаты ВБП также свидетельствовали о неблагоприятной прогностической роли вариантов A1298C у пациентов с распространенным раком желудка, получавших лечение пеметрекседом. Эти данные совпадают с результатами более ранних исследований [31, 32], сообщивших о более плохом прогнозе у пациентов с вариантами A1298C, что позволяет предположить, что варианты A1298C (пациенты A/C и C/C) могут являться отрицательными прогностическими факторами эффективности. Что касается вариантов C677T, то, подобно другим сообщениям, данные Chen J.S. показали, что этот аллель не ассоциируется с улучшенными результатами лечения больных раком желудка [32].
Было бы интересно оценить ассоциацию вариантов MTHFR в нашем исследовании, особенно потому что 100 % пациентов относились к европеоидной расе. Возможно, различия в некоторых оценках эффективности между нашим исследованием и исследованием в рамках II фазы, проведенным Chen J.S. (длительность эффекта – 3,8 по сравнению с 5,4 месяца, ВБП – 3,7 против 4,9 месяца и ОВ – 8,8 против 11,8 месяца), могли быть обусловлены демографическими различиями (соответственно, MTHFR-вариантами) между двумя исследованиями.
Заключение
Данное исследование у пациентов с распространенным раком желудка без предшествующей химиотерапии, получавших лечение пеметрекседом с последующим введением цисплатина (700 и 75 мг/м² соответственно), демонстрирует умеренную эффективность изучаемого режима и удовлетворительный профиль безопасности. Частота случаев контроля заболевания, равная 58,5 %, свидетельствует об эффективности комбинации при данной стадии заболевания в этой популяции больных.
Благодарности
Авторы благодарят всех пациентов, исследователей и организации, вовлеченных в данное исследование. Слова благодарности авторы также выражают сотрудникам компании Eli Lilly: Kurt Krejcy – за помощь в разработке исследования, Марии Осиповой – за ее содействие, Patti Moore и Noelle Gasco – за помощь в подготовке статьи. Авторы хотят также поблагодарить Ирину Петухову за помощь в переводе текста статьи.
Данное исследование было спонсировано EliLillyandCompany.


