Введение
Рак желудка (РЖ) занимает 4-е место в структуре злокачественных новообразований и 2-е – как причина смертности населения России от злокачественных новообразований [1]. Перитонеальный канцероматоз (ПК) является одним из наиболее неблагоприятных факторов прогрессирования и рецидивирования опухолей желудка [2]. У 40% больных РЖ ПК выявляют во время диагностической лапароскопии, и в 10–46% случаев имеет место метахронно выявленный ПК после ранее проведенного хирургического или комбинированного лечения [3, 4].
К факторам риска развития ПК при РЖ относятся инвазия серозной оболочки, метастазы в лимфатические узлы, наличие свободных опухолевых клеток в брюшной полости (cyt+), диффузный тип опухоли (классификация по Lauren) [5, 6]. Длительное время наличие ПК у больных РЖ рассматривалось как терминальная стадия онкозаболевания с медианой выживаемости 3–5 месяцев [6, 7].
В России большинство больных ПК при РЖ считаются инкурабельными и не подлежат специальному противоопухолевому лечению, а применение симптоматических терапии сводится к повторным лапароцентезам с целью эвакуации асцита.
На сегодняшний день стандартным методом лечения больных ПК служит паллиативная химиотерапия (ХТ), включающая комбинации препаратов платины, фторпиримидинов и/или таксанов (XELOX, FOLFOX, DCF, CF и т. п.). Однако даже современные режимы увеличивают показатели общей выживаемости больных диссеминированным РЖ лишь до 8–12 месяцев [6]. Эффективность системной ХТ для пациентов с ПК ниже, чем при метастазах в паренхиматозные органы, особенно при таких химиорезистентных опухолях, как перстневидноклеточный РЖ. Между тем для 10–40% таких больных поражение брюшины имеет изолированный характер в отсутствие других отдаленных метастазов [8, 9].
В настоящее время существует несколько потенциально эффективных методов лечения пациентов с изолированным ПК, одним из которых является выполнение циторедуктивной операции в сочетании с гипертермической интраоперационной внутрибрюшной ХТ (ГИВХ). Данный метод показал высокую эффективность при ряде диссеминированных злокачественных опухолей, таких как псевдомиксома брюшины, рак яичников, рак толстой кишки. Однако эффективность применения ГИВХ к больным РЖ с ПК оказалась значительно ниже вследствие низкой чувствительности к цитостатическим препаратам [10–12].

Систематический обзор 10 опубликованных исследований позволил оценить медиану выживаемости больных РЖ с ПК после циторедуктивной операции с ГИВХ. Она составила лишь 7,9 месяца для всей группы и 15 – в случае полной циторедукции [13].
Опыт МНИОИ по проведению циторедуктивных операций с ГИВХ больным РЖ продемонстрировал ограниченную эффективность данного метода при распространенном перитонеальном канцероматозе (перитонеальный раковый индекс [PCI] >7), медиана выживаемости составила 5,5 месяца [2]. Проведенные на сегодняшний день исследования, включая опыт МНИОИ им. П.А. Герцена, показали, что наиболее эффективно данный метод применяется с профилактической целью в отношении больных РЖ с высоким риском развития ПК, в частности при выходе опухолевого процесса на серозную оболочку (Т4а), наличии лимфогенных метастазов (N+) и cyt+ [14].
Еще одним потенциально эффективным методом лечения больных изолированным ПК является внутрибрюшная аэрозольная ХТ под давлением (ВАХД). Впервые процедуру ВАХД выполнили в Германии в 2011 г. [15].
Принцип действия данной методики основан на физических свойствах газов, находящихся под давлением. Доклинические исследования показали преимущества доставки цитостатиков в виде аэрозоля в условиях карбоксиперитонеума по сравнению с обычным внутриполостным введением химиопрепаратов. При введении мелкодисперсного аэрозоля отмечается более равномерное распределение химиопрепарата, а также более глубокое его проникновение непосредственно в опухолевые ткани по сравнению с обычным внутриполостным введением или ГИВХ [16]. Первый опыт клинического применения ВАХД в отношении больных РЖ с ПК принес обнадеживающие результаты. В частности, полный патоморфологический ответ наблюдался у 25% больных, частичный ответ или стабилизация – у 34% [17]. Следует отметить, что для ВАХД используют низкие дозы цисплатина и доксорубицина (10% от обычной дозы применения в ходе гипертермической интраперитонеальной ХТ).

МНИОИ им. П.А. Герцена (филиал ФГБУ НМИРЦ Минздрава России) стал первым и пока единственным в России учреждением, в котором с 2013 г. проводят ВАХД больным ПК. Нами разработан протокол проспективного клинического исследования больных диссеминированным РЖ, включивший сеансы ВАХД (цисплатин 7,5 мг/м2 и доксорубицин 1,5 мг/м2) в сочетании с системной ХТ XELOX (оксалиплатин и капецитабин). В этой статье мы предоставляем первые результаты по безопасности и эффективности 68 процедур ВАХД у 37 больных РЖ с ПК.
Материал и методы
Лечебный протокол
В соответствии с принятым клиническим протоколом всем больным РЖ до начала лечения выполняют диагностическую лапароскопию или лапаротомию (если канцероматоз не был выявлен на дооперационном этапе) с оценкой PCI и морфологической верификацией (рис. 1).
На первом этапе проводят 3–4 курса системной ХТ по схеме XELOX (оксалиплатин 130 мг/м2 внутривенно в сочетании с капецитабином 1000 мг/м2 перорально 2 раза в день в течение 2 недель). Далее проводят 3 сеанса ВАХД с интервалом в 6 недель и двумя курсами системной ХТ по схеме XELOX между сеансами. В случае прогрессирования опухолевого процесса на фоне проводимого лечения (увеличение PCI на 50% и более, нарастание специфического асцита, появление отдаленных лимфогенных и гематогенных метастазов, ургентных осложнений) больной выбывает из исследования. Инструментальное обследование проводили по окончании первых 4 курсов системной ХТ и далее перед каждым последующим сеансом ВАХД.
Если больной уже получал предшествующую системную ХТ непосредственно перед обращением в МНИОИ (n=37), сеансы ВАХД начинали без предварительных курсов XELOX, а решение о проведении ХТ между курсами и схеме лечения принимали индивидуально, исходя из объема ранее проведенного лечения и его эффективности.

Методика ВАХД
Процедуру осуществляют посредством лапароскопического доступа в условиях операционной, оборудованной ламинарной системой вентиляции. В соответствии с принятой методикой выполняют пункцию брюшной полости в параумбиликальной зоне с наложением карбоксиперитонеума 12 мм рт.ст. Устанавливают два троакара размером 10 мм. Проводят тщательную ревизию органов брюшной полости с оценкой PCI и заполнением специализированной карты по методике Р. Sugarbaker. Производят многоточечную био-псию брюшины (не менее 3 анатомических зон) с целью верификации канцероматоза и оценки лечебного патоморфоза (при повторных процедурах). Эвакуируют асцитическую жидкость, объем которой регистрируют в карте.
Подключают форсунку-распылитель к ангиографическому инжектору высокого давления и вводят ее в один из троакаров (рис. 2). Проверяют герметичность брюшной полости. Начинают подачу растворов химиопрепаратов: цисплатин в дозе 7,5 мг/м2 вводится в раствор NaCl 0,9% общим объемом 150 мл; доксорубицин в дозе 1,5 мг/м2 – в раствор NaCl 0,9% общим объемом 50 мл. Введение осуществляют со скоростью 30 мл/мин, максимальное давление – 200 psi. Процесс введения препаратов контролируют по видеомонитору.
В брюшной полости при прохождении через форсунку растворы преобразуются в аэрозоль, находящийся под давлением. Карбоксиперитонеум поддерживается в течение 30 минут при 37°С. По окончании сеанса аэрозоль эвакуируют отсосом в закрытую систему сброса медицинских газов через 2 последовательно установленных микропористых фильтра. Троакары удаляют с ушиванием мест проколов. Дренирование брюшной полости не проводят.
Оценка безопасности
Оценку безопасности ВАХД проводили на 1-е и 3-е сутки послеоперационного периода посредством физикального осмотра и рутинных лабораторных исследований. Регистрацию нежелательных явлений проводили в соответствии с принятыми критериями побочных эффектов (CTCAE 4.0).
Оценка эффективности
Эффективность ВАХД оценивали на основании двух критериев – уровня PCI и степени лечебного патоморфоза по данным патоморфологического исследования повторных биопсий брюшины.
Диагностическую лапароскопию с биопсией проводили по завершении первых 4 курсов системной ХТ по схеме XELOX, далее перед каждым последующим сеансом ВАХД с интервалом в 6 недель. Последующее обследование включало эзофагогастродуоденоскопию, компьютерную томографию грудной и брюшной полости, онкомаркеры (РЭА, СА-72-4, СА-125) и рутинные лабораторные анализы (общий анализ крови, биохимический анализ крови, общий анализ мочи).
Результаты
С августа 2013 по сентябрь 2016 г. выполнено 68 процедур внутрибрюшной аэрозольной химиотерапии под давлением 37 больным РЖ с ПК (см. таблицу).
На первом этапе всем больным выполнено диагностическое вмешательство с целью верификации канцероматоза и оценки PCI. В зависимости от распространенности процесса больные были условно разделены на 3 группы: PCI <9 баллов был выявлен у 14 (37,8%) пациентов, от 9 до 18 – у 16 (43,2%), >18 баллов – у 7 (19%). По гистологической структуре опухоли преобладал диффузный тип по классификации Lauren (низкодифференцированный и перстневидно-клеточный рак) – 35 пациентов. Еще 2 (5,4%) больным был диагностирован рак кишечного типа. Асцит был выявлен у 13 (35,1%) больных; стеноз, потребовавший эндоскопического стентирования, обнаружен у 5 (13,5%) пациентов.
По состоянию на сентябрь 2016 г. по одному сеансу ВАХД проведено 19 (51,4%) пациентам, 2 процедуры – 8 (21,6 %), 3 – 7 (19%) и 4 процедуры – 3 (8,1%) больным. Причины, по которым 19 пациентам проведен лишь 1 сеанс ВАХД, предоставлены ниже. Основной причиной досрочного выбывания из исследования стало прогрессирование основного заболевания (13 пациентов). Один больной был потерян из-под наблюдения. Пять пациентов ожидают второго сеанса ВАХД. Средний срок пребывания в стационаре составил 3 дня.
Внутрибольничной летальности (CTCAE 5) и серьезных осложнений (CTCAE 4) зарегистрировано не было. На 68 процедур ВАХД отмечено 5 случаев нежелательных явлений. У одного больного на интраоперационном этапе была диагностирована перфорация диафрагмы во время взятия биопсии брюшины с развитием карбокситоракса, что потребовало дополнительного дренирования плевральной полости (CTCAE 3 – 2,9 %).
У 4 (10,8%) пациентов была отмечена тошнота без позывов на рвоту в течение первых 2 суток после выполнения ВАХД.
Лечебный патоморфоз по данным биопсии был оценен у 16 больных, получивших как минимум один сеанс ВАХД, которым была проведена повторная биопсия. У 4 (25%) пациентов из 16 зарегистрирован полный патоморфологический ответ (отсутствие клеток рака на фоне фиброзной ткани).
У 10 (62,5%) больных на фоне фиброзной ткани определялись единичные клетки рака с выраженными дистрофическими изменениями, что расценено как частичный ответ. Отсутствие патоморфологических изменений по сравнению с исходной биопсией отмечено у лишь у 2 (12,5%) из 16 пациентов (рис. 3).
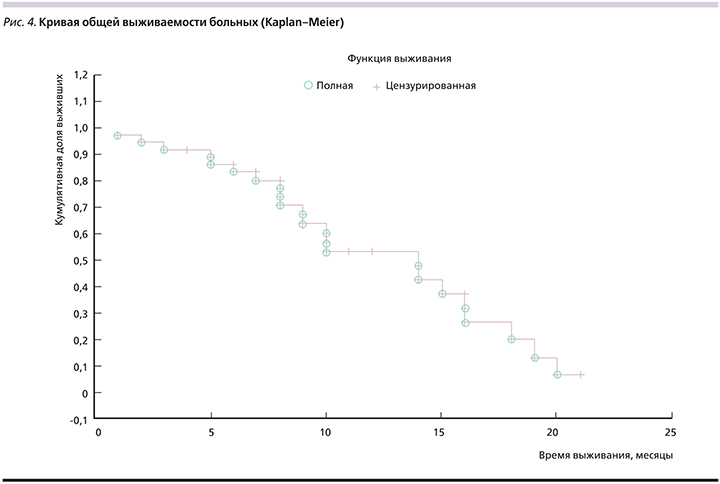
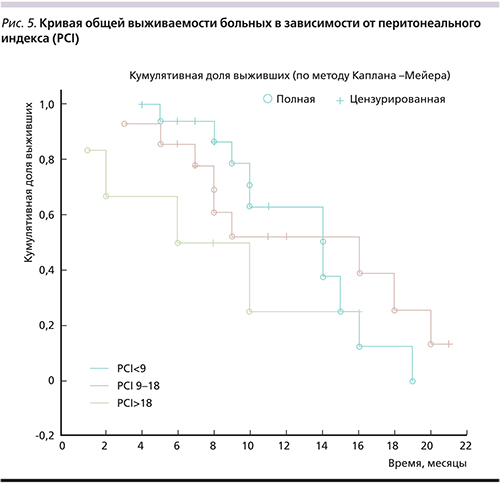
Медиана общей выживаемости составила 14 месяцев, годичная выживаемость (Kaplan–Meier) – 47,8% (рис. 4). Живы и продолжают участие в исследовании в течение первого года наблюдения 14 пациентов. При оценке выживаемости в зависимости от исходного PCI достоверных различий между группами не отмечено (рис. 5). Имеет место тенденция к более низкой выживаемости в группе распространенного канцероматоза (PCI >18), однако малое число наблюдений не позволяет судить о достоверности различий.
Обсуждение
Наше исследование показывает, что сочетание ВАХД с системной ХТ больным РЖ с ПК оказывает несомненный терапевтический эффект. Объективный патоморфологический ответ зарегистрирован у 87,5% пациентов в группе из 16 больных, которым выполнили повторную биопсию. Низкая частота осложнений, хорошая переносимость процедуры, ее малоинвазивность позволяют применять данную методику в отношении ослабленных больных.
Московский научно-исследовательский онкологический институт стал вторым центром в мире и первым в России по применению ВАХД в сочетании с системной ХТ больным РЖ с распространенным ПК.
Наличие канцероматоза брюшины при раке имеет неблагоприятный прогноз с медианой выживаемости 3–6 месяцев. Частота перитонеальной диссеминации у первичных больных РЖ, по данным литературы, варьируется от 14 до 43% и составляет 35% от всех синхронных метастазов [18]. Одним из ведущих методов лечения больных ПК является системная ХТ, однако ее эффективность весьма ограниченна, что обусловлено наличием гемато-перитонеального барьера, который не позволяет добиваться высокой концентрации химиопрепаратов в брюшине.
Внутрибрюшная аэрозольная химио-терапия под давлением (ВАХД) является новым методом лечения больных ПК, который позволяет существенно повышать глубину проникновения цитостатиков и их концентрацию в тканях [19]. У больных РЖ с распространенным ПК, ожидаемая продолжительность жизни которых ограничена несколькими месяцами, ВАХД является простым малоинвазивным и безопасным методом паллиативного лечения. Кроме того, данный метод позволяет выполнять повторные диагностические лапароскопии с целью объективной оценки динамики течения заболевания с морфологическим подтверждением ответа на терапию [20]. Впервые метод ВАХД был использован в Германии в качестве 3-й линии терапии на фоне прогрессирования после нескольких линий системной ХТ [21].
Протокол нашего исследования предполагает использование ВАХД в сочетании с системной ХТ в качестве первой линии лечения больных РЖ с распространенным ПК, что является уникальным в мировой практике. Несмотря на внедрение данного метода в десятки учреждений по всему миру, остаются широкие возможности для дальнейшего научного поиска в плане усовершенствования методики, использования новых схем и сочетаний цитостатиков.
Выводы
Внутрибрюшная аэрозольная химиотерапия под давлением (ВАХД) является простым и безопасным методом паллиативного лечения больных РЖ с распространенным ПК. Для окончательного суждения об эффективности ВАХД необходимы дальнейшие исследования по сравнению комбинированного метода (ВАХД+системная ХТ) и традиционных методов лечения (системная ХТ).


