Статья посвящена изучению эффективности и токсичности низких доз комбинированной химиотерапии гемцитабина с цисплатином для 131 больной диссеминированным раком молочной железы (РМЖ), прогрессирующим после применения антрациклиновых антибиотиков, таксанов, капецитабина и других цитостатиков. Гемцитабин назначали внутривенно капельно в дозе 600–750 мг/м2, цисплатин – 30 мг/м2 в 1-й и 8-й дни каждые 3 недели. Комбинация гемцитабина с цисплатином в низких дозах оказалась эффективной в лечении диссеминированного РМЖ не только во 2-й, но и в 3-й, 4-й и последующих линиях химиотерапии и может быть использована с целью получения повторных лечебных эффектов при исчерпанных возможностях лекарственного лечения антрациклинами, таксанами, капецитабином и другими противоопухолевыми агентами. Преимуществом комбинации гемцитабина с цисплатином является умеренная и предсказуемая токсичность, не требующая редукции дозы, что позволяет применять ее после многократных курсов химиотерапии, а также пожилым и ослабленным больным диссеминированным РМЖ, в т. ч. в амбулаторных условиях.
Лечение диссеминированного рака молочной железы (РМЖ), несмотря на успехи терапии антрациклиновыми антибиотиками, таксанами, капецитабином и другими цитостатиками, является
паллиативным и направленным на увеличение общей выживаемости и повышение качества жизни больных. Создание нового аналога дезоксицитидина – гемцитабина, обладающего синергизмом со всеми цитостатиками, используемыми в лечении РМЖ, расширило перспективы ранее существовавших стандартных подходов. Наибольший синергизм гемцитабина отмечен к цисплатину (73 %), что
проявляется способностью подавлять естественное восстановление ДНК клетки после повреждения ее цисплатином, и это в конечном итоге приводит к апоптозу опухолевой клетки [1]. В настоящее время продолжается дальнейшее изучение оптимальных доз комбинированной химиотерапии (ХТ) гемцитабином с цисплатином для различных режимов лечения диссеминированного РМЖ в фазе прогрессирования опухоли (табл. 1).
Таблица 1.
Эффективность комбинации гемцитабина и цисплатина (2–5-я линии) в лечении больных диссеминированным РМЖ.
Целью настоящего исследования является изучение эффективности и токсичности низких доз [1] гемцитабина с цисплатином во 2-й, 3-й, 4-й и последующих линиях ХТ для больных диссеминированным РМЖ.
Материал и методы
С 2000 по 2011 г. в исследование включили 131 женщину в возрасте от 33 до 73 лет (средний возраст –54 года) с диссеминированным РМЖ, прогрессирующим после применения антрациклинов, таксанов, капецитабина и других цитостатиков. Комбинированную ХТ гемцитабином и цисплатином в низких дозах во 2-й линии получили 28 больных, в 3-й – 54, в 4-й и последующих линиях – 49 (табл. 1). Гемцитабин назначали в дозе 600–750 мг/м2 в виде 30-минутной инфузии, цисплатин – 30 мг/м2 внутривенно капельно на фоне пре- и постгидратации в 1-й и 8-й дни каждого 3-недельного цикла. Всего проведено 549 циклов. Среднее число циклов на одну больную составило 4,2 (от 2 до 12 циклов). Группы были сопоставимыми по возрасту, общему состоянию, рецепторному статусу, экспрес-
сии HER2, локализации и числу метастатических очагов до начала лечения (табл. 2).
Таблица 2.
Характеристика пациентов с диссеминированным РМЖ, получавших комбинированную ХТ гемцитабином и цисплатином в низких дозах.
Более чем 60% пациентов в каждой группе были изначально рефрактерны
или стали резистентными к стандартным антрациклин-содержащим программам ХТ (табл. 3), что являлось отягощающим прогностическим фактором в отношении частоты и продолжительности изучавшихся лечебных эффектов.
Таблица 3.
Предшествующее лечение больных диссеминированным РМЖ, подвергшихся ХТ по схеме гемцитабин + цисплатин.
Уровень рецепторов эстрогенов (ЭР) и прогестерона (ПР) определялся с помощью иммуногистохимического и радиоконкурентного методов у 70 % больных. Оценка HER2-статуса была выполнена для 62 % больных. Детекция гиперэкспрессии рецепторов эпидермального фактора роста 2-го типа (HER2) выполнялась с помощью иммуногистохимической реакции, ампфликация гена HER2 – FISH-методом. Качественную оценку рецепторного статуса всех больных выполнить не удалось в связи с давностью истории заболевания у большинства пациенток.
Объективный ответ (ОО) опухоли на лечение оценивался в соответствии с критериями оценки эффекта для солидных опухолей (RECIST). Дополнительные критерии оценки эффективности лечения – время до прогрессирования заболевания (ВДП); длительность ответа (ДО), оцениваемая только у больных, достигших полной (ПР) или частичной ремиссии (ЧР), и общая выживаемость (ОВ). В число критериев субъективного ответа входили улучшение общего статуса и ослабление болевого синдрома. Общее состояние больных оценивалось по шкале ECOG.
Оценка болевого синдрома производилась по шкале ВОЗ:
• 0 (нет симптомов);
• 1 (умеренные симптомы);
• 2 (симптомы средней выраженности);
• 3 (тяжелые симптомы);
• 4 (особенно тяжелые симптомы, угрожающие жизни).
Токсичность оценивалась с использованием общепринятых критериев NCIC-CTC на протяжении всего лечения и в течение 28 дней после последнего введения препаратов.
Результаты и обсуждение
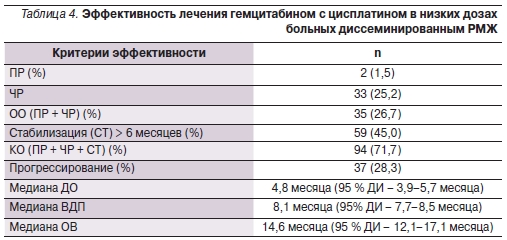
В общей группе ОО и клинически значимый ответ (КО) оказались достаточно высокими (26,7 и 71,7 % соответственно) с медианой ВДП 8,1 месяца (95 % доверительный интервал [ДИ] – 7,7–8,5 месяцев) и медианой ОВ 14,6 месяца (95% ДИ – 12,1–17,1 месяца; табл. 4).
Проведенные дискриминантный и регрессионный анализы зависимости критериев эффективности всей выборки от клинических факторов выявили ряд корреляций (табл. 5). Аналогичные результаты были получены при выполнении дискриминантного и регрессионного анализов в зависимости от линии лекарственного лечения.
Таблица 5.
Значимость клинических характеристик в дискриминантном анализе ОО и регрессионном анализе ВДП, ДО и ОВ у пациентов с диссеминированным РМЖ, получавших ХТ гемцитабином и цисплатином в низких дозах.
Так, например, у больных в удовлетворительном состоянии были выше медиана ОВ (при ECOG 0-1 – 16,2 месяца, при ECOG 2-3 – 12,4 месяца; р = 0,003) и ВДП (при ECOG 0-1 – 5,0 месяцев, при ECOG 2-3 – 4,0 месяца; р = 0,026). Выявлена корреляция между выраженным болевым синдромом и снижением ОВ (р = 0,0001). Медиана ВДП у больных с метастазами в лимфатические узлы составила 4,0 месяца, а в их отсутствие – 6,4 месяца (р = 0,003); при метастатическом поражении печени – 3,5 против 5,2 месяца соответственно (р = 0,022). Медиана ОВ при диссеминации процесса в лимфатические узлы
также была ниже (12,3 против 17,0 месяцев; р = 0,002). Таким образом, статус больного, наличие болевого синдрома, метастатическое поражение лимфатических узлов и печени
являются прогностическими факторами в отношении эффективности изучаемой комбинации. Важно, что ОО у больных диссеминированным РМЖ не зависел от резистентности к антрациклиновым антибиотикам, а также от уровня в опухоли рецепторов эстрогенов и HER2.
Как и предвиделось, ОО на проводимое лечение был выше во 2-й линии по сравнению с 3-й и ≥ 4-й линиями ХТ (39,3, 27,8 и 18,4 % соответственно; р < 0,05), но КО (ПР + ЧР + СТ) был достаточно высок независимо от линии ХТ, в т. ч. у интенсивно леченных пациентов (85,7, 59,3 и 77,6 % соответственно; р > 0,05). При этом ПР метастатических очагов был зарегистрирован у двух больных, получавших комбинированную химиотерапию гемцитабином с цисплатином в исследуемых дозах в 3-й линии ХТ (табл. 6).
Таблица 6.
Эффективность лечения гемцитабином с цисплатином в низких дозах в зависимости от линии ХТ.
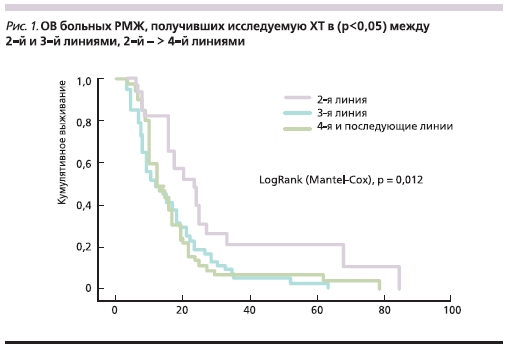
Медиана ОВ (рис. 1) при использовании исследуемой комбинации GP была также выше во 2-й линии по сравнению с последующими линиями ХТ (23,4, 11 и 13 месяцев соответственно; р < 0,05).
Изучение субъективного ответа на ХТ гемцитабином и цисплатином во всех исследуемых группах больных с прогрессирующим диссеминированным РМЖ (независимо от линии ХТ) показало достоверное снижение интенсивности болевого синдрома и улучшение общего статуса больных, а следовательно, и
повышение качества жизни (рис. 2, 3). Улучшение общего состояния до ECOG 0 было отмечено у 28,6, 28,5 и 18,5 пациентов во 2-й, 3-й и ≥ 4-й линиях соответственно, т. е. многие больные стали способны выполнять работу, которую осуществляли до болезни, без ограничений (рис. 2). Снижение интенсивности болевого синдрома отмечено во всех исследуемых группах. Число пациентов, нуждающихся в назначении нестероидных противовоспалительных средств и наркотических анальгетиков уменьшилось почти в 3 раза во всех группах.
Рисунок 2.
Динамика общего статуса больных диссеменированным РМЖ при ХТ гемцитабином и цисплатином (р<0,005).
Рисунок 3. Динамика болевого синдрома у больных диссминированным РМЖ при ХТ гемцитабином и цисплатином (р < 0,005).
Те или иные побочные эффекты (табл. 7) были зарегистрированы длявсех больных, но преимущественно I–II степени; осложнения III–IV степени (в основном III степени), как правило, не требовали соответствующей терапевтической коррекции несмотря на истощение резервов костного мозга и наличие структурно-функциональных изменений в паренхиматозных органах. Фебрильная нейтропения не регистрировалась ни в одном случае. Гематологические осложнения имели обратимый характер и не приводили к отказу от лечения. В ряде случаев увеличение интервала между циклами
до 28 дней являлось вполне достаточным для восстановления гемопоэза. Наиболее частыми негематологическими осложнениями являлись умеренные тошнота и рвота. Летальных исходов,
связанных с токсичностью препаратов, не было отмечено. Не выявлено различий гематологической и негематологической токсичности комбинации гемцитабина с цисплатином в зависимости от линии ХТ, что свидетельствует о безопасности назначения данной комбинации, в т. ч. у ранее интенсивно леченных пациентов. Таким образом, осложнения комбинированной ХТ гемцитабином с цисплатином в низких дозах характеризовались умеренностью, предсказуемостью, обратимостью, т. е. не требовали редуцирования дозы.
Таблица 7.
Токсичность комбинации гемцитабина с цисплатином в низких дозах у больных диссеминированным РМЖ.
Анализ результатов проведенных клинических исследований показал высокую активность комбинации гемцитабина с цисплатином в качестве ХТ 1-й линии у больных диссеминированным РМЖ с частотой ОО 81 % и медианой ОВ 27,9 месяца [3].
Tas и соавт. [6] и Kim и соавт. [7] назначали гемцитабин в дозе 1200–2000 мг/м2 в 1-й и 8-й дни, а цисплатин в дозе 50–75 мг/м2 в 1-й и 15-й дни каждого 3–4-недельного цикла больным диссеминированным РМЖ с прогрессированием после применения антрациклинов и/или таксанов.
При этом показатели ОО и ОВ были сопоставимы с результатами, полученными нами при использовании
низких доз изучаемых цитостатиков во 2–3-й линиях ХТ.
В настоящее время с целью повышения эффективности лекарственного лечения диссеминированного РМЖ продолжается поиск комбинаторных партнеров гемцитабина для различных режимов и схем ХТ. В клинических исследованиях II–III фаз оценивается эффективность и переносимость гемцитабина в комбинации с различными цитостатиками, в частности препаратами платины, таксанами, винорел
бином, капецитабином, а также с таргетными препаратами: трастузумабом, инипарибом и др. [6–14].
Заключение
Таким образом, результаты проведенной работы свидетельствуют о том, что комбинация гемцитабина с цисплатином эффективна в лечении диссеминированного РМЖ не только во 2-й, но и в 3-й, 4-й и последующих линиях ХТ, может быть использована с целью получения повторных
лечебных эффектов при исчерпанных возможностях лекарственного лечения антрациклинами, таксанами, капецитабином и другими цитостатиками. Использование данного режима ХТ ведет к повышению качества жизни больных в виде улучшения общего статуса и снижения интенсивности
болевого синдрома. Преимуществом комбинации низких доз гемцитабина с цисплатином является умеренная и предсказуемая токсичность, как правило не требующая специальной коррекции или редукции дозы, что позволяет применять ее после многократных курсов ХТ, а также пожилым и ослабленным больным диссеминированным РМЖ, в т. ч. в амбулаторных условиях.
1. Nagorney RA, Link J, Blitzer J, et al. Gemcitabine plus cisplatin repainting doublet therapy in previously
treated, relapsed breast cancer patient. J Clin Oncol 2000;18(11):2245–49.
2. Heinemann V, Stemmler HJ, Wohlrab A, et al. High efficacy of gemcitabine and cisplatin in patients with predominantly anthracycline-and taxane-pretreated metastatic breast cancer. Cancer Chemother Pharmacol
2006;57(5):640–46.
3. Fuentes H, Galderillo G, Alexander F, et al. Phase II study of gemcitabine plus cisplatin in metastatic breast cancer. Anticancer Drugs 2006;17(5):565–70.
4. Seo J, Oh S, Choi C, et al. Phase II study of a gemcitabine and cisplatin combination regimen in
taxane resistant metastatic breast cancer. Cancer Chemother Pharmacol 2007;59(2):269–74.
5. Sanchez-Escribano Morcuende R, Ales-Martinez J, Aramburo Gonzalez P. Low dose gemcitabine plus cisplatin in a weekly-based regimen as salvage therapy for relapsed breast cancer after taxane-anthracycline-containing regimens. Clin Transl Oncol 2007;9(7):459–64.
6. Tas F, Guney N, Derin D, et al. Biweekly administration of gemcitabine and cisplatin chemotherapy in patients with anthracycline and taxanepretreated metastatic breast cancer. Invest New Drugs 2008;26(4):363–68.
7. Kim G, Oh S, Kwon H, et al. Phase II study of Gemcitabine plus Cisplatin in Patients with Anthracycline- and Taxane-Pretreated Metastatic Breast Cancer. Cancer Res Treat 2008;40(3):101–05.
8. Chew H, Doroshow J, Frankel P, et al. Phase II studies of gemcitabine and cisplatin in heavily and minimally pretreated metastatic breast cancer. J Clin Oncol 2009;27(13):2163–69.
9. Somali I, Alacacioglu A, Tarhan M, et al. Cisplatin plus gemcitabine chemotherapy in taxane/anthracycline-resistant metastatic breast cancer. Chemotherapy 2009;55(3):155–60.
10. Chan S, Romieu G, Huober J, et al. Phase III study of gemcitabine plus docetaxel compared with capecitabine plus docetaxel for anthracyclinepretreated patients with metastatic breast cancer. J Clin Oncol 2009;27(11):1753–60.
11. Shehata S, Saad E, Goda Y, et al. A phase II study of gemcitabine combined with vinorelbine as first-line chemotherapy for metastatic breast cancer. Hematol Oncol Stem Sell Ther 2010;3(1):1–6.
12. Malmstrom A, Hansen J, Malmberg L, et al. Gemcitabine and capecitabine in combination for advanced anthracycline and taxane pretreated breast cancer patients: A phase II study. Acta Oncol 2010;49(1):35–41.
13. Yardley D, Burris H, Hanson S, et al. Weekly gemcitabine and trastuzumab in the treatment of patients with HER2- overexpressing metastatic breast cancer. Clin Breast Cancer 2009;9(3):178–83.
14. O’Shaughnessy J, Osborne C, Pippen JE, et al. Iniparib plus Chemotherapy in Metastatic Triple-Negative Breast Cancer. N Engl J Med 2011;364:205–14.
Cемиглазова Татьяна Юрьевна – кандидат медицинских наук, старший научный сотрудник отдела терапевтической онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ. E-mail:
Гершанович Михаил Лазаревич – доктор медицинских наук, профессор, руководитель отдела терапевтической онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ. e-mail:
Латипова Дилором Хамидовна – аспирант отделения химиотерапии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ. E-mail:
Филатова Лариса Валентиновна – кандидат медицинских наук, старший научный сотрудник отдела терапевтической онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ. E-mail:
Чубенко Вячеслав Андреевич – кандидат медицинских наук, заведующий отделением химиотерапии с паллиативной помощью, ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ. E-mail:
Семиглазов Владислав Владимирович – доктор медицинских наук, заведующий кафедрой онкологии СПбГМУ им. акад. И.П. Павлова. E-mail:
Мацко Дмитрий Евгеньевич – доктор медицинских наук, профессор, руководитель лаборатории патоморфологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Клименко Вероника Викторовна – ординатор кафедры онкологии СПбГМУ им. акад. И.П. Павлова. E-mail: