Рак яичников (РЯ) является широко распространенным заболеванием как в России,
так и за рубежом. В большинстве случаев в связи с бессимптомным течением болезни РЯ выявляется на поздних стадиях, что во многом определяет неблагоприятный прогноз течения заболевания. С появлением таксанов в 1996 г. наиболее эффективной при РЯ оказалась комбинация препаратов
платины и паклитаксела в качестве первой линии лечения. Несмотря на то что у большинства больных при применении этой схемы достигается полный клинический эффект, примерно в 70 % случаев развиваются рецидивы заболевания [1]. Современные тенденции лечения РЯ включают изучение
молекулярной биологии опухоли и подбор таргетных препаратов, а также определение их эффективности при совместном назначении с химиотерапией (ХТ).
Ангиогенез и его ингибиторы
При возникновении злокачественной опухоли ее клетки нуждаются в доставке питательных веществ и кислорода, что приводит к формированию новой патологической сети сосудов (неоангиогенез). Характерной особенностью опухолевого ангиогенеза являются формирование неполноценной сосудистой сети с нарушенной структурой сосудистой стенки и как следствие – с ее повышенной проницаемостью, что создает благоприятные условия для питания и метастазирования опухоли. Патологически извитая сосудистая сеть опухоли затрудняет нормальный кровоток и может пре-
пятствовать доставке цитостатических агентов в опухолевую ткань [2].
Сосудистый эндотелиальный фактор роста (VEGF) является одним из наиболее мощных стимуляторов неоангиогенеза и активно изучаемой мишенью терапии. Увеличение экспрессии VEGF отмечается при ряде злокачественных новообразований, в т. ч. при РЯ, причем в большинстве случаев повышенная экспрессия VEGF ассоциируется с неблагоприятным прогнозом. VEGF увеличивает экстравазацию
плазменных протеинов и воды в опухолевое окружение, что изменяет форму экстрацеллюлярного матрикса, приводит к усилению клеточной миграции и пролиферации [3].
Бевацизумаб – это рекомбинантное гуманизированное моноклинальное антитело, которое селективно связывается с молекулой VEGF и нейтрализует ее, тем самым блокируя воздействие VEGF на рецепторы. Эффективность бевацизумаба при рецидивах РЯ сопоставима с таковой при использовании цитостатических агентов.
Данные о высокой эффективности бевацизумаба у многократно леченных больных распространенным РЯ стали основанием для совместного назначения бевацизумаба и комбинации производных платины и таксанов в качестве первой линии терапии. В рандомизированном плацебо-контролируемом исследовании GOG-218 приняли участие больные РЯ с III–IV стадиями после оптимальной или субоптимальной циторедукции. Больные были рандомизированы в 3 группы сравнения: 1) стандартная ХТ: карбоплатин AUC 6 и паклитаксел 175 мг/м2 + плацебо; 2) стандартная ХТ + бевацизумаб 15 мг/кг во время ХТ; 3) стандартная ХТ + бевацизумаб 15 мг/кг во время ХТ и в дальнейшем до прогрессирования. В исследование были включены 1873 пациентки, ранее не получавшие ХТ (табл. 1) [4]. Добавление бевацизумаба к ХТ не привело к заметному улучшению результатов лечения по сравнению с контрольной группой, но увеличило токсичность терапии за счет частого развития артериальной гипертензии (АГ) и перфораций кишечника. В группе с продолжением введения бевацизумаба после окончания ХТ отмечено статистически значимое увеличение времени до прогрессирования (ВДП) на 3,8 месяца по сравнению с контрольной группой (р < 0,001), однако это не привело к существенному увеличению продолжительности жизни (ПЖ).
Таблица 1. Результаты исследования GOG 218.
В другое исследовании (ICON-7) включили больных РЯ с I–IIA стадиями с высоким риском прогрессирования или наличием светлоклеточной опухоли и IIB–IV стадий заболевания, рандомизированных в группу стандартной ХТ карбоплатином и паклитакселом или в группу стандартной ХТ с добавлением бевацизумаба. Стандартный режим химиотерапии включал карбоплатин в дозе AUC 6 и паклитаксел по 175 мг/м2 каждые 3 недели, в исследуемой группе бевацизумаб в дозе 7,5 мг/кг каждые 3 недели назначался со второго курса ХТ, максимальное число
введений бевацизумаба могло составить 18 [5]. Всего в исследование были включены 1528 больных, у которых в большинстве случаев выявлялись IIIC и IV стадии заболевания по классификации FIGO. Оптимальная циторедукция (размеры остаточных опухолевых образований в брюшной полости < 1 см) имела место у 74 % больных. Медиана ВДП в контрольной группе и группе бевацизумаба составила 17,4 и 19,8 месяца (р = 0,0041). Наибольшим выигрыш от применения бевацизумаба отмечен у больных с массивным распространением болезни (III–IV стадии), т. е. в прогностически наиболее неблагоприятной группе. В этой подгруппе добавление бевацизумаба к ХТ увеличило медиану ПЖ на
7,8 месяца (с 28,8 до 36,6; р = 0,002). Добавление бевацизумаба в меньшей, чем в исследовании GOG-218, дозе (7,5 против 15 мг/кг) обусловило низкую частоту токсических реакций, представленных в основном АГ, венозными и артериальными тромбозами (табл. 2). Частота кишечных перфораций и протеинурии была незначительной в обеих группах.
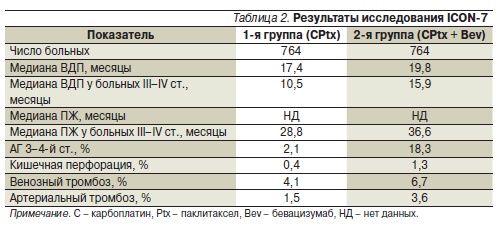
Таким образом, в исследовании ICON-7 было показано, что добавление бевацизумаба к ХТ может улучшать результаты лечения больных с распространенным опухолевым процессом. Кроме того, была продемонстрирована эффективность меньшей дозы бевацизумаба (7,5 мг/кг по сравнению с 15.0
мкг/кг в исследовании GOG-218) и показан больший выигрыш от добавления бевацизумаба группе больных субоптимальной циторедукцией.
После публикации результатов этих двух исследований бевацизумаб был включен в стандарт первой
линии ХТ. В настоящее время проводится несколько исследований по лечению РЯ с включением бевацизумаба. В исследовании GOG-262 стандартная терапия с добавлением бевацизумаба сравнивается с дозоинтенсивной еженедельной ХТ и бевацизумабом с последующей поддерживающей терапией бевацизумабом в обеих группах. В исследовании GOG-252 оцениваются лечебные подходы, включающие интенсификацию доз, внутрибрюшинный путь введения и воздействие на ангиогенез. Больные разделены на три группы: 1) дозоинтенсивная схема с включением еженедельных введений в сочетании с бевацизумабом, который вводится одновременно с ХТ и далее назначается в качестве поддерживающей терапии;2) внутрибрюшинная ХТ в сочетании с бевацизумабом во время ХТ и в качестве поддерживающей терапии; 3) внутрибрюшинное введение карбоплатина и внутривенное введение паклитаксела в сочетании с бевацизумабом во время ХТ и в качестве поддерживающей терапии. Также проводится исследование по определению оптимальной длительности (15 или 30 месяцев) поддерживающей терапии бевацизумабом после окончания первой линии ХТ (BOOST). Результаты этих интересных исследований ожидаются.
Ингибиторы тирозинкиназ
К другой группе лекарственных средств, влияющих на ангиогенез, относятся ингибиторы тирозинки-
наз, которые в большинстве случаев являются мультитаргетными препаратами. Механизм их действия сводится к прямому подавлению работы самого рецептора, фосфорилирование которого приводит к активации сигнальных путей PI3K/Akt/MAPK и как следствие – запускает процессы ангиогенеза, усиливает клеточную пролиферацию, миграцию клеток, приводящую к метастазированию [6].
В процессе эмбриогенеза эпителий яичников формируется из клеток Мюллерова протока, и это приводит к тому, что клетки, выстилающие яичник, имеют характеристики и эпителиальной, и мезенхимальной ткани [7]. Это помогает объяснить тот факт, что при эпителиальном РЯ присутствуют и маркеры, относящиеся к мезенхимальной ткани, такие как рецепторы тромбоцитарного фактора роста (PDGFR), рецепторы фактора роста стволовых клеток (c-kit), рецепторы фактора роста фибробластов (FGFR). Причем отмечено, что экспрессия PDGFR при РЯ наблюдается в 50–80 % случаев
[8]. Явления гипоксии стимулируют выработку опухолевыми клетками факторов роста и цитокинов (например, VEGF, PDGF, FGF), которые при взаимодействии с рецепторами оказывают влияние на эндотелиоциты и перициты сосудистой стенки, фибробласты, стимулируя формирование новой сосудистой сети.
Препарат нинтеданиб (BIBF1120) блокирует рецепторы VEGFR, PDGFR и FGFR. В исследовании III фазы
AGO-OVAR12 больные РЯ получают стандартную терапию (паклитаксел/карбоплатин) в сочетании с нинтеданибом 200 мг 2 раза в сутки во время ХТ и в последующем в течение двух лет или до прогрессирования, а группа контроля – стандартную терапию и плацебо.
Пазопаниб, также являющийся мультитаргетным ингибитором тирозинкиназы (VEGFR, PDGFR, c-kit),
был одобрен в качестве препарата первой линии при раке почки. В настоящее время проводится исследование по изучению пазопаниба в качестве поддерживающей терапии после первой линии лечения распространенного РЯ. В исследование включены 900 больных, ежедневно получающих
пазопаниб 800 мг или плацебо до прогрессирования заболевания или в течение двух лет.
Ингибиторы ангиопоэтинов
Другим направлением в развитии антиангиогенной терапии является воздействие на ангиопоэтины и их рецепторы. Ангиопоэтины-1 и -2 играют немаловажную роль в развитии и стабилизации сосудистой сети. После их присоединения к тирозинкиназному рецептору Tie-2 происходит активация сигнального пути Akt и стимуляция выработки сурвивина, который ингибирует апоптоз клеток эндотелия [9]. Помимо этого ангиопоэтин-1 стабилизирует сосудистую сеть, уплотняя соединения между эпителиальными клетками и увеличивая покрытие стенки перицитами. Ангиопоэтин-2 редко
экспрессируется в нормальной ткани, однако его количество резко возрастает при гипоксии, одним из условий которой является ремоделирование сосудов в опухоли. Ангиопоэтин-2 в большинстве случаев продуцируется непосредственно эндотелиоцитами. Предполагается, что блокирование взаимодействия ангиопоэтина-2 с рецептором Tie-2 приводит к снижению клеточной пролиферации эндотелиоцитов, что обусловливает уменьшение избыточного числа сосудов в опухоли и как следствие – ее объема [10].
Препарат AMG386 (требананиб) ингибирует взаимодействие ангиопоэтинов-1 и -2 с рецептором Tie-2.
Результаты исследований II фазы по изучению AMG386 при рецидивах РЯ позволили начать исследования этого препарата в рамках первой линии ХТ. В исследовании TRINOVA3, в которое
планируется включить 2000 больных, выделено две группы: 1) в исследуемой группе стандартное лечение сочетается с AMG386 15 мг/кг во время ХТ и в дальнейшем в качестве поддерживающей терапии в течение 18 месяцев или до прогрессирования РЯ; 2) в контрольной группе пациенты получают стандартную терапию и плацебо. Стоит отметить, что преимуществом AMG386 оказалась низкая встречаемость таких видов токсичности, как АГ, кишечная перфорация и замедление заживления раневых поверхностей [11].
Инсулиноподобный фактор роста
Инсулиноподобный фактор роста 1 (IGF-1) вовлечен в процессы опухолевого прогрессирования и метастазирования, а также ингибирования апоптоза. В настоящее время при рецидивах РЯ изучаются препарат AMG 479, являющийся моноклональным антителом против IGF-1, и препарат OSI-906, который блокирует не только рецептор IGF-1, но и инсулиновый рецептор. Результаты исследований при рецидивах РЯ еще не опубликованы, но набор больных в исследование II фазы по изучению AMG 479 в качестве препарата, добавляемого к стандартной терапии первой линии после оптимальной циторедукции, уже идет.
Новые мишени в лечении РЯ
Поиск биологических маркеров для селекции больных РЯ является приоритетной задачей онкологии.
В настоящий момент при рецидивах РЯ активно изучаются два таких маркера. Первый из них – это определение мутации в генах BRCA1/2. При мутации в этих генах возникает недостаточность гомологичной рекомбинации при двухцепочечных разрывах ДНК. А при использовании ингибиторов
PARP (поли(АДФ-рибозо)полимераза) у этой категории больных возникает блок второго пути репарации (эксцизионного механизма), что приводит к генетической нестабильности клетки и последующей ее гибели. PARP-ингибитор олапариб в монотерапии продемонстрировал эффективность в отношении больных РЯ с мутацией BRCA 1/2 [12]. Исследование II фазы по изучению олапариба в качестве средства поддерживающей терапии после первой линии ХТ было опубликовано в прошлом году [13]. В него были включены 265 пациенток, разделенных на 2 группы. Частота мутаций в генах BRCA 1/2 в обеих группах оказалась сопоставимой: 22,8 % – в исследуемой, 21,7 % – в контрольной.
В исследуемой группе больные после окончания платиносодержащей первой линии ХТ получали поддерживающую монотерапию олапарибом в дозе 400 мг дважды в сутки внутрь до прогрессирования, в контрольной группе – плацебо. Медиана ВДП у больных исследуемой группы составила 8,4 месяца, контрольной – 4,8 месяца (р < 0,001). Однако выигрыш в ВДП при использовании в качестве поддерживающей терапии олапариба не оказал влияния на ПЖ больных, медиана которой составила в указанных группах 29,7 и 29,9 месяца соответственно. Изучение олапариба в рамках первой линии ХТ находится на стадии планирования.
Одной из многообещающих мишеней при РЯ является α-фолатный рецептор (АФР) – трансмембранный
белок, обладающий высокой аффинностью к фолатам и участвующий в транспортировке их в клетку. Экспрессия АФР резко возрастает в опухолях эпителиального происхождения, и РЯ не оказался исключением [14]. Экспрессия АФР достигает 90 % при немуцинозном РЯ и коррелирует со стадией заболевания, степенью злокачественности, ответом на ХТ [15]. В исследованиях in vitro было показано, что при выраженной экспрессии АФР возрастает пролиферация опухолевых клеток и подавляется лекарственнозависимый апоптоз [15]. В настоящее время проводится исследование III фазы по оценке моноклонального антитела к АФР (фарлетузумаб) при платино-чувствительных рецидивах РЯ. Вероятно, при позитивных результатах этого исследования изучение фарлетузумаба будет продолжено в рамках первой линии лечения больных РЯ.
Другим перспективным препаратом является EC145 (винтафолид). Это конъюгат винкаалкалоида и лиганда к фолатному рецептору, что позволяет цитостатическому агенту беспрепятственно проникать в клетку. В исследовании PRECEDENT комбинация EC145 и пегилированного липосомального доксорубицина (ПЛД) сравнивалась с монотерапией ПЛД в рамках II фазы при платинорезистентном РЯ, и при ее применении было отмечено статистически значимое увеличение медианы ВДП [16]. При этом максимальное значение медианы ВДПбыло достигнуто в группе больных с высокой экспрессией АФР. В настоящий момент проводится исследование III фазы PROCEED по изучению действия винтафолида на больных платинорезистентным РЯ.
Заключение
За последнее время разработано множество таргетных молекулярных агентов, которые изучаются на
больных РЯ. Недавние исследования показали, что ингибиторы ангиогенеза оказались в отношении этой опухоли перспективными препаратами, а бевацизумаб включен в состав стандартной терапии первой линии в европейских странах. Лучшее понимание молекулярной биологии опухоли позволит выявить новые потенциальные терапевтические мишени, что будет иметь важное значение в выборе оптимальной тактики лечения больных РЯ.



