Нейроэндокринные опухоли (НЭО) – гетерогенная группа редких, медленно прогрессирующих опухолей, происходящих из нейроэндокринных клеток. Биологические характеристики НЭО зависят от клеток предшественников, анатомической локализации и секреторной функции. НЭО способны синтезировать, запасать и секретировать биологически активные вещества (пептиды, гормоны, нейропередатчики) и экспрессировать нейроэндокринные маркеры.
Клинические проявления НЭО в первую очередь ассоциированы с соответствующими эндокринными гиперфункциональными синдромами, связанными с продукцией таких биологически активных веществ, как серотонин, инсулин, гастрин, глюкагон, адренокортикотропный гормон (АКТГ) и др. Наиболее часто встречается карциноидный синдром (КС), который сопровождает развитие примерно 20% высокодифференцированных НЭО тощей или подвздошной кишки [1, 2]. Считается, что КС возникает преимущественно у пациентов с метастазами в печень, когда гормоны попадают в большой круг кровообращения.
Более половины НЭО не обладают повышенной гормональной активностью и условно относятся к нефункционирующим. Под понятием «нефункционирующие» прежде всего подразумевают НЭО с определенными морфологическими признаками без клинических проявлений гиперфункциональной активности. Бессимптомное течение может быть связано с синтезом неактивных гормонов, параллельной секрецией пептидных ингибиторов или понижающей регуляцией периферических рецепторов [3]. Клинические проявления таких неоплазий чаще обусловлены наличием объемного образования и местным воздействием опухоли на окружающие органы и ткани, а также проявлениями метастатической болезни. Развитие нефункционирующих НЭО может характеризоваться такими неспецифическими общими симптомами, как периодические боли, которые могут возникать в течение многих лет, тошнота, рвота, слабость, быстрая утомляемость, приступообразный кашель и одышка. Обычно нефункционирующие опухоли выявляются при компьютерной и магнитно-резонансной томографии, хирургических и эндоскопических вмешательствах.
Большинство НЭО являются высокодифференцированными, растут медленнее, чем другие злокачественные опухоли, и часто клинически проявляются только при возникновении метастатической болезни или КС, что отдаляет время постановки диагноза в среднем на 7–9 лет. Разнообразие клинических симптомов НЭО также затрудняет своевременную постановку правильного диагноза, что еще более усугубляет течение болезни и часто приводит к необратимым изменениям со стороны органов и систем. В данном аспекте наибольшую ценность для пациентов с НЭО приобретают осведомленность и онкологическая настороженность терапевтов, эндокринологов, дерматологов, инфекционистов, невропатологов, психиатров и врачей других специальностей.
Часть НЭО имеют отличительные клинические признаки и характеристики, свойственные определенному гормону, что отражается в их названии.
Гастриномы – гастрин-продуци-рующие опухоли поджелудочной железы (ПЖ) и двенадцатиперстной кишки. Проявляются развитием синдрома Золлингера–Эллисона, характерными для которого являются гиперхлоргидрия; гипертрофия складок слизистой оболочки желудка вследствие избытка гастрина; наличие рецидивирующих осложненных пептических язв, не поддающихся стандартной противоязвенной терапии, и жидкого стула. Диарея развивается примерно у половины больных, а у 7–35% пациентов может быть единственным клиническим симптомом заболевания. Причины развития диареи при синдроме Золлингера–Эллисона связаны с эвакуацией в тощую кишку значительного количества кислого содержимого с последующим усилением моторики тонкой кишки и развитием в ней реактивного воспаления. Избыток гастрина непосредственно вызывает замедление всасывания натрия и воды в тонкой кишке и обильную вторичную продукцию панкреатических гидрокарбонатов. Инактивация липазы при низких значениях рН приводит к возникновению стеатореи. Приблизительно у 13% больных синдромом Золлингера–Эллисона отмечаются тяжелые проявления эзофагита, причем у части пациентов – с формированием пептических язв и стриктур пищевода [3, 4]. Для дифференциальной диагностики синдрома Золлингера–Эллисона специфичен нагрузочный тест с глюкагоном и глюконатом кальция, введение кото-рых приводит к повышению уровня гастрина.
Инсулиномы – инсулин-продуцирующие опухоли ПЖ. В редких случаях встречается внепанкреатическое поражение абберантной ткани двенадцатиперстной, тощей, подвздошной кишки, легких, шейки матки [3]. Клинически проявляются симптомами гипогликемии: головной болью, вялостью, головокружениями, нарушением или «затуманиванием» зрения, снижением концентрации внимания, амнезией, реже – судорогами или стойким неврологическим дефицитом с развитием паралича и комы; катехоламиновой реакцией в виде тремора, учащенного сердцебиения, появления холодного пота, чувства голода, беспокойства и страха. Иногда гипогликемические состояния проявляются приступами психомоторного возбуждения, заканчивающимися глубоким расстройством сознания. Клиническая картина инсулином характеризуется т.н. триадой Уиппла: приступы спонтанной гипогликемии натощак или после физической нагрузки; снижение содержания сахара в крови (<2,22 ммоль/л) во время приступа; купирование тяжелого приступа введением глюкозы или глюкагона [5].
Випомы – функционирующие НЭО из островковых клеток ПЖ, продуцирующие вазоинтестинальный полипептид (ВИП). В 90% случаев випомы локализуются в ПЖ, а в 10% – имеют внепанкреатическую локализацию (в области симпатического ствола) и морфологическую структуру гаглионевром, ганглиобластом или нейробластом [3, 6]. ВИП-секретирующие образования описаны также в надпочечниках, тонкой кишке, средостении и легких. Основными признаками випом являются постоянная или интермиттирующая диарея, боль в животе, снижение массы тела, гипокалиемия, ацидоз и обезвоживание – совокупность данных симптомов получила название «синдром Вернера–Моррисона», или панкреатической холеры. Характерным признаком секреторной диареи является отсутствие улучшения при воздержании от приема пищи. В большинстве случаев выделяется более 3 литров жидкого стула в сутки. Иногда тяжелая водянистая секреторная диарея достигает 30 литров в сутки, что приводит к выраженной потере жидкости и электролитов с развитием астении, судорог, нарушением сердечного ритма и даже внезапной смерти. У 20% пациентов в течение приступов диареи наблюдается гиперемия лица подобно КС [6].
Глюкагономы – редкие опухоли из α-клеток ПЖ, как правило сопровождающиеся типичным синдромом, развивающимся в результате избытка глюкагона: потеря массы тела, хронические высыпания на коже, нарушение углеводного обмена, стоматит, хейлит и глоссит, аллопеция, анемия, тромбозы вен, желудочно-кишечные симптомы, включающие диарею, боль в животе, колики, анорексию. Патогномоничными симптомами для глюкагономы являются сыпь и некролитическая мигрирующая эритема, которая чаще всего локализуется в паху с распространением на гениталии, в области промежности, ануса и на уровне бедер; довольно часто эритема наблюдается в околоротовой области и сопровождается появлением язвочек в углах рта. Обычно в области пораженных участков пациенты отмечают выраженный зуд и боли. Могут возникать неврологические симптомы, такие как атаксия, деменция и мышечная слабость, часто развиваются психические расстройства. Отмечается увеличение частоты тромбоэмболии, проявляющейся тромбозом глубоких вен и тромбоэмболией легких. Более половины случаев смерти при глюкагономе связаны с тромбоэмболическими осложнениями [3, 7].
Соматостатиномы – редкие опухоли из D-клеток ПЖ. Встречаются также в желчевыводящих путях, тонкой кишке, (в основном в двенадцатиперстной кишке), толстой и прямой кишке, бронхах, описаны случаи секреции соматостатина (СС) мелкоклеточными опухолями легких, медуллярными опухолями щитовидной железы и феохромоцитомой [5]. Проявляются т.н. ингибиторным синдромом, связанным с избыточной продукцией соматостатина, который тормозит секрецию почти всех панкреатических и кишечных гормонов, снижает моторику желудка и кишечника, ухудшает всасывание жиров и кальция. Обычно у пациентов отмечаются гипергликемия, холелитиаз, диарея и стеаторея, гиперхлоргидрия, диспептический синдром, анемия и потеря массы тела. Однако у больных внепанкреатическими соматостатиномами «классический» симптомокомплекс практически не наблюдается, а клинические проявления заболевания связаны только с местным воздействием опухоли [8].
Существует ряд опухолей, которые секретируют эктопические гормоны, такие как АКТГ, рилизинг-гормоны, паратгормонсвязанный пептид, кальцитонин, соматотропин, панкреатический полипептид, лютенизирующий гормон и др. Клинические симптомы данных НЭО обусловлены соответствующими гормональными проявлениями. Эктопическая секреция АКТГ может приводить к развитию эндогенного гиперкортицизма, эктопическая секреция паратгормона при паратиреномах связана с гиперкальциемией и известковыми отложениями, соматолибериномы могут сочетаться с акромегалией. Диагноз таких опухолей подтверждается повышением в плазме уровня соответствующих гормонов. При иммуногистохимическом исследовании данных опухолей в большей части клеток обычно присутствует положительная реакция на эктопический гормон, вызывающий клиническую симптоматику.
КС обусловлен избыточным высвобождением в кровоток вазоактивных пептидов, основным из которых является серотонин. Среди всех пациентов с НЭО частота КС варьируется от 8 до 35% , из них 75–90% случаев КС связаны с опухолями тонкой кишки.
Серотонин (5-гидрокситриптамин, 5-ГТ) является одни из важных регуляторных аминов в организме человека. Формируется из триптофана с образованием под воздействием декарбоксилазы ароматических кислот промежуточного продукта-5-ГТФ (5-гидрокситриптофана) и распадается до 5-гидрокси-3-индолилуксусной кислоты (5-ГИУК), выделяющейся с мочой. Около 90% эндогенного серотонина содержится в желудочно-кишечном тракте (ЖКТ), где он в основном синтезируется и накапливается в энтерохромаффинных клетках, принимая участие в регуляции моторики и секреции слизи. Также к секреции серотонина способны тучные клетки, 5% серотонина синтезируется в 5-ГТ-нейронах. Почти весь (95%) 5-ГТ плазмы связывают тромбоциты [9]. Серотонин оказывает прямое действие на гладкую мускулатуру, в т.ч. в сосудистой стенке, вызывая в разных условиях и в зависимости от типа рецепторов сокращение или релаксацию. Кроме того, он может подавлять или потенцировать ответы, индуцированные другими вазоактивными агентами [10]. Примерно у 5% больных вследствие сдвига в сторону избыточного синтеза серотонина из триптофана возникают дефицит никотиновой кислоты и снижение синтеза белка, что приводит к развитию гипоальбуминемии и «пеллагроподобного» симптомокомплекса, который включает глоссит, стоматит, кожную сыпь, дерматит, диарею и деменцию. Также может развиваться дилятационная кардиомиопатия [2,11].
Наиболее высоким содержанием серотонина отличаются опухоли тонкой кишки, кроме двенадцитиперстной, аппендикса, восходящего отдела ободочной кишки. Некоторые НЭО могут секретировать кинины, простогландины и субстанцию Р, что также способно приводить к развитию «классического» КС [2, 11].
В НЭО поперечно-ободочной, нисходящей и прямой кишки практически не происходит превращения триптофана в серотонин и другие метаболиты, однако в них также могут содержаться желудочно-кишечные гормоны. При данных опухолях клиническая симптоматика КС встречается редко [3].
В опухолях дыхательных путей, тимуса, пищевода, желудка, ПЖ, двенадцатиперстной кишки часто отсутствует декарбоксилаза ароматических кислот, поэтому вместо серотонина они синтезируют его предшественник 5-ГТФ и гистамин, а также различные полипептидные гормоны, такие как АКТГ, субстанцию Р, простогландины, калликреин и др. Такие опухоли клинически проявляются «атипичным» КС.
Обычно при попадании серотонина и других продуктов секреции в портальный кровоток они эффективно метаболизируются печенью и не вызывают системных проявлении. Поэтому возникновение КС связывают с нарушением печеночного барьера и выходом пептидов за пределы органного кровотока в системный, что чаще всего обусловлено наличием метастазов в печени либо первичным поражением бронхов или яичников. На логистической модели была показана корреляция метастазов в печени с уровнем сывороточного и связанного тромбоцитами серотонина и 5-ГИУК мочи [12].
Основными клиническими проявлениями КС являются диарея и приливы. Наличие диареи чаще всего обусловлено влиянием серотонина на секрецию и моторику ЖКТ. В частности, серотонин увеличивает секрецию жидкости в кишечнике и скорость прохождения пищевых масс, что создает предпосылки к развитию диареи. Другие гуморальные факторы, такие как гистамин, простогландины, тахикинин и др., также могут стимулировать перистальтику и секрецию кишечника и вызывать схваткообразные боли в животе и жидкий стул. Первоначально диарея при КС носит периодический характер и не является специфической. Со временем из-за хронического нарушения секреции и моторики развивается лимфангиоэктазия кишечника, происходит избыточное размножение бактериальной флоры и диарея становится постоянной, часто сопровождается приступами болей в животе, тошнотой и рвотой. Характерным для диареи при КС является отсутствие облегчения при воздержании от приема пищи.
Типичный прилив при «классическом» КС имеет внезапное начало и проявляется розовым либо красным окрашиванием кожи лица, шеи и верхней части туловища (эритематозный тип). В отличие от менопаузальных длительность карциноидного прилива обычно не превышает нескольких минут, и он не сопровождается повышенным потоотделением. Со временем у части больных приливы становятся более продолжительными, на лице сохраняется постоянный цианотический оттенок, а во время приступа нос приобретает пурпурно-красный цвет. Частота возникновения приливов варьируется от нескольких раз в сутки до одного–трех приступов за час. Причина возникновения типичных приливов скорее всего связана с воздействием тахикининов, нейропептида К, субстанции Р и калликреина, значение уровня серотонина для возникновения приливов дискутабельно. Прилив может провоцироваться употреблением алкоголя или продуктов, содержащих тиамин: бананов, орехов, шоколада [3, 12].
Атипичный прилив может длиться несколько часов и даже дней и представляет собой багровое окрашивание кожи, после которого остаются глубокие морщины и телеангиоэктазии, развивается гипертрофия кожи лица и верхней части шеи. У таких больных отмечается расширение сосудов конъюнктивы и слезотечение, кроме того, возможны акроцианоз верхних конечностей, отек кожи и зуд, головные боли, гипотония, бронхоспазм. Обычно такие симптомы наблюдаются при НЭО дыхательных путей, тимуса, пищевода, желудка, ПЖ, двенадцатиперстной кишки и обусловлены избыточной продукцией серотонина и гистамина. Атипичный КС развивается примерно у 5% больных. В редких случаях у пациентов с хроническим атрофическим гастритом и гиперплазией ЕСL-клеток (энтерохромафиноподобные клетки) развиваются атипичные гистамин-индуцированные приливы с образованием ярко-красных пятен неправильной формы, которые локализуются на лице, основании шеи и на руках.
У 15% больных КС сопровождается одышкой и в некоторых случаях бронхоспазмом. Возникновение бронхоспазма может быть опосредовано серотонином, гистамином и кининами, вызывающими сокращение гладких мышц и отек. В некоторых случаях при бронхоспазме необходимо проводить дифференциальную диагностику с приступами бронхиальной астмы. Иногда у больных КС наблюдают миопатии [5].
Одним из основных проявлений гормонально-активных опухолей является фиброэластоз эндокарда (синдром Хедингера), т.н. карциноидная болезнь сердца. Возникает у 60–80% больных, но довольно редко проявляется клинически на ранних стадиях, протекая обычно под маской других заболеваний сердечно-сосудистой системы [11, 13, 14]. Клинически проявляется приступами тахикардии, нарушением ритма, повышением артериального давления (АД), болями в области сердца в сочетании с изменениями ЭКГ метаболического и ишемического характера. Течение болезни и смертность пациентов с карциноидным поражением сердца обусловлены хронической недостаточностью кровообращения. Примерно 25% смертей от карциноидного синдрома приходится на сердечную недостаточность [3, 11].
При НЭО тонкой кишки, аппендикса, восходящего отдела ободочной кишки независимо от размера первичной опухоли часто имеются метастазы в брыжейку с развитием перитонеального фиброза. Интраабдоминальный фиброз может вызывать явления частичной или полной непроходимости тонкой, а иногда и толстой кишки, окклюзию сосудов брыжейки с развитием мезентериальной ишемии. Фиброзные тяжи забрюшинного пространства могут сдавливать мочеточники с нарушением функции почек. В редких случаях в результате фиброза развиваются карциноидная артропатия и фибропластическая индурация полового члена (болезнь Пейроне) [15].
Одним из самых опасных для жизни пациента осложнением КС является карциноидный криз. Клиническая картина криза характеризуется резкими колебаниями АД с преобладанием гипотензии, нарушением сердечного ритма, тахикардией, стридорозным дыханием, приливами и дисфункцией ЦНС (спутанность сознания, в тяжелых случаях кома). Карциноидные кризы могут возникать спонтанно или провоцироваться анестезией, диагностическими манипуляциями, приемом лекарственных средств, в т.ч. и химиопрепаратами, вызывающими лизис опухоли и выделение в кровоток биологически активных веществ [2, 11].
Часто больные с гормонально-активными опухолями до постановки диагноза наблюдаются у невропатолога либо психиатра, т.к. на первый план клинической картины выступают симптомы расстройств психики и деятельности центральной нервной системы. Пациенты могут страдать неустойчивым настроением, нарушением сна, навязчивыми состояниями, страхами, депрессией. Такие больные часто склонны к плаксивости, раздражительности, повышенной мнительности, зацикленности на симптомах болезни. При детальном сборе анамнеза можно выяснить, что начало заболевания многие связывают с перенесенным стрессом, который для них явился своеобразным «пусковым механизмом» прогрессивного развития патологической симптоматики, хотя отдельные нарушения поведенческих реакций существовали на протяжении ряда лет и воспринимались как особенности характера.
Лечение пациентов с НЭО зависит от многих факторов и предполагает комплексный подход. Для устранения гиперпродукции гормонов и истощающих симптомов заболевания выполняются циторедуктивные операции по удалению первичного очага с резекцией печени и резектабельных внепеченочных очагов. Допускается неполное удаление очагов с целью уменьшения опухолевой массы и облегчения гормональных симптомов [16]. С той же целью применяются радиочастотная аблация и химиоэмболизация [17]. Однако у большинства пациентов на момент установления диагноза имеются проявления метастатической болезни, осложненной симптомокомплексом КС и других синдромов, которые представляют реальную угрозу для жизни больного. Оказание хирургического пособия таким пациентам затруднено, и предпочтение отдается биологической терапии аналогами СС.
Предпосылкой для использования аналогов СС в лечении НЭО стало описание ингибирующего влияния СС на функцию нейроэндокринных и эпителиальных клеток. Нативный СС представляет собой циклический полипептид, способный подавлять продукцию глюкагона, гастрина, серотонина, инсулина, секретина, холецистокинина и ВИП [18, 19]. Биологический эффект СС реализуется через специфические рецепторы, имеющие пять подтипов (SSTR1–SSTR5), которые экспрессируются в различных органах и тканях, а также в большинстве НЭО [20]. Было доказано, что аналоги СС подавляют выделение большинства пептидов в кишечнике, ПЖ и гипофизе, оказывают влияние на фактор роста опухолей, а при использовании в определенных дозах могут вызывать апоптоз.
Аналоги СС уже более четверти века применяются в качестве препаратов первой линии антисекреторной терапии для контроля истощающих симптомов НЭО. Благодаря их широкому применению в клинической практике удалось существенно повлиять на течение болезни и выйти на плато хорошего качества жизни больных. Клиницисты получили возможность купировать либо контролировать проявления КС, что существенно снизило риск нежелательных явлений и привело практически к отсутствию такого тяжелого осложнения, как карциноидный криз.
Клинические эффекты аналогов СС: значительное снижение выделения с мочой продукта распада серотонина – 5-ГИУК, полное исчезновение приливов – у 60% пациентов, уменьшение частоты приливов или их тяжести – у 80%, купирование диареи – у 30%, снижение частоты эпизодов диареи – у 70%.
Сохранение хорошего качества жизни отмечают около 90% пациентов.
Длительное и систематическое применение аналогов СС обеспечивает пациентам с метастатическими формами болезни значимое увеличение продолжительности жизни больных. Так, по данным американского ракового регистра, медиана выживаемости больных НЭО ранее составляла 18 месяцев, а внедрение в практику аналогов СС привело к увеличению медианы их выживаемости до 39 месяцев [21–23].
Можно с уверенностью сказать, что аналоги СС открыли эру таргетной противоопухолевой терапии в лечении НЭО. Их антипролиферативная активность была доказана в мультицентровых рандомизированных исследованиях РROMID и CLARINET, которые продемонстрировали достоверное увеличение времени до прогрессирования у больных высокодифференцированными НЭО, получавших терапию аналогами СС [24, 25].
Исследованию РROMID, в котором была доказана антипролиферативная активность пролонгированной формы октреотида, было посвящено достаточно публикаций, и такие препараты, как Сандостатин-Лар, Октреотид-Депо за последние несколько лет получили широкое применение как антисекреторные и противоопухолевые агенты для лечения высокодифференцированных НЭО различных локализаций.
В 2013 г. были опубликованы первые результаты двойного слепого мультицентрового рандомизированного плацебо-контролируемого исследования III фазы CLARINET.
В исследование были включены 204 пациента со спорадическими высокодифференцированными нефункционирующими НЭО (G1, G2) ЖКТ и ПЖ (гастроэнтеропанкреатические НЭО или GEP-NETs). Пролиферативная активность всех НЭО (Кi-67) не превышала 10%. Группа НЭО G1составила 70%, НЭО G2 – 30% [26].
Исследовались нерезектабельные местнораспространенные метастатические новообразования и метастазы НЭО без выявленного первичного очага из поджелудочной железы – 42%, опухоли, происходящие из средней кишики – 33%, опухоли, происходящие из задней кишки – 11%, опухоли из невыявленного первичного очага – 15%
У 30% пациентов объем метастатического поражения печени превышал 25%. Как минимум 6 месяцев до начала исследования пациенты не должны были получать аналоги СС, интерферон-α или химиотерапию.
Целью исследования была оценка показателя выживаемости без прогрессирования (ВБП): время до прогрессирования заболевания или смерти, возникших в течение 96 недель после первой инъекции (согласно RECIST версии 1.0). Также планировался анализ ВБП в зависимости от источника опухоли, стадии и объема опухолевого поражения. Вторичная точка исследования включала пациентов без прогрессирования заболевания на 48-й и 96-й неделях. Оценивались время до прогрессирования заболевания, общая выживаемость, качество жизни, уровень хромогранина А, фармакокинетические показатели, переносимость.
Все пациенты были рандомизированы и получали препарат ланреотид (Соматулин®) Аутожель® 120 мг (n=101) или плацебо (n=103) – глубокие подкожные инъекции каждые 28 дней (максимум 24 инъекции).
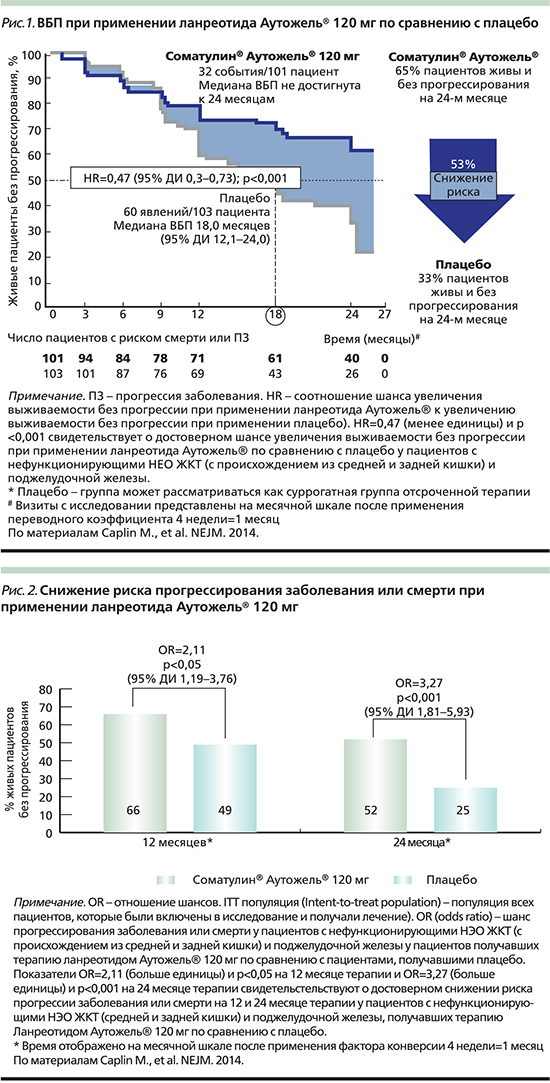
Было доказано, что ланреотид Аутожель® 120 мг значительно увеличивает медиану ВБП у пациентов с нефункционирующими НЭО ЖКТ (происходящими из средней и задней эмбриональной кишки и ПЖ; рис. 1). При этом соотношение риска прогрессирования заболевания или смерти при сравнении с плацебо составило 0,47 (р<0,001).
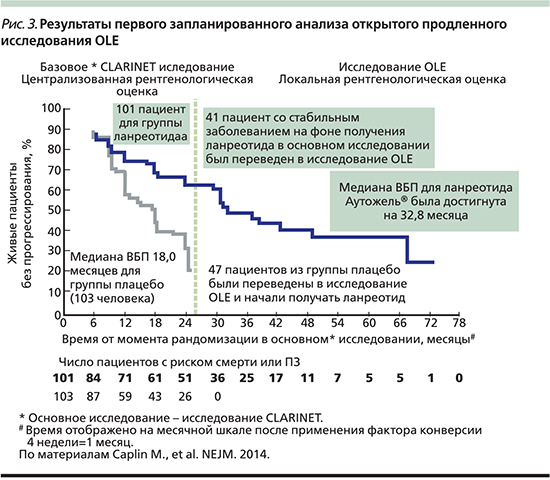
Снижение риска прогрессирования заболевания или смерти было продемонстрировано через 24 месяца лечения ланреотидом Аутожель® (52 против 25%; p<0,001), при этом достоверная разница по сравнению с плацебо наблюдалась уже на 12-м месяце исследования (66 против 49%; p<0,05; рис. 2).
Также было показано положительное влияние ланреотида Аутожель® на медиану ВБП независимо от источника опухоли, стадии опухолевого процесса и опухолевой нагрузки печени.
Результаты исследования CLARINET обеспечили доказательства в поддержку применения ланреотида® Аутожель® 120 мг для контроля гастроэнтеропанкреатических НЭО и поставили вопрос о целесообразности наблюдения при ведении пациентов с высокодифференцированными распространенными НЭО.
Для оценки долгосрочной безопасности терапии ланреотидом® Аутожель® 120 мг было предпринято открытое международное продленное исследование III фазы OLE. В продленную фазу вошли пациенты из базового исследования CLARINET. Запланировано лечение препаратом ланреотид® Аутожель® 120 мг до выхода из исследования или прекращения такового. Ожидаемая максимальная длительность исследования – 8 лет. Вторичной целью продленного исследования является оценка долгосрочной эффективности препарата.
По результатам первого запланированного анализа применение препарата ланреотид® Аутожель® 120 мг обеспечило долгосрочные преимущества в рамках ВБП. Медиана времени до прогрессирования была достигнута на 32,8-м месяце без каких-либо рисков в отношении безопасности (рис. 3). Следует напомнить, что в основном исследовании CLARINET в течение 24 месяцев терапии ланреотидом® Аутожель® 120 мг медиана ВБП не была достигнута по сравнению с плацебо (18 месяцев в группе плацебо). Таким образом, в исследовании OLE пациенты, оставшиеся живыми в основном исследовании и не имевшие признаков прогрессирования заболевания в течение 96 недель, включенные в продленное исследование и получавшие терапию только ланреотидом® Аутожель® 120 мг независимо от терапии в исследовании CLARINET, продемонстрировали достижение медианы ВБП на 32,8-м месяце.
Исследование CLARINET и продленное исследование OLE не выявили нарушений качества жизни в группе активной терапии препаратом ланреотид® Аутожель® 120 мг. В профиле безопасности было показано отсутствие летальности, связанной с терапией, и крайне малое число отказа от лечения по причине нежелательных явлений. Это доказывает положительное соотношение профиля польза/риск для ланреотида® Аутожель® 120 мг и подтверждает целесообразность применения данного препарата для ранней терапии в алгоритме лечения пациентов с гастроэнтеропанкреатическим НЭО [25].
В настоящее время пролонгированные аналоги СС являются стандартом для лечения высокодифференцированных НЭО независимо от гормональной активности опухоли [24, 25, 27].
Следует отметить, что ланреотид® (Соматулин®) Аутожель® имеет удобную лекарственную форму для глубоких подкожных введений в виде стабильного препарата, готового к использованию и находится в предварительно заполненном шприце-ручке, что облегчает выполнение инъекций медицинским персоналом. Кроме того, всегда имеется возможность безопасного выполнения введения Соматулина® Аутожель® самими пациентами или с помощью родственников, что в значительной мере положительно влияет на качество жизни больных и сокращает число визитов к врачу [28, 29].
Лечение НЭО – это многолетний, поэтапный процесс, направленный на сохранение хорошего качества жизни и продление жизни пациентов, подавляющее большинство которых являются людьми трудоспособного возраста. От осведомленности, коллегиальности и преемственности в действиях врачей различных специальностей во многом зависит своевременная диагностика НЭО, результаты их лечения и в конечном счете – продолжительность жизни больных.



