Введение
Акромегалия является тяжелым полиорганным заболеванием, негативно влияющим на качество и продолжительность жизни пациентов.
Относительно низкая распространенность акромегалии затрудняет проведение проспективных сравнительных клинических исследований, направленных на поиск наиболее рациональных способов ее диагностики и лечения. В этих условиях оптимальной медико-организационной формой является создание и поддержание национальных и региональных нозологических регистров больных акромегалией, обеспечивающих систематизацию и постоянный мониторинг эпидемиологических, демографических и клинических данных с целью определения наиболее эффективных способов выявления и лечения гормональноактивных аденом гипофиза [2].
В течение последних 10 лет в Москве благодаря коллективному участию сотрудников Эндокринологического научного центра МЗ РФ, Эндокринологического диспансера ДЗ Москвы и кафедры эндокринологии Первого МГМУ им И.М. Сеченова успешно функционирует Регистр больных акромегалией, ведущим условием для поддержания которого является корпоративное взаимодействие учреждений-участников, обеспечивающее каждому включенному в регистр пациенту стандартизированное диагностическое обследование, квалифицированное и преемственное лечение, а также динамическое наблюдение.
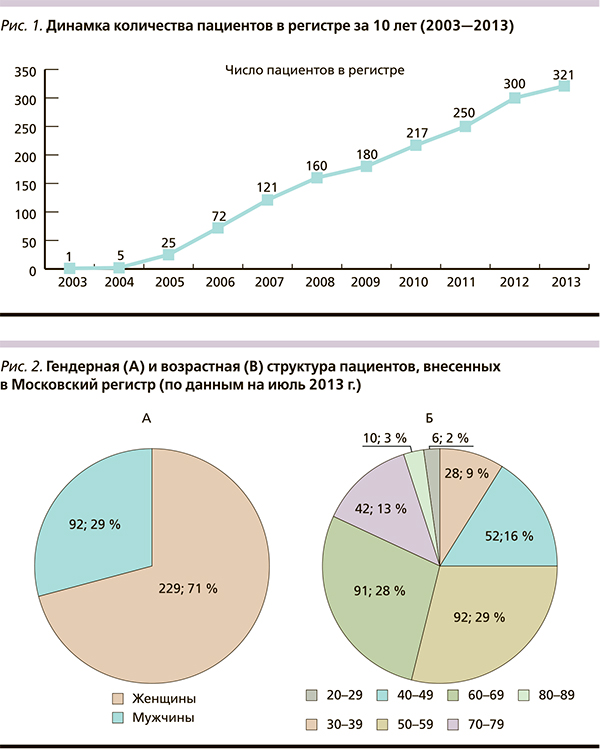
По данным на июль 2013 г. в Московском регистре насчитывается 321 пациент с акромегалией, из них 92 (29 %) мужчины и 229 (71 %) женщин. Средний возраст больных составляет 58 (от 26 до 85) лет. Обращает на себя внимание относительно молодой возраст мужчин при постановке диагноза – 48 (39–58) лет против 55 (48–65) у женщин (р = 0,0017) (рис. 1, 2). Средняя длительность латентного периода составляет 6,4 (4–8) года, длительность активной стадии: 12,9 года с разбросом от года до 48 лет. Пик дебюта заболевания приходится на 3–5-ю декады жизни – самые продуктивные для работоспособного населения. В 61 % случаев у пациентов была выявлена макроаденома гипофиза, нередко – с экстраселлярным ростом. Соотношение микро-/макроаденом составляет 1,0 : 1,6. Медикаментозное лечение аналогами соматостатина (АС) получают 202 пациента: ланреотидом (Соматулин® Аутожель®) – 55 % и октреотидом – 45 %.
Ведение Московского регистра позволяет осуществлять динамическое наблюдение и мониторинг лечения, а также оценивать эффективность различных терапевтических подходов ведения пациентов с акромегалией в долгосрочном ретроспективном периоде.
В зависимости от клинической ситуации больным рекомендуется хирургическое, медикаментозное или лучевое лечение. У пациентов, находящихся на первичной или вторичной фармакотерапии, налажен динамический контроль биохимических и инструментальных показателей: определение содержания инсулиноподобного фактора роста-1 (ИФР-1) и соматотропного гормона (СТГ) проводится 1 раз в 3–6 месяцев, магнитно-резонансная томография (МРТ) гипофиза с контрастным усилением – 1 раз в 6–12 месяцев. В электронные карты пациентов вносятся анамнестические, а также лабораторно-инструментальные данные: длительность заболевания, проводимое лечение, дата операции или лучевой терапии и др. Проведение мониторинга лечения позволяет оперативно оценивать эффективность различных оперативных и терапевтических подходов ведения пациентов в долгосрочном периоде с оперативным проведением необходимой коррекции.
В лечебной деятельности врачи руководствуются современным алгоритмом лечения акромегалии, предложенным Международным консенсусным соглашением, где в качестве средства выбора рекомендуется использовать хирургическое пособие, что позволяет достигать быстрой ремиссии заболевания. В отсутствие хирургической перспективы или нерадикальности проведенного оперативного вмешательства показано использование лекарственных препаратов, к которым относятся синтетические АС (ланреотид, октреотид), агонисты дофамина (каберголин), антагонист рецепторов гормона роста – пегвисомант, однако последний препарат в России не зарегистрирован и потому не применяется во врачебной практике.
Трудность подбора адекватной фармакотерапии обусловлена возрастными особенностями клинического течения акромегалии, а также множественностью существующих патоморфологических форм СТГ-продуцирующих аденом гипофиза с вариабельной экспрессией соматостатиновых и дофаминовых рецепторов, различной чувствительностью к лекарственному воздействию [10, 27]. На сегодняшний день АС являются наиболее эффективным средством медикаментозного контроля секреторной и пролиферативной опухолевой активности. Использование АС способствует нормализации уровней ИФР-1 и СТГ приблизительно у 55 % пациентов и уменьшению объема опухолевой ткани у 20–75 % [7, 8, 11, 15, 19]. К сожалению, положительный результат наблюдается не у всех. Важной терапевтической проблемой остается разработка лекарственных схем, позволяющих обеспечивать контроль акромегалии у больных с частичной или полной резистентностью к АС. Среди предлагаемых решений обсуждаются эскалация доз, сокращение межинъекционного интервала, взаимозамена октреотид-, ланреотид-содержащих препаратов АС, добавление к АС агонистов дофамина. Анализ этих вариантов подробно представлен в работе [1].
В данной статье авторы поделились опытом относительно рациональности смены препарата внутри группы АС при неэффективности предшествующей терапии или выраженных побочных эффектах используемого ранее препарата. В частности, речь идет о переводе пациентов с максимальных доз октреотид-содержащих препаратов (Сандостатин ЛАР, Октреотид-Депо, Октреотид-лонг) на максимальную дозировку ланреотида (Соматулин® Аутожель® 120 мг). Результаты ранее проведенных клинических исследований указывают на сопоставимую эффективность октреотид- и ланреотид-содержащих препаратов, что обусловлено их воздействием на одни и те же подтипы соматостатиновых рецепторов.
К выгодным отличиям ланреотида относятся отсутствие фармакологического носителя, бóльшая длительность действия (до 56 дней) за счет медленной диффузии препарата из подкожного депо, равномерность фармакокинетического профиля с отсутствием первоначальных пиков гиперконцентрации, возможность (при наличии показаний) увеличения межинъекционного интервала, наличие готовой лекарственной формы, малый объем вводимого вещества и подкожный способ введения. Простота инъекций позволяет вводить препарат в домашних условиях самостоятельно или с помощью близких. Все это обеспечивает стабильный лечебный эффект, повышает степень свободы и качество жизни больных [3–5, 9, 13, 14, 16, 17, 20–26, 28].
Анализ долгосрочной эффективности ланреотида у пациентов, прежде получавших октреотид, представляет как научный, так и практический интерес. С данной целью был проведен ретроспективный анализ карт пациентов из Московского регистра больных гипофизарным гигантизмом и акромегалией.
Ниже представлены результаты анализа долгосрочной эффективности ланреотида (Соматулин® Аутожель® 120 мг) у пациентов, прежде получавших октреотид-содержащие препараты. Дополнительно была исследована возможность перевода пациентов, получавших максимальные дозы октреотид-содержащих препаратов, на максимальную дозировку ланреотида (120 мг/28 дней) в комбинации с каберголином (3–3,5 мг/нед). Комбинация ланреотида и каберголина позволяет, согласно имеющимся данным, снижать затраты на лечение и достигать эффективного контроля заболевания у бóльшего числа пациентов, чем при изолированном увеличении доз АС [1, 2].
Материал и методы
Медикаментозное лечение АС получали 202 больных акромегалией. Октреотид-содержащие препараты получали 90 (45 %) больных и ланреотид (Соматулин® Аутожель®) – 112 (55 %) больных. При анализе электронных карт больных акромегалией учтены уровни ИФР-1 и СТГ, динамика размеров аденомы, по данным МРТ, наличие клинической и биохимической компенсации.
Критерии включения:
- пациенты с акромегалией любой длительности, любого возраста и пола;
- в анамнезе – перевод с октреотида (в любой дозе) на ланреотид;
- отсутствие операции или лучевой терапии в период после перевода и до момента ретроспективного анализа данных;
- возможность регулярного пополнения данных о пациенте в регистре.
Статистическая обработка результатов проведена с помощью критерия Уилкоксона с применением программы STATISTICA 6.0 (StatSoft®, 2003). Данные представлены в виде медианы и 25 %, 75 % квартилей медианы. Статистически значимыми различия считались при р < 0,05.
Результаты
По критериям включения в данный ретроспективный анализ подходили 65 пациентов (46 женщин и 19 мужчин), переведенных в 2011 г. с октреотида на ланреотид. На момент перевода медиана возраста составила 57 лет (от 30 до 83) лет, медиана продолжительности заболевания – 7 [4, 13] лет. Макроаденома была диагностирована у 38 (59 %) пациентов.
- Причины перевода пациентов на ланреотид:
- недостаточный терапевтический эффект (резистентность к проводимой терапии);
- целесообразность назначения препарата с увеличенными интервалами введения;
- необходимость проведения инъекций в домашних условиях;
- непереносимость октреотида.
С дозировки октреотида 10 мг/28 дней были переведены 4 пациента, с дозировки 20 мг/28 дней – 8, 30 мг/28 дней – 9 и с дозировки 40 мг/28 дней – 44 пациента; 34 (52 %) пациента после перевода получали ланреотид в комбинации с каберголином. Период наблюдения (от момента перевода до последнего зарегистрированного визита) составил 2,0–2,5 года.
При первичном анализе результатов долгосрочного лечения всех 65 пациентов выявлено достоверное уменьшение уровня ИФР-1 по сравнению с результатами на момент перевода (табл. 1). При этом 12 пациентами достигнута стойкая нормализация уровня ИФР-1.
У 12 (19 %) пациентов, по данным МРТ, наблюдалось уменьшение объема опухоли гипофиза, а у 3 – нормализация изначально повышенного уровня ИФР-1 + уменьшение аденомы. У двух пациентов на момент последнего визита произошла декомпенсация.
При дальнейшем анализе результатов лечения в двух подгруппах: монотерапии ланреотидом (Соматулин® Аутожель®) и комбинированной медикаментозной терапии (Соматулин® Аутожель® + каберголин), выявлено, что более выраженное улучшение биохимических показателей наблюдалось в подгруппе, где использовано комбинированное лечение (табл. 2, 3).
В подгруппе монотерапии в период после перевода пациентов на Соматулин® Аутожель® дальнейшее уменьшение размера аденомы, по данным МРТ, наблюдалось у 6 (19 %) из 31 пациента. У 7 пациентов данной подгруппы после переключения на ланреотид наблюдалась клинико-биохимическая компенсация, в т. ч. нормализация уровня ИФР-1, у 2 – произошла декомпенсация по биохимическим показателям (табл. 2).
В подгруппе пациентов на комбинированной терапии после перевода на ланреотид уменьшение размера аденомы, по данным МРТ, наблюдалось у 6 (18 %) из 34 пациентов, клинико-биохимическая компенсация наступила у 5 пациентов (табл. 3).
У одной пациентки с непереносимостью октреотида наблюдалась хорошая переносимость ланреотида с положительным клиническим и биохимическим ответом.
Обсуждение
Проведенный анализ электронных карт 65 пациентов из Московского регистра больных акромегалией показал, что у ряда пациентов перевод с октреотида на ланреотид (Соматулин® Аутожель®) повысил эффективность долгосрочной терапии, что проявилось в нормализации биохимических показателей (у 12 из 50 изначально декомпенсированных пациентов) и умеренном уменьшении размеров аденомы гипофиза (у 19 % пациентов). При этом бóльшее улучшение показателей наблюдалось в подгруппе комбинированной терапии.
Согласно современным рекомендациям, АС показаны пациентам с акромегалией:
- при неэффективности или недостаточной эффективности оперативного лечения (класс рекомендации А, уровень доказательности 2);
- при макроаденоме, отсутствии интракраниальной компрессии и низкой вероятности эффективности оперативного вмешательства (класс рекомендации В, уровень доказательности 3);
- в качестве предоперационной подготовки для улучшения соматического статуса и уменьшения периоперационных осложнений (класс рекомендации В, уровень доказательности 2);
- при противопоказаниях к операции или если ее проведение отложено (класс рекомендации С, уровень доказательности 4);
- после лучевой терапии в период до наступления максимального эффекта (класс рекомендации А).
Эффективность терапии АС рекомендовано оценивать не ранее чем через 6 месяцев от начала терапии [12, 18].
По заключению Американской ассоциации клинических эндокринологов (ААКЭ) , октреотид и ланреотид обладают сопоставимым профилем эффективности и безопасности (класс рекомендации В, уровень доказательности 2) [15]. В то же время во многих исследованиях показано, что у пациентов с непереносимостью одного из АС возможно эффективное и безопасное применение другого препарата данного класса [4, 24].
Одной из причин перевода пациентов может быть целесообразность проведения инъекций с увеличенным интервалом. Благодаря особенностям фармакокинетики примерно для 50 % пациентов, отвечающих на терапию октреотид-содержащими препаратами, возможно применение ланреотида (Соматулин® Аутожель® 120 мг) с интервалами 42 или 56 дней [24]. Следует отметить, что введение препарата Соматулина Аутожель® в дозе 120 мг с интервалами 28, 42 и 56 дней соответствует введению октреотида-ЛАР в дозе 30, 20 и 10 мг соответственно (каждые 28 дней независимо от дозы). В нашей группе наблюдения было 10 пациентов, которым за счет перевода на ланреотид (Соматулин® Аутожель® 120 мг) удалось увеличить интервалы между введением препарата до 42 или 56 дней без потери эффективности.
Нередки ситуации, когда больные в силу тяжести соматического статуса (или при необходимости выезда в другой регион) не в состоянии строго в определенное время посещать лечебное учреждение для проведения очередной инъекции, что чревато нежелательными перерывами в лечении.
В этом случае решением остается проведение инъекций в домашних условиях самими пациентами или их близкими, что, как показали специальные исследования, не снижает эффективности терапии [6]. В Московском регистре также были пациенты, желающие проводить инъекции в домашних условиях самостоятельно или с помощью родственников. В связи с этим они были переведены на ланреотид (Соматулин® Аутожель®)с хорошим терапевтическим эффектом.
Следует отметить, что, несмотря на то что большинство наших пациентов находились на максимальной дозе октреотид-содержащих препаратов (40 мг/28 дней), у части из них после перевода на ланреотид эффективность терапии повысилась. В случае отсутствия медикаментозной компенсации на монотерапии АС показано использование комбинированной терапии (ланреотид + каберголин), что подтверждено результатами нашего исследования и согласуется с общемировой практикой [15].
Таким образом, перевод больных с октреотид-содержащих препаратов на ланреотид (Соматулин® Аутожель® 120 мг) при сохранении лечебного эффекта позволяет существенно упрощать режим инъекций, повышать степень свободы пациента и сокращать затраты на лечение. Частично резистентным к АС больным комбинация ланреотида с каберголином позволяет снижать затраты на лечение и достигать эффективного контроля заболевания у бóльшего числа пациентов, чем при изолированном увеличении дозы АС.



