За последние годы появились новые данные, позволяющие утверждать, что питание в младенчестве существенным образом влияет на риск развития хронических неинфекционных заболеваний у взрослых. Появилось новое направление исследований – DOHAD (Младенческие истоки здоровья и болезней человека), которое изучает влияние факторов внешней среды, прежде всего питания на ранних этапах развития, на состояние здоровья во взрослом возрасте [1]. Период внутриутробного и раннего постнатального развития считается критическим и характеризуется максимальной пластичностью всех звеньев метаболизма, адаптирующегося к определенным условиям внешней среды. Так, недостаточное питание плода «программирует» «экономный» фенотип, склонный к задержке и накоплению энергетических запасов [2].
Избыточное питание беременной женщины, ожирение, гестационный диабет сопровождаются ростом числа случаев макросомии плода и новорожденного и ранним развитием избыточной массы тела (в первые полгода жизни) у младенца [3–5].
В постнатальном периоде сохраняется высокая пластичность генома и избыточное постнатальное питание (повышение уровня белка, калорий) служит независимым фактором, программирующим риск развития сердечно-сосудистых заболеваний, ожирения и метаболического синдрома.
Четким показателем избыточного питания является скорость роста ребенка, особенно в первые месяцы жизни. Многие исследователи считают, что скорость роста в младенчестве может прогнозировать ожирение в дальнейшей жизни. J. Baird и cоавт. в 2005 г. провели системный анализ 10 исследований, в которых оценивали динамику роста ребенка в отношении последующего ожирения. Относительный риск ожирения варьировался от 1,17 до 5,70 у детей с максимально высокой скоростью роста на первом году жизни [6].
Анализ характера роста детей во Франции показал, что прибавка массы тела в возрасте от 3 до 6 месяцев жизни являлась прогностическим фактором увеличения жировой массы тела в подростковом возрасте [7]. Долговременное исследование в Швеции показало, что скорость роста в возрасте от рождения до 6 месяцев жизни служила прогностическим фактором не только для ожирения, но и для метаболического синдрома [8]. Дети с наибольшей прибавкой массы тела в первые 6 месяцев жизни в возрасте 17 лет достоверно чаще имели больший объем висцерального жира, более высокое артериальное давление, более высокий уровень триглицеридов в крови и имели признаки резистентности к инсулину. Анализ факторов, увеличивающих скорость роста, проведенный М. Rоlland-Cachera, показал корреляцию скорости роста в младенчестве с уровнем потребления белка: дети с наибольшим уровнем белка в рационе имели наибольшую скорость роста и наибольший индекс массы тела (ИМТ) в возрасте 8 лет [9].
Искусственные смеси, содержащие более высокий уровень белка по сравнению с грудным молоком, достоверно увеличивают скорость роста в младенчестве и таким образом увеличивают риск развития ожирения. Предполагают, что высокий уровень белка в рационе младенца приводит к увеличению концентрации инсулиногенных аминокислот (рис. 1) в плазме крови, которые стимулируют продукцию инсулина (рис. 2)
и инсулиноподобного фактора роста (ИФР-1) [10] (рис. 3). ИФР-1 играет центральную роль в процессах регуляции роста в младенчестве. Этот факт подтверждается результатами многих исследований, в которых показана достоверная корреляция ИФР-1 с параметрами роста ребенка грудного и раннего возраста. По мнению ученых, именно ИФР-1 служит своеобразным медиатором, реализующим влияние белка на рост ребенка [11]. В соответствии с современными данными механизм влияния повышенной белковой нагрузки на риск развития ожирения, по-видимому, реализуется по следующей схеме: повышенное потребление белка в грудном и раннем возрасте сопровождается повышением уровня инсулиногенных аминокислот в плазме крови. Эти аминокислоты стимулирую повышенную продукцию инсулина и ИФР-1. Повышение уровня ИФР-1 увеличивает активность дифференциации и пролиферации адипоцитов, что формирует риск развития ожирения. Согласно данным M. Skilton (2013), в случае высокой скорости роста в младенчестве наблюдаются и изменения со стороны сосудов и сердца. В частности, высокая скорость роста в первые 18 месяцев помимо повышения ИМТ вызывает нарушения состояния эндотелия сосудов и повышение уровня систолического артериального давления у детей в 8-летнем возрасте [12].

Снижение уровня белка в детской смеси до 12 г/л является возможным выходом для создания продукта, уменьшающего скорость роста ребенка и снижающего риск развития ожирения. К сожалению, простое снижение уровня белка в смеси оказалось сложной технологической задачей, связанной с невозможностью обеспечить адекватный уровень всех эссенциальных аминокислот, прежде всего триптофана, при снижении уровня белка.
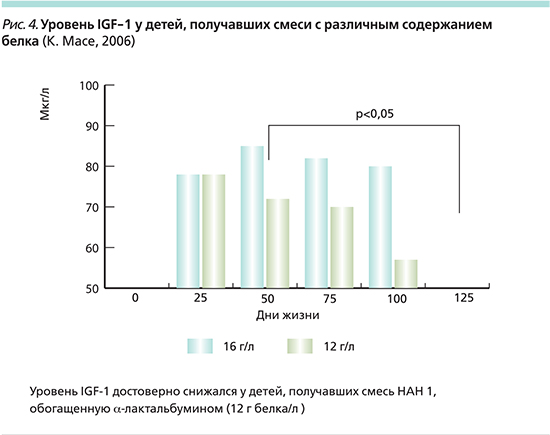
Многоцентровое исследование группы европейских ученых, проведенное в 5 европейских странах, показало, что снижение уровня белка в детской смеси до 12 г/л достоверно снижает концентрацию инсулиногенных аминокислот в плазме крови у детей, а также снижает продукцию ИФР-1 и инсулина (рис. 4). Использование смеси со сниженным уровнем белка позволило уменьшить число детей с избыточной массой тела и ожирением к 7-летнему возрасту [13, 14].
Кишечная микробиота, иммунитет и метаболизм
Другим фактором, влияющим на метаболизм и иммунную функцию, служит кишечная микробиота (КМ). За последние годы внимание исследователей направлено на изучение роли КМ в сохранении здоровья человека. Этот интерес связан с развитием новых технологий изучения микробиома человека, разработкой новых методов определения бактерий (рибосомальная ДНК, РНК бактерий, флуоресцентная гибридизация и др.), а также с появлением новых данных о влиянии КМ на риск развития аллергии, ожирения, диабета, сердечно-сосудистых заболеваний и ряда других «болезней цивилизации» [15–18].
Становление иммунной системы (приобретенного иммунитета) начинается с рождения и тесно связано с колонизацией организма новорожденного ребенка. Здоровая КМ поддерживает адекватное состояние врожденного иммунитета и способствует развитию приобретенного иммунитета [16]. Нарушения КМ у грудного ребенка чаще всего связаны с антибиотикотерапией и/или кесаревым сечением. Экспериментальные исследования влияния антибиотикотерапии в раннем постнатальном периоде показали увеличение уровня жировой массы, снижение плотности костной ткани и изменение экспрессии генов, ответственных за липидный и углеводный обмены [19]. Данные современных исследований говорят о том, что кесарево сечение (КС) является самым сильным фактором нарушения КМ у младенца и увеличивает риск развития ряда заболеваний, в основе которых лежит нарушение иммунных функций и развитие процессов хронического воспаления [20].
КМ новорожденных детей при вагинальных родах наиболее близка к вагинальной микробиоте матери с доминированием Lactobacillus, Prevotella, Atopobium, в то время как при КС микробиота близка к кожной микробиоте с доминированием стафилококков. Выявлено, что при КС в КМ младенцев обнаружено 64–82% метициллин-резистентных штаммов Staphylococcus aureus [21]. Изменения в составе КМ у детей в возрасте 4 месяцев, перенесших КС, выявлены в одной из последних работ, изучающих эту проблему.
Нарушения состава КМ у детей, рожденных с помощью КС, не нормализуются до достижения ребенком 1 года жизни. Более того, у детей, рожденных с помощью КС, сохраняется сниженное соотношение анаэробных бактерий к факультативным в возрасте 1 года, что может рассматриваться как слабое развитие анаэробной микрофлоры, не способной подавить рост факультативных бактерий. Дети, рожденные с помощью КС, демонстрируют повышенное содержание энтеробактерий, таких как Klebsiella, Enterobacter, при сниженной колонизации Escherichia coli. В кишечнике младенцев, рожденных путем КС, чаще присутствуют клостридии, включая Clostridium perfringens и Clostridium difficile [22].
Появились данные, согласно которым КС нарушает не только характер, но и разнообразие КМ у детей. По данным G. Biasucci (2008), исследование КМ у новорожденных в возрасте трех дней показало отсутствие бифидобактерий в образцах стула, в то время как у детей, родившихся вагинальными родами, доминировали Bifidobacterium longum и Bifidobacterium catenulatum, при этом число штаммов бактерий было меньше у детей с КС [23]. Известно, что снижение разнообразия КМ служит сильным фактором риска развития атопии у детей. По данным E. Forno (2008), снижение числа штаммов и разнообразия КМ у младенцев в возрасте 1 месяца являлось фактором развития атопии на протяжении первого года жизни [24]. Авторы показали, что у детей с низким разнообразием КМ достоверно чаще развивались признаки атопии по сравнению с детьми, имевшими более высокий индекс разнообразия (Shannon index)
Функциональные нарушения пищеварительного тракта и КМ
Большой интерес у педиатров вызывают данные о возможном влиянии нарушения КМ на распространенность функциональных расстройств пищеварения (колики, срыгивания, запоры) у детей грудного возраста. Функциональные расстройства органов пищеварения представляют собой сочетание гастроинтестинальных симптомов без структурных изменений. Нарушения деятельности пищеварительного тракта связаны с развитием основных гастроэнтерологических заболеваний, а сформировавшиеся функциональные отклонения часто определяют тяжесть и неблагоприятный прогноз соматических болезней.
На стадиях формирования функциональных отклонений наблюдается воздействие ряда факторов, среди которых выделяют особенности влияния моторного миграционного комплекса, на активность которого существенную роль оказывает микробно-тканевой комплекс кишечника, в результате воздействия формируется метаболический круг, реализующийся в функциональных нарушениях [30]. Эти звенья функциональных нарушений включают влияние диетических факторов, изменение КМ, нейроэндокринные и митохондриальные дисфункции [31].
У 60% детей раннего возраста описываются различные функциональные нарушения: в т.ч. срыгивание – 25%, младенческие кишечные колики (МКК) – 20%, запоры – 18%, рвота – 6%, диарея – 4%. Примерно у двух третей этих групп отмечается частая смена детских адаптированных смесей и использование неадаптированных смесей.
При формировании функциональных расстройств у детей раннего возраста отмечаются отрицательные эффекты их влияния на показатели здоровья взрослого человека.
При гастроэзофагеальном рефлюксе (ГЭР), особенно когда появляются клинико-морфологические признаки гастроэзофагеальной рефлюксной болезни, доминируют длительный болевой синдром (особенно в промежутках между едой), отрыжка, срыгивание, рвота, появляются внепищеводные проявления. Изменения со стороны бронхо-легочной системы характеризуются бронхо-, ларингоспазмом, рецидивирующим крупом. У этих больных часто наблюдается патология органов уха, горла, носа (повторные отиты, боли в ухе, фарингиты, ларингомаляция).
У больных этой группы формируется кардиальный синдром, возникают рецидивирующие боли в сердце, брадикардия, аритмия. Имеются работы, указывающие на значительное ухудшение качества жизни, связанное со здоровьем больных этой группы, сопоставимое с качеством жизни при сахарном диабете, хронической сердечной недостаточности, депрессии, что влияет на различные аспекты жизни.
По данным St. James-Roberts (2012), частота возникновения колик (в соответствии с критериями Wessel) наблюдается почти в 30% случаев у детей первых трех месяцев жизни [27].
В педиатрической литературе обсуждаются разные механизмы и причины развития колик у детей, однако единого объяснения и решения этой проблемы пока не найдено. Одним из этиологических факторов развития колик у детей считается нарушение состава и разнообразия КМ в младенчестве. В 1990-х гг. проведен ряд работ по изучению состава КМ у детей с коликами, однако используемые в те времена методики (посевы) не позволяли выявлять возможные нарушения.
В одной из последних работ этого направления проведен анализ бактериальных ДНК у детей с коликами и здоровых детей первых месяцев жизни [28]. Исследование продемонстрировало более низкое разнообразие КМ в первую неделю жизни у детей с коликами по сравнению с контрольной группой. Далее показано более высокое содержание протеобактерий, причем была выявлена положительная корреляция частоты развития колик с доминированием отдельных групп протеобактерий, включая Escherichia, Klebsiella, Serrata, Yersinia, Pseudomonas, но отрицательная корреляция с бактериями семейств Bacteroidetes и Firmicutes.
За последние годы последствия МКК описаны в определенном количестве работ. В более старшем возрасте в этой группе лиц отмечаются частые психосоматические жалобы, больше негативных эмоций по шкале темперамента, изменение сна, особенности его фаз. В возрасте 8–10 лет дети, страдающие МКК, имеют признаки гиперактивности, нарушение поведения, питания и аппетита, изменение сна. Длительность сна, чередование ритма сна и бодрствования, фазы сна определяются многими факторами: деятельностью ряда структур головного мозга, гормонами, продуцируемыми гипоталамусом, рядом нейротрансмиттеров и пищевых компонентов, получивших название «хрононутриенты». У детей, имевших проблемы сна, описаны синдром дефицита внимания, гиперактивность, импульсивность, агрессивность поведенческих реакций, снижение когнитивных функций [31, 32]. После МКК в старшем возрасте и у взрослых наблюдается рецидивирующий абдоминальный болевой синдром и более чем у 60% пациентов формируется синдром раздраженного кишечника.
С учетом влияния микрофлоры на формирование МКК в комплексное лечение включают Lactobacillus reuteri (LR) с целью купирования основных клинических проявлений. Доказан антиноцицептивный эффект бактерии LR, связанный с индукцией экспрессии опиоидных и каннабиноидных рецепторов 2 в клетках кишечного эпителия, опосредующих анальгезирующие эффекты, модулируя и восстанавливая нормальную перцепцию висцеральной боли. При этом значительно уменьшается продолжительность и частота колик и других функциональных нарушений (срыгивания, запоры), восстанавливается ритм сна.
Продуцируемый LR реутерин активен в отношении патогенной флоры, в результате LR имеет более выраженные ингибирующие свойства по сравнению с другими пробиотическими штаммами. LR, ингибируя свойства условно-патогенных бактерий, грибов и антибиотикоассоциированных штаммов, подавляет образование провоспалительных цитокинов, фактора некроза опухоли α, интерликина-8 и изменяет перенос транскрипционного фактора. Указанные действия восстанавливают состав микробиоты и приводят к уменьшению воспалительной реакции в кишечнике.
Дефицит цинка
Разнообразие нарушений здоровья у взрослых описано при дефиците цинка, который формировался при беременности и в раннем возрасте [33].
Цинк необходим для функционирования более 200 ферментов, в первую очередь тех, которые участвуют в делении и пролиферации клеток. Снижение уровня цинка оказывает влияние на эмбриогенез, рост и дифференциацию клеток. У детей могут отмечаться аномалии развития мозга, сердца, легких, мочеполовой системы. В постнатальный период проявлением дефицита цинка являются сниженные ростовые показатели, наблюдаемые в старшем возрасте и у взрослых. Уменьшение линейного роста связывают с формированием d-димера гормона роста, который более активно подвергается деградации, а также низким уровнем ИФР-1.
Цинк связан с деятельностью всех звеньев формирования иммунного ответа. Дефицит этого микроэлемента сопровождается значительными проявлениями грибковой инфекции, вирусных и бактериальных заболеваний (рецидивирующая пиодермия, паронихии, конъюнктивиты, блефариты), атопических реакций, алопецией.
Значительно участие цинка в нейрогенезе и функционировании центральной нервной системы. Дефицит цинка может проявляться у детей старшего возраста и у взрослых снижением моторных, когнитивных функций, особенностями поведения.
У мужчин и женщин отмечается бесплодие, у беременных женщин, имеющих значительное снижение уровня цинка, формируется невынашивание беременности, наблюдаются внутриутробная задержка развития плода, преждевременные роды.
Доказаны последствия дефицита цинка в развитии соматических заболеваний. Имеются работы о роли дефицита цинка и селена в формировании желчнокаменной болезни [34]. Выраженное уменьшение содержания цинка в желчи характерно для холестеринового и билирубинового литеаза.
Сниженный уровень цинка в крови, желчи может нарушать стабильность ДНК и РНК клеток, способствовать развитию дистрофических процессов в покровном эпителии стенки желчного пузыря, формируя хроническое воспаление.
Таким образом, полученные данные о роли отдельных пищевых компонентов в раннем детском возрасте вносят важный вклад в понимание формирования здоровья детей старшего возраста и взрослых, позволяют целенаправленно обосновывать лечебно-профилактические программы.


