Акромегалия является тяжелым нейроэндокринным заболеванием, в основе патогенеза которого лежит хроническая гиперпродукция соматотропного гормона (СТГ) у лиц с завершенным физиологическим ростом. Акромегалия проявляется патологическим диспропорциональным периостальным ростом костно-суставного аппарата, мягких тканей, внутренних органов, а также нарушением функционального состояния сердечно-сосудистой, легочной систем, различных видов метаболизма, периферических эндокринных желез. Причиной заболевания в подавляющем большинстве случаев является гормонально-активная опухоль гипофиза (соматотропинома). В отсутствие своевременного и адекватного лечения прогрессирование заболевания приводит к стойкой инвалидизации и повышенной смертности [1–6].
С учетом тяжести заболевания всем пациентам с верифицированным диагнозом акромегалии даже в случаях ее мягкого проявления необходимо назначать максимально раннее и активное (по международной терминологии – “агрессивное”) лечение. Главными целями терапии являются достижение полной и стойкой ремиссии заболевания, контроль над размерами опухоли гипофиза. Важные условия адекватного лечения – максимальные безопасность и комфортность для пациента. Конечным итогом проводимого лечения становится оптимизация качества жизни больного [7–10].
Введение в практику в 2000 г. строгих международных критериев ремиссии заболевания [11] показало, что задача радикального лечения акромегалии до сих пор полностью не решена. Оперативное вмешательство (транссфеноидальная аденомэктомия) позволяет достичь полной ремиссии заболевания лишь в случае удаления эндоселлярных микро- и макроаденом. В случаях же экстраселлярного распространения опухоли, частота которого достигает 88 %, вероятность полной ремиссии уменьшается от 50 до 0 % [12, 13]. В частности, по данным ФГУ ЭНЦ, из 204 больных акромегалией, подвергнутых трассфеноидальной аденомэктомии, ремиссия в целом отмечена всего в 52 % случаев при удалении макроаденом. При исходном экстраселлярном (особенно латероселлярном с охватом сифонов внутренних сонных артерий) их распространении частота ремиссии снижается до 6 %.
К сожалению, лучевые методы лечения также не в состоянии обеспечить пациентам адекватный гормональный контроль. Даже такой современный вид лучевой терапии, как стереотаксическая радиохирургия (техника линейного ускорения, гамма- и киберг-нож), способен вызывать нормализацию уровня ИФР-1 – главного маркера активности заболевания, лишь у 37 % больных. Причем данный результат достигается в сроки от 5 до 98 месяцев от момента проведения облучения и в 28 % случаев сопровождается развитием гипопитуитаризма [14, 15].
В связи с необходимостью проведения дополнительной терапии с целью достижения полной ремиссии заболевания после хирургического и/или лучевого лечения, а также наличием немалого числа больных, у которых проведение данных видов лечения невозможно ввиду наличия абсолютных либо относительных противопоказаний, все большее значение приобретает медикаментозная терапия акромегалии. Исследования последних лет направлены на разработку патогенетической медикаментозной терапии, определение показаний к применению последней в качестве средства первичной терапии.
В настоящее время препаратами первой линии в лечении акромегалии являются длительно действующие аналоги соматостатина, первое место среди которых занимает октреотид (Сандостатин Лар, Новартис Фарма). Препарат, произведенный в 1994 г., представляет собой лекарство, в котором активное вещество октреотид помещен в микросферы из поли-DL-лактид-когликолид-глюкозного полимера. Высвобождение лекарственного вещества сначала с поверхности микросфер, а затем из их глубины обеспечивает быструю и стабильную концентрацию препарата в крови.
В настоящее время за рубежом накоплен достаточный опыт по лечению больных акромегалией данным препаратом с позиций его эффективности и безопасности [16–25]. Впервые в России на базе ГУ ФГУ ЭНЦ совместно с Эндокринологическим диспансером Москвы получены результаты терапии Сандостатином Лар у 163 больных акромегалией с длительностью лечения до 5 лет.
Материал и методы
Эффективность терапии Сандостатином Лар была оценена у 163 больных акромегалией (у 79 пациентов – в качестве дополнительной терапии после неудачного хирургического вмешательства, у 84 – первичной).
Клиническая характеристика пациентов, получивших терапию Сандостатином Лар:
- всего – 163 больных (97 – из городского Эндокринологического диспансера, 66 – из ФГУ ЭНЦ);
- 116 (71,2 %) женщин и 47 (28,8 %) мужчин;
- возраст – 20–79 лет (медиана – 52 года, 25-й процентиль – 42 года, 75-й – 62 года);
- микроаденома – 46 (28,2 %) человек;
- макроаденома – 117 (71,8 %) человек, из них у 78 – с экстраселлярным распространением.
Показаниями к назначению Сандостатина Лар в качестве первиной терапии являлись: наличие относительных либо абсолютных противопоказаний к оперативному вмешательству (аденомэктомии), особенности распространения аденомы гипофиза, не позволяющие провести радикальную операцию, а также отказ больного от операции. Главным условием для применения первичной терапии являлось отсутствие хиазмального синдрома. Исходная доза препарата у 154 (94,5 %) человек составила 20 мг внутримышечно 1 раз в 28 дней, у 7 (4,3 %) – 30 мг, у 2 (1,2 %) – 40 мг, а к концу исследования: 10 мг – у 8 (4,9 %) человек, 20 мг – у 80 (49 %), 30 мг – у 59 (36,2 %), 40 мг – у 16 (9,8 %). Показанием к увеличению дозы препарата являлось отсутствие достижения “безопасного” уровня СТГ [26] и показателя ИФР-1, соответствующего норме для данного пола и возраста. Длительность терапии составила от 3 до 61 месяца, медиана – 18,4 месяца, 25-й процентиль – 10 месяцев, 75-й – 25 месяцев. Гормональный контроль проводили через 3, 9, 12, 24, 28 месяцев, МРТ-контроль размеров аденомы гипофиза – через 3, 6, 12, 24 месяца.
Результаты
К моменту начала терапии все пациенты находились в активной стадии заболевания: исходный уровень СТГ колебался от 1,1 до 429,0 мЕД/л [Me – 15,7 (6,6–33,5)], уровень ИФР-1 (представлен как % от нормы ввиду большого разброса величины) составлял 49,7–793,2 [Me – 203,9 (142,9–266,9)]. В случае нормального базального уровня СТГ активную стадию акромегалии подтверждали по отсутствию снижения уровня СТГ ниже 2,7 мЕД/л в ходеперорального глюкозотолерантного теста.
У 156 (93,3 %) больных на фоне терапии Сандостатином Лар отмечена положительная динамика уровней СТГ и/или ИФР-1. Клинически значимое (≥ 30 %) снижение уровня СТГ выявлено у 102 (62,6 %) человек, снижение уровня ИФР-1 – у 103 (63,2 %) пациентов, одновременно обоих показателей – у 73 (44,8 %). Показателем эффективности препарата явилось достижение “безопасного” уровня СТГ и нормального уровня ИФР-1 у 95 (58,3 %) и 90 (55,2 %) пациентов соответственно, а также число больных, достигших полной ремиссии заболевания, – 70 (43 %) человек.
Сходные результаты эффективности Сандостатина Лар получены в группах первичной и дополнительной терапии. Так, полная ремиссия заболевания достигнута у 38 (46,4 %) человек в группе первичной терапии и у 32 (43 %) больных в группе дополнительной терапии, что коррелирует с показателями медиан уровней СТГ и ИФР-1 к концу 28-го месяца терапии (табл. 1 и 2).
Таблица 1. Динамика уровня СТГ на фоне лечения в группе первичной (I) и дополнительной (II) терапии.
Таблица 2. Динамика уровней ИФР-1 на фоне лечения в группе первичной (I) и дополнительной (II) терапии.
Выявлена зависимость частоты ремиссии заболевания от размера аденомы и возраста больных. Полная ремиссия заболевания выявлена у 47 (40 %) из 117 больных с макроаденомами и у 23 (50 %) из 46 пациентов с микроаденомами, большая частота ремиссии наблюдалась у пациентов старше 35 лет по сравнению с более молодым контингентом: у 62 (44,3 %) из 140 и у 8 (34,8 %) из 23 человек соответственно.
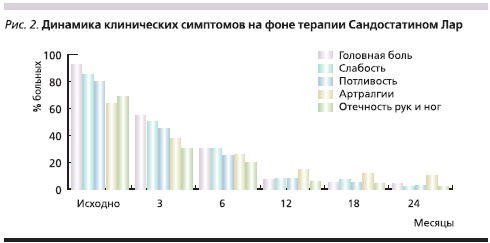
По мере увеличения продолжительности лечения отмечено прогрессирующее снижение уровня ИФР-1 (представлено в виде медианы; рис. 1), что в свою очередь сопровождалось выраженной положительной динамикой основных клинических симптомов заболевания (рис. 2).

Положительная динамика размера аденомы гипофиза зафиксирована у 48,3 % (29/60) больных. Степень уменьшения объема опухоли составила от 13 до 73 % исходного. При этом через 3 месяца терапии уменьшение размеров аденомы произошло лишь у одного пациента, через 6 месяцев – у 19, через 12 – у 20 и через 24 месяца – у 29. Ни у одного больного отрицательная динамика объема опухоли гипофиза не зарегистрирована.
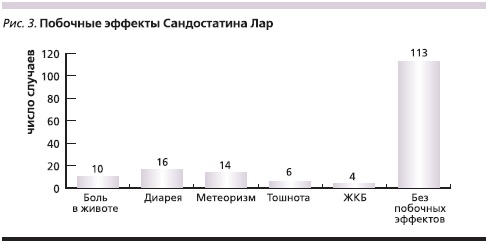
Терапию данным препаратом пациенты переносили удовлетворительно, частота побочных эффектов составила 30,7 % (рис. 3). Как правило, побочные эффекты возникали однократно. Лишь у 6 пациентов имелась периодичность появления диареи и метеоризма, у четырех больных – после первых трех инъекций. У четырех больных отмечено появление камней в желчном пузыре, что не потребовало оперативного вмешательства или отмены препарата.
Выводы
1. Длительная терапия препаратом Сандостатин Лар является безопасным и эффективным средством консервативного лечения акромегалии.
2. Применение Сандостатина Лар в качестве первичной терапии акромегалии как самостоятельного метода лечения допустимо в следующих случаях:
- в отсутствие риска зрительных нарушений, вызванных аденомой;
- при наличии абсолютных противопоказаний к хирургическому лечению;
- в случае ожидаемого неудовлетворительного исхода операции (наличие выраженного латероселлярного роста аденомы);
- при категорическом отказе от операции.
3. Длительная терапия Сандостатином Лар позволяет осуществлять контроль объема опухоли гипофиза практически у 100 % пациентов.
Информация об авторах:
Молитвословова Наталья Николаевна – ведущий научный сотрудник
отделения нейроэндокринологии ФГУ ЭНЦ.
Тел. 8 (499) 124-43-02;
Алексеева Татьяна Марковна – заведующая отделением эндокринологии Московского
городского эндокринологического диспансера.
Тел. 8 (495) 246-06-80;
Анциферов Михаил Борисович – доктор медицинских наук, профессор, главный
эндокринолог Департамента здравоохранения Москвы.
Тел. 8 (495) 246-65-73



