Введение
С увеличением продолжительности жизни в мире медицина все большее внимание уделяет изменениям в организме, связанным с возрастом. С каждым прожитым десятилетием у человека увеличивается количество проблем со здоровьем, таких как повышение массы тела, артериального давления, появление онкологических и сердечно-сосудистых рисков [1, 2]. Среди возраст-ассоциированных заболеваний особого внимания заслуживает системный остеопороз (ОП), диагноз которого нередко ставится уже на стадии осложнений после свершившегося низкоэнергетического перелома. Несмотря на активное внедрение методики костной денситометрии, доступность информации и проведение различных образовательных программ, профилактика этого заболевания не всегда осуществляются рационально и эффективно [3].
В России среди лиц в возрасте 50 лет и старше ОП выявляется у 34% женщин и 27% мужчин [3]. Для женщин с хирургической менопаузой риск развития ОП увеличивается еще на 14%. Для женщин перименопаузального возраста встречаемость ОП равна 11% [4]. Поэтому восполнение дефицита кальция и витамина D имеет особенно большое значение для женщин в возрасте старше 45 лет. В период пери- и постменопаузы на фоне дефицита эстрогенов резко увеличивается скорость резорбции костной ткани, снижается кишечная абсорбции кальция и за счет уменьшения активности почечной 1альфа-гидроксилазы снижается продукция в почках активного метаболита витамина D кальцитриола. Дефицит кальция и витамина D является значимым фактором потери минеральной плотности костной ткани (МПК) у пожилых, негативно влияет на частоту падений и переломов (рис. 1).
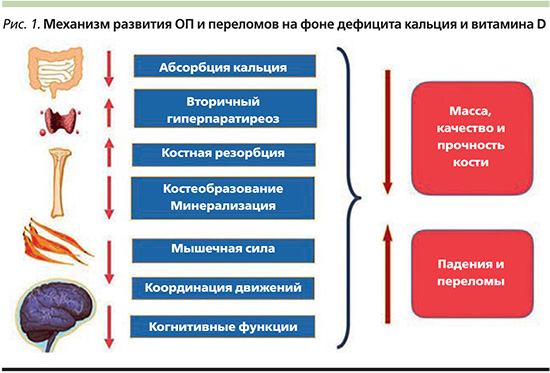
Практически на всей территории России выявлена высокая распространенность дефицита кальция и витамина D [5, 6], а регулярный прием препаратов кальция и витамина D остается эффективным методом профилактики возрастных костных потерь, основой профилактики и комплексной терапии ОП [7, 8]. Адекватное поступление кальция и витамина D у женщин в пери- и постменопаузе предотвращает формирование отрицательного кальциевого баланса и развитие вторичного гиперпаратиреоза, что замедляет менопаузальную потерю МПК [9]. Кроме того, по результатам исследований, прием витамина D и кальция в адекватных дозах дает возможность несколько уменьшить риск таких ассоциированных с возрастом заболеваний, как артериальная гипертензия [10] и гиперхолестеринемия [11, 12], снизить риск сердечно-сосудистой [13] и общей смертности [14, 15], а также вероятность развития рака разной локализации [16]. Восполнение дефицита витамина D благоприятно влияет на течение жирового гепатоза, способствует уменьшению висцерального жира и поддержанию мышечной массы [17].
В настоящее время препараты кальция и витамина D доступны в разных комбинациях и широко применяются как по рекомендациям врача, так и без них. Однако до сих пор обсуждаются вопросы об эффективных дозах и комбинациях этих действующих веществ в составе лекарственных препаратов.
Кальций и витамин D
Потребление кальция в популяции снижается с возрастом. У женщин старше 40 лет выявляется дефицит потребления кальция с пищей и по сравнению с возрастной нормой составляет от 160 до 586 мг/сут [18]. К 65 годам оптимальное потребление кальция должно составлять не менее 1200 мг/сут. В ходе исследования «Остеоскрининг Россия», в которое были включены более 5000 пациентов, получены данные о том, что ежедневное потребление кальция женщинами составило в среднем около 683±231 мг, мужчинами – 635±276 мг. Таким образом, более 70% обследованных лиц ежедневно потребляли с продуктами питания менее половины требуемого им по возрасту количества кальция [19].
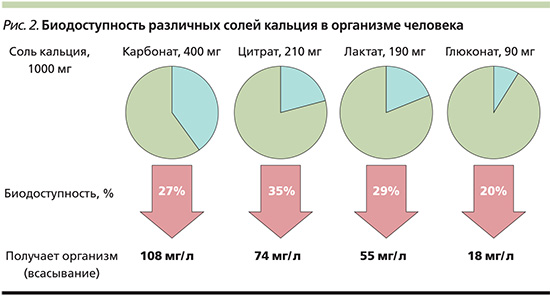
Для восполнения пищевого дефицита кальция предпочтительно использовать его соли, которые характеризуются наибольшим процентным содержанием элементарного кальция – карбонат, трифосфат или цитрат. В своем составе карбонат имеет самую высокую долю элементарного кальция (40%) и в целом обладает значительно более высокой биодоступностью по сравнению с другими кальциевыми солями (рис. 2). Суточную дозу кальция рекомендуется разделить на два приема, поскольку при одномоментном поступлении в организм более 600 мг ионизированного кальция его абсорбция в кишечнике существенно снижается [20, 21].
Витамин D необходим для адекватной абсорбции в кишечнике кальция, содержащегося в пище, и является основным фактором минерализации костной ткани, в норме образуется в небольших количествах в коже под действием ультрафиолета, а также содержится в жирной рыбе, яйцах, печени, обогащенном молоке или маргарине. Терапия витамином D в комбинации с кальцием снижает скорость костных потерь, увеличивает плотность костной ткани, а также уменьшает риск переломов в пожилом возрасте до 43% [22, 23].
В отдельных исследованиях отмечали положительное влияние солей кальция на риск переломов и уровень МПК, однако монотерапия кальцием, применяемая с целью профилактики или лечения ОП, характеризуется более слабым клиническим эффектом, чем его комбинация с витамином D [23, 24]. Мета-анализ демонстрирует, что добавки кальция не профилактируют развитие перелома бедра ни у мужчин, ни у женщин [22]. Комбинированные препараты характеризуются лучшей абсорбцией кальция в кишечнике, их прием ассоциирован с более выраженным повышением МПК и снижением риска переломов по сравнению с монотерапией кальцием [9].
В последнее время отмечается тенденция к преимущественному назначению монотерапии витамином D без сопутствующего приема кальциевых солей при проведении профилактики или комплексного лечения ОП. При этом мета-анализ 9 рандомизированных исследований, проведенный S. Boonen и соавт. (2007), с общим числом пациентов 53 260, продемонстрировал неэффективность монотерапии витамином D без дополнительного приема кальция в отношении риска переломов, в частности переломов бедра [25].
Магний
Магний участвует в регуляции метаболизма кальция, росте и минерализации костной ткани и совместно с витамином D является кофактором скорости костного метаболизма. В организме взрослого человека содержится 21–28 г (1 моль) магния, 60% которого находятся в скелете, где этот микроэлемент составляет около 1% минеральной составляющей кости [26]. Поскольку магний – один из составных элементов кристаллической решетки костного гидроксиапатита, его дефицит может вызывать патологические изменения в структуре костной ткани и ряд костных заболеваний. Мобилизация магния из костей приводит к костной резорбции [27]. Магний участвует в минерализации костной ткани, на всех этапах костного метаболизма напрямую и опосредованно через влияние на секрецию паратиреоидного гормона и образование активной формы витамина D в почках. Внутриклеточный магний незаменим для многих биохимических реакций, прежде всего он входит в состав АТФ, а также выступает кофактором для значительного количества ферментов. Благодаря своему положительному заряду магний является стабилизатором клеточных мембран и антагонистом кальция [28].
Дневная потребность в магнии составляет 8–12 ммоль. Поскольку магний входит в структуру хлорофила, этим элементом богаты овощи и зелень [29]. Кроме того, высоко содержание минерала в орехах, семенах и бобовых. Особенности «западного» питания характеризуются потреблением значительного количества полуфабрикатов и недостатком микронутриентов в пище. В результате программы мониторинга питания, проведенные в Европе и США, выявили неудовлетворительное количество магния в пище большинства людей [30], что приводит к субклиническому дефициту магния. Дефицит магния может также быть обусловлен хроническими заболеваниями почек и желудочно-кишечного тракта, сахарным диабетом 2 типа, приемом диуретиков, антибиотиков и противоопухолевых препаратов [31]. Кроме того, низкий уровень магния часто встречается у пожилых людей на фоне алкоголизма [30].
В исследованиях на животных отражено, что недостаток поступления магния с пищей приводит к развитию ОП, усиливает активность остеокластов, замедляет дифференцировку остеоцитов, минерализацию и, вероятно, снижает прочность костной ткани [32]. Роль дефицита магния в развитии патологии костной ткани подтверждается и в клинических исследованиях. В частности, выявлена сильная связь между уровнем магния и показателями МПК. У женщин в пери- и постменопаузе низкие цифры магния в сыворотке крови ассоциируются с низкой МПК и ОП, и, наоборот, дополнительный прием солей магния оказывает положительный эффект на МПК у пациенток с ОП [33].
Последние исследования показывают, что ежедневный прием комбинированных пероральных препаратов, содержащих 600 мг магния и 500 мг кальция, способствует поддержанию МПК трабекулярной костной ткани у женщин после наступления менопаузы [34]. Недостаток магния может приводить к гипокальциемии и периферической резистентности к действию витамина D [35]. Таким образом, важен баланс и соотношение кальция и магния в организме, и этот фактор следует учитывать при подборе витаминно-минерального комплекса для пациента.
Цинк
В организме человека содержится 1,5–2,5 г цинка, 30% находится непосредственно в костях и еще 60% – в скелетной мускулатуре [36]. Известно, что цинк входит в состав более чем 200 ферментов, таких как карбоангидраза, щелочная фосфатаза и др. Выработка гормонов, в т.ч. отвечающих за кальциево-фосфорный обмен, связана с цинком. Цинк принимает участие во множестве биохимических процессов, так или иначе связанных с образованием костной ткани и ростом организма в целом. Известно, что содержание цинка в костях снижается с возрастом, у женщин после менопаузы, а также при состояниях, ассоциированных с усилением костной резорбции. Есть данные о том, что цинк способен оказывать стимулирующий эффект на функцию остеобластов и минерализацию кости, при этом подавляя активность остеокластов [36].
Цинк помимо кальция необходим для минерализации костной ткани и стимуляции синтеза ДНК в костных клетках. Сочетание цинка и витамина D3 синергически потенциирует костную минерализацию путем стимуляции синтеза ДНК в остеоцитах [37]. Но повышенное содержание кальция может влиять на метаболизм цинка, поэтому всякий раз при увеличении потребления кальция следует также увеличивать содержание цинка в диете. При дефиците цинка резко замедляется формирование скелета и окостенение хрящей. Поступление цинка также важно для предотвращения ОП при старении. С увеличением возраста происходит снижение содержания клеточного цинка и снижается синтез белка в костных тканях, который можно частично восстанавливать благодаря дополнительному приему цинка [38].
Среди микронутриентов именно дефицит цинка занимает первое место в мире по распространенности: им страдают около 4,5 млрд человек (данные Российского общества микроэлементологии – РОСМЭМ). Частота выявления недостаточности цинка у детей составила 30% в Новосибирске, 48% – в Московском регионе, 81% – в Челябинске, 92% – в Саратове. Основная причина дефицита цинка – алиментарная. Так, по данным РОСМЭМ, в 2002 г. дефицит цинка в рационе питания у женщин 25–34 лет в Москве достигал почти 40%, уступив лишь дефициту йода (65%) и селена (56%) [39]. Еще одна из причин имеющегося дефицита цинка – избыток его элементов-антагонистов. Таким образом, остро встает вопрос о профилактике дефицита цинка и его восполнении путем применения витаминно-минеральных комплексов [40].
В настоящее время фармакологические средства, содержащие кальций, делятся на несколько групп:
- Препараты первого поколения – лекарства, содержащие исключительно соединения кальция.
- Препараты второго поколения – содержат комбинацию кальция с витамином D, отличаются более высокой терапевтической эффективностью по отношению к препаратам первого поколения.
- Препараты третьего поколения – наиболее современные комбинированные средства, сочетающие максимально биодоступные соединения кальция, витамин D, микро- и макроэлементы, способствующие более качественному усвоению кальция и обеспечивающие пролонгированный терапевтический результат.
Одним из таких лекарств третьего поколения является Остеокеа (Osteocare®, Витабиотикс; Великоб-ритания). В таблетированной форме Остеокеа является зарегистрированным лекарственным препаратом, в жидкой форме – биологически активной добавкой и, что важно, единственной жидкой формой кальция. Помимо непосредственно витамина D (100 ЕД) препарат содержит магний и цинк (см. таблицу).
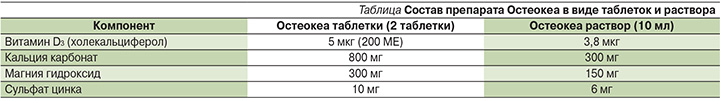
Лечение препаратом показано к профилактике и коррекции дефицита минералов и витамина D, профилактике дефицита кальция в периоды жизни, характеризующиеся повышенной потребностью в нем (менопауза, пожилой возраст, период беременности и лактации), а также профилактике системного ОП и кариеса. Препарат прошел ряд исследований с успешным результатом, в которых доказал свое положительное действие на МПК, кальциевый баланс, отмечено достоверное снижение костной резорбции и уменьшение болевого синдрома на фоне терапии [41].
Заключение
Адекватное поступление кальция и витамина D – одно из важных условий профилактики ОП и других возраст-ассоциированных заболеваний. Выбирая препарат, следует помнить о наличии и сбалансированном сочетании в лекарственном средстве не только витамина D и соли кальция с его высоким процентным содержанием, но и дополнительных минералов и микроэлементов, необходимых в комплексе для поддержания здоровья костной ткани.



