Аденомы, секретирующие соматотропный гормон (СТГ) (соматотропиномы), составляют 10–15 % от всех опухолей гипофиза и по распространенности занимают устойчивое 3-е место (после гормонально-неактивных аденом [30–50 %] и пролактином [25–40 %]) [1]. Избыточная продукция гормона роста клинически проявляется гипофизарным гигантизмом или акромегалией в зависимости от того, когда (до или после завершения пубертата) дебютирует заболевание. Несмотря на улучшение медицинского пособия, риск смертности при данной патологии на 32 % выше, чем в общей популяции. Запоздалая диагностика и наличие полиорганных осложнений служат ведущими факторами негативного прогноза акромегалии [2].
Прогрессирующее увеличение объема опухоли гипофиза в ограниченном пространстве турецкого седла оказывает негативное влияние на морфофункциональное состояние окружающих образований с развитием интраселлярной и интракраниальной компрессии. Следствием масс-эффекта остается развитие парциальной гипофизарной недостаточности, которая проявляется признаками вторичного гипогонадизма, гипотиреоза, гипокортицизма, а также несахарного диабета. Выход опухоли за пределы турецкого седла сопровождается краниалгией, широким спектром зрительных, неврологических, сосудистых и функциональных отклонений, характер которых определяется направлением и особенностями опухолевого роста [3].
Морфологический состав соматотропином достаточно разнообразный как по степени цитодифференцировки, так и по функциональной и пролиферативной активности. Согласно классификации ВОЗ, выделяют густогранулированные, редкогранулированные, смешанные (соматопролактиномы, маммосоматотропиномы) аденомы, аденомы из ацидофильных стволовых клеток, плюригормональные СТГ-продуцирующие аденомы, а также карциномы гипофиза [4, 5]. Наиболее агрессивным течением отличаются низкодифференцированные формы аденом, характеризующиеся генетической предрасположенностью, ранним возрастом дебюта, высокой скоростью опухолевого роста с экстраселлярным и инвазивным распространением, повышенной секреторной активностью, резистентностью к проводимому лечению и наклонностью к рецидивированию. При иммуногистохимическом исследовании опухолевые клетки характеризуются низкой экспрессией соматостатиновых рецепторов и высоким индексом пролиферации Ki-67 [6].
Как следует из литературных данных, состав и рецепторный профиль опухолевых клеток, их пролиферативная и секреторная активность, равно как и чувствительность к супрессивному действию лекарственных препаратов, зависят от множества факторов, включая изменение нативной рецепторной архитектоники, выраженность мембранного и цитозольного пулов рецепторных белков, возникновение биологически неактивных изоформ рецепторных подтипов, а также нарушение внутриклеточных процессов [7].
Для оценки пролиферативной активности гипофизарных опухолей используются методики, позволяющие вычислять митотический индекс, а также содержание маркеров клеточной пролиферации. Если в неинвазивных аденомах число митозов не превышает 3,9 %, то в инвазивных опухолях это число увеличивается до 21,4 %, а в карциномах оно еще выше, составляя 66,7 %.
Наиболее важным маркером клеточной пролиферации остается Ki-67 (MIB-1), который экспрессируется в G1-, S-, G2-, и M-фазы клеточного цикла. При диагностике чаще используется MIB-1 – высоковоспроизводимый эпитоп Кi-67-антигена. В опухолях гипофиза содержание MIB-1 колеблется от 0,1 до 3,7 %, причем в инвазивных аденомах этот индекс значительно выше, составляя 1,12 ± 1,87 % и 2,01 ± 3,1 % соответственно [8, 9].
О скорости опухолевого роста можно также судить по оценке индекса мечения (ИМ) для Ki-67, который определяется путем подсчета позитивных помеченных ядер в 1000 опухолевых клетках и выражается в процентах. Этот показатель статистически значимо выше в быстроувеличивающихся аденомах (более 1,5 мм в год). Значение ИМ Ki-67 более 3 % свидетельствует о высокой пролиферативной активности опухоли и склонности к рецидивирующему течению. Согласно данным K. Thapar и соавт., ИМ Ki-67 в 3 раза выше в опухолях с инвазивным ростом по сравнению с неинвазивными аденомами. В гипофизарных карциномах ИМ Ki-67 повышается до 12 % [10].
Важным прогностическим признаком является иммуногистохимическое определение присутствия соматостатиновых рецепторов (ССР) в опухолевой ткани, поскольку их плотность и специфика распределения в цитоплазматической мембране напрямую связаны с чувствительностью к действию аналогов соматостатина. Отмечено, что в соматотропиномах доминируют ССР 2А- и 5-го подтипов, тогда как в смешанных СТГ/пролактин-секретирующих аденомах более представлен 5-й подтип ССР [11].
Среди стромальных предикторов инвазивного роста опухолевой ткани выделяют активность тканевого ангиогенеза, содержание фактора роста эндотелия сосудов (ФРЭС), металлопротеаз и мукосубстанций. К основным индукторам ангиогенного роста относится ФРЭС, экспрессия которого положительно коррелирует с выраженностью клеточной пролиферации [12].
При изучении инвазивных свойств различных подтипов гипофизарных аденом было установлено, что плохо дифференцированные, слабогранулированные, смешанные, а также гормональнонеактивные аденомы отличаются более частым инвазивным ростом, чем хорошо дифференцированные, густогранулированные и гормональноактивные опухоли гипофиза. Показана связь между размерами соматотропиномы и риском инвазии: при микроаденомах (≥ 10 мм в диаметре) инвазия в окружающие ткани наблюдается в 2 % случаев, при макроаденомах (11–39 мм) – в 22 %, при гигантских аденомах (≥ 40 мм) – в 80 % случаев [6, 13].
Согласно международному консенсусному соглашению, составными элементами лечебного пособия являются ликвидация (резекция или стабилизация размеров) опухоли гипофиза, снижение содержания СТГ и инсулиноподобного фактора роста-1 (ИРФ-1) до безопасного уровня, уменьшение выраженности (стабилизация или обратное развитие) клинических симптомов заболевания, сохранение функциональной активности гипофиза и предупреждение рецидивов [2, 14].

В настоящее время средством выбора при удалении интраселлярных микроаденом и неинвазивных макроаденом служит селективная аденомэктомия трансназальным транссфеноидальным доступом. При оперативном удалении микроаденомы полная биохимическая ремиссия (с нормализацией уровня ИРФ-1 в крови) наблюдается в 75–95 % случаев, тогда как радикальное удаление неинвазивной макроаденомы достигается лишь 40–60 % пациентов. Сам факт наличия опухоли больших размеров (макроаденомы, гигантской аденомы) указывает на техническую сложность достижения клинико-биохимической ремиссии. В 43 % случаев сохраняется продолженный рост и в 2–3 % – рецидивирующее течение. При инвазивных макроаденомах рекомендуется проведение резекции (не менее 75 % от всего опухолевого объема) с последующим назначением лекарственной терапии [15, 16].
По данным проведенного мета-анализа, послеоперационная биохимическая ремиссия акромегалии (спорадический уровень гормона роста [ГР] < 2,5 нг/мл, СТГ надир < 1 нг/мл, нормализация концентрации ИРФ-1) наблюдается при микроаденоме в 75 % случаев, при макроаденоме: интраселлярной – в 74 %; параселлярной (или в сторону сфеноидального синуса) – в 42 %; с супраселлярным ростом – в 33 %; при гигантской аденоме – в 10 % случаев. Отмечается обратная корреляция между объемом опухолевой ткани и процентом постоперационной биохимической нормализации. Показано, что при макроаденомах размером более 2 см показатель хирургической ремиссии составляет 40–50 %. Выявлена прямая корреляция между повышенным содержанием СТГ (более 30 нг/мл) и инвазивным ростом соматотропиномы. При этом хирургическая ремиссия наблюдается лишь в 20–50 %. При уровне СТГ более 200 нг/мл опухоль заведомо хирургически не курабельна, поскольку имеется выраженная инвазия в кавернозный синус. Cам факт присутствия инвазии опухоли предполагает техническую невозможность ее тотального удаления при стандартном хирургическом подходе, а также необходимость дополнительной терапии и продолжительного динамического контроля [17, 18]. Таким образом, наличие либо отсутствие хирургической перспективы, а также соматическое состояние больного следует учитывать при планировании лечебной стратегии.
Что же касается лучевой терапии, то с учетом отсроченного характера ее действия, а также высокого риска развития тропной недостаточности и иных ятрогенных последствий назначение ее ограничивается ситуациями неэф-фективности иных методов лечения [2, 19].
За последние десятилетия активно разрабатывается тема медикаментозного лечения соматотропином с использованием разнопрофильных фармакологических препаратов (агонистов дофамина, синтетических аналогов соматостатина [АС], блокаторов рецепторов СТГ и т.д.). Наиболее эффективно проявили себя АС (октреотид и ланреотид), обладающие не только антисекреторным, но и антипролиферативным действиями [20, 21]. В отличие от нативного соматостатина АС избирательно связываются со 2-м и 5-м подтипами соматостатиновых рецепторов (ССР), контролирующими секрецию СТГ. Причем их аффинитет ко 2-му лиганду в 10 раз выше, чем к 5-му подтипу ССР. Клетки СТГ-секретирующих аденом гипофиза также преимущественно экспрессируют 2-й и 5-й подтипы ССР, аффинность к которым может различаться в различных морфологических типах опухолей [22, 23].
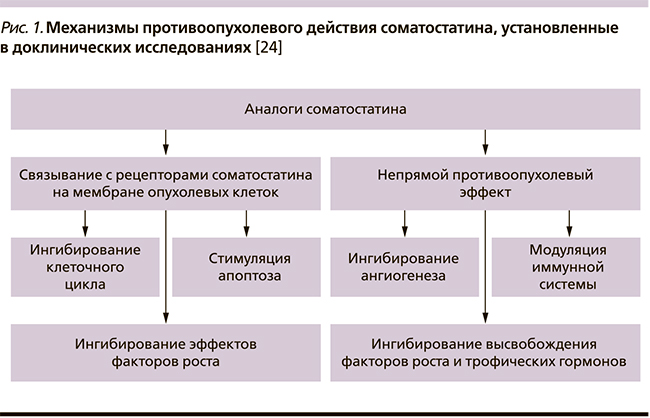
Противоопухолевый эффект АС реализуется прямыми и непрямыми механизмами через активацию ССР1–5 на поверхности опухолевых клеток, а также клеток микроокружения [24] (рис. 1). Механизмы данного эффекта изучены в исследованиях in vitro и in vivo и изложены в одном из последних обзоров Zatelli и соавт. Противоопухолевый эффект АС зависит от экспрессии ССР и их подтипов [25].
Нативный соматостатин ингибирует пролиферацию клеток путем приостановки клеточного цикла, индукции апоптоза, снижения продукции ростовых факторов и блокирования ангиогенеза. Отмечено, что активация 1-го, 2-го, 4-го и 5-го ССР вызывает остановку клеточного цикла, тогда как воздействие на 2-ю и 3-ю лиганды стимулирует процесс апоптоза. Ингибирование ангиогенеза может осуществляться как прямо – путем задержки роста эндотелиальных клеток, так и опосредованно – с помощью подавления продукции ФРЭС [23].
Как следует из результатов сравнительных клинических исследований, предоперационный прием АС способствует уменьшению присутствия в опухолевых клетках ядерного белка Ki-67, экспрессируемого только в процессе клеточного цикла, а также увеличению пропорции клеток, находящихся в G1- и M-фазах, что однозначно указывает на цитостатическое действие препаратов. По данным норвежского исследования POTA (Preoperative Octreotide Treatment of Acromegaly), предварительное (в течение 6 месяцев) введение октреотида повышало плотность опухолевой массы, что способствовало более радикальной аденомэктомии и снижению послеоперационных осложнений [26]. В исследовании T. Florio и соавт. было показано, что аналог соматостатина ланреотид ингибировал пролиферацию клеток 10 из 13 аденом in vitro [27].
Клинические исследования противоопухолевого эффекта аналогов соматостатина
На сегодняшний день собрана широкая доказательная база, подтверждающая положительное влияние АС (октреотида и ланреотида) при лечении акромегалии. Особо подчеркивается, что у чувствительных к октреотиду пациентов АС оказывают выраженное антисекреторное и антипролиферативное действие, способствуя повышению качества жизни и выживаемости больных. Биохимический контроль достигается 50–75 % пациентов.
Аналоги соматостатина используются как в комбинации с хирургическим вмешательством (пред- и/или послеоперационно), так и в качестве самостоятельной первичной терапии. Первичная медикаментозная терапия АС может быть предложена пациентам с макроаденомами, не имеющими локального масс-эффекта или имеющими плохую хирургическую перспективу (из-за экстраселлярного распространения опухоли, особенно в кавернозный синус), или тем, у которых имеются соматические противопоказания, или больным, предпочитающим медикаментозную терапию [2, 3, 14]. Доказано, что эффективность лечения зависит от базального уровня ГР, наличия специфических функционирующих рецепторов и продолжительности лечения. По данным P.U. Freda и соавт., вторичная терапия сандостатином-ЛАР или соматулином способствовала нормализации уровня ГР в 56 и 49 % случаев, а концентрации ИРФ-1 – в 66 и 48 % соответственно. Полученные результаты убедительно свидетельствуют о том, что использование АС в качестве первичной или вторичной медикаментозной терапии способствует нормализации содержания ИРФ-1 у 67–75 % больных, а также статистически значимому уменьшению размеров аденомы гипофиза примерно у 75 % больных после годичного курса лечения. Предикторами противоопухолевого ответа считаются степень снижения уровня СТГ и ИРФ-1 на фоне терапии аналогами соматостатина и длительность лечения [28, 29].
Возвращаясь к патоморфологическому строению соматотропином, следует отметить, что наибольшей чувствительностью к АС обладают опухоли, состоящие из густогранулированных соматотропоцитов, экспрессирующие на своей поверхности 2-й подтип ССР. Напротив, редкогранулированные, смешанные, а также атипичные аденомы лишены аффинитета к данному лиганду и проявляют резистентность к АС, что требует дополнительных усилий для медикаментозной коррекции секреторной активности [30].
В работе A. Giustina и соавт. (2012) представлены результаты мета-анализа, целью которого являлось определение числа пациентов с акромегалией, у которых выявлено снижение размеров опухоли на фоне лечения АС (октреотид п/к или октреотид ЛАР в/м) и средний процент уменьшения объема опухолевой ткани. Было проанализировано 2202 статьи и выбрана когорта из 1685 пациентов, соответствующих критериям обследования. Как показали результаты, уменьшение размеров опухоли наблюдалось в среднем у 53 % больных (при использовании октреотида ЛАР – у 66 %), при этом величина снижения объема составила 37,4 и 50,6 % соответственно. Клиническое преимущество пролонгированных форм октреотида объясняется созданием более стойкой терапевтической концентрации препарата в крови. Обнаружена прямая корреляция между степенью нормализации уровней СТГ и ИРФ-1 и процентом снижения объема аденомы гипофиза, хотя имеются литературные данные, указывающие на наличие диссоциации между антисекреторным и антимитотическим действиями АС. Также обсуждается возможное супрессивное влияние АС на продукцию ростовых факторов и ангиогенез [31].
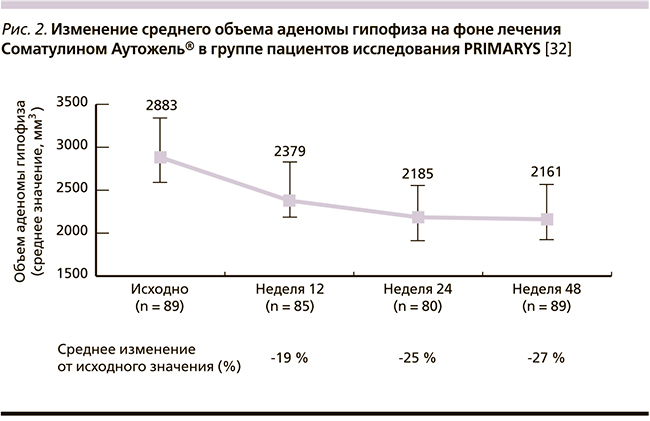
В 2013 г. были подведены результаты многоцентрового исследования PRIMARYS, целью которого была оценка антипролиферативного эффекта Соматулина Аутожель® (ланреотид) на гомогенной выборке пациентов с СТГ-продуцирующими макроаденомами гипофиза [32].
Исследование PRIMARYS
Данное открытое многоцентровое исследование 3b-фазы продолжительностью 48 недель проходило в 27 специализированных эндокринологических центрах 9 стран (Бельгия, Чешская Республика, Финляндия, Франция, Германия, Италия, Нидерланды, Турция, Великобритания) в течение почти 4 лет (с 2008 по 2012 г.). В исследование включали первичных пациентов с СТГ-секретирующей макроаденомой гипофиза без признаков сдавления зрительного перекреста (см. таблицу).
Пациентам, включенным в исследование, вводили Соматулин® Аутожель® (ланреотид) в дозе 120 мг раз в 28 дней (всего 12 инъекций за период исследования). В связи с упрощенной лекарственной формой инъекции препарата проводились как в медицинском центре, так и в домашних условиях, что, как было ранее доказано, не только не снижало эффективности лечения, но и повышало степень свободы пациентов [33].
Целью исследования стало определение числа (в %) пациентов, у которых на фоне 48 недель лечения отмечено значимое уменьшение объема аденомы гипофиза (≥ 20 %). Объем аденомы гипофиза для каждого по МРТ-снимкам оценивали три независимых эксперта. Кроме того, определены серологические концентрации СТГ, ИФР-1 и % пациентов, достигших нормальных значений СТГ (≤ 2,5 и ≥ 1 мкг/л) и/или ИФР-1.
К концу исследования уменьшение объема аденомы ≥ 20 % было достигнуто примерно 75 % пациентов. При этом уже на 12-й неделе исследования клинически значимое уменьшение аденомы гипофиза наблюдалось у 54 % пациентов. В среднем к концу исследования степень уменьшения аденомы гипофиза составила 27 % (рис. 2).
Что касается биохимического ответа, на 48-й неделе исследования уровень СТГ в среднем снизился на 71 %, ИФР-1 – на 57 % от исходных значений. Доля пациентов с нормализацией обоих биохимических показателей составила примерно 44 %, а с нормализацией биохимических показателей и устранением симптомов заболевания – 34 %.
Заключение
Таким образом, в исследовании PRIMARYS показана эффективность применения в качестве терапии первой линии при макроаденомах в отношении как биохимического контроля, так и контроля над ростом опухоли. Приведенные результаты, согласующиеся с данными других проспективных исследований, подтверждают эффективность использования Соматулина Аутожель® в качестве первичной или вторичной медикаментозной терапии. Наличие чувствительности к АС, проявляющееся нормализацией уровней СТГ и ИРФ-1, является дополнительным предиктором антипролиферативного действия препарата и позволяет рекомендовать его длительное использование в лечении соматотропином в случае повышенного анестезиологического риска, отсутствия хирургической перспективы или наличия соматических противопоказаний к оперативному вмешательству.



