Введение
Акромегалия (АМ) является гетерогенным заболеванием, объединяющим различные клинико-патоморфологические варианты гипофизарных и внегипофизарных нейроэндокринных опухолевых образований, отличающихся рецепторным фенотипом, пролиферативной активностью и чувствительностью к предъявляемому лечению. Согласно классификации опухолей эндокринных органов Всемирной организации здравоохранения (ВОЗ, 2017) среди соматотрофных опухолей гипофиза морфологически выделяют четыре подтипа: плотно гранулированные (ПГА), редко гранулированные (РГА) аденомы, маммосоматотрофные (опухоли состоят из одной популяции клеток, способных секретировать гормон роста [ГР] и пролактин [ПРЛ]) и смешанные соматолактотрофные (опухоли состоят из двух клеточных популяций, которые изолированно секретируют ГР или ПРЛ) аденомы. Несмотря на то что все эти морфологические подтипы дифференцируются из стволовых соматотрофных клеток и принадлежат одной ацидофильной линии, они различаются дополнительными факторами транскрипции, гистологическими, иммунофенотипическими характеристиками, а также особенностями клинического течения [1, 2].
Наиболее часто (в 30-50% случаев) встречаются ПГА, состоящие из «ярко» эозинофильных опухолевых клеток с диффузной положительной экспрессией ГР и перинуклеарным расположением низкомолекулярных цитокератинов. При электронном микроскопировании выявляется хорошо развитый эндоплазматический ретикулум, большой комплекс Гольджи, многочисленные перинуклеарные промежуточные нити и множественные крупные (300-600 нм) электронноплотные секреторные гранулы, содержащие ГР [10]. Иммуногистохимический анализ (ИГА) опухолевого материала с помощью специфических антител (АТ) выявляет высокую экспрессию 2-го и низкую экспрессию 5-го подтипов соматостатиновых рецепторов - ССР (рис. 1) Как и нормальные соматотрофы, опухолевые клетки способны экспрессировать а-субъединицу гликопротеиновых гормонов. Данный опухолевый вариант, как правило, выявляется у пациентов старше 50 лет и отличается медленным ростом, преимущественно интраселлярным расположением, а также хорошей чувствительностью к аналогам соматостатина 1-й генерации (АС1).
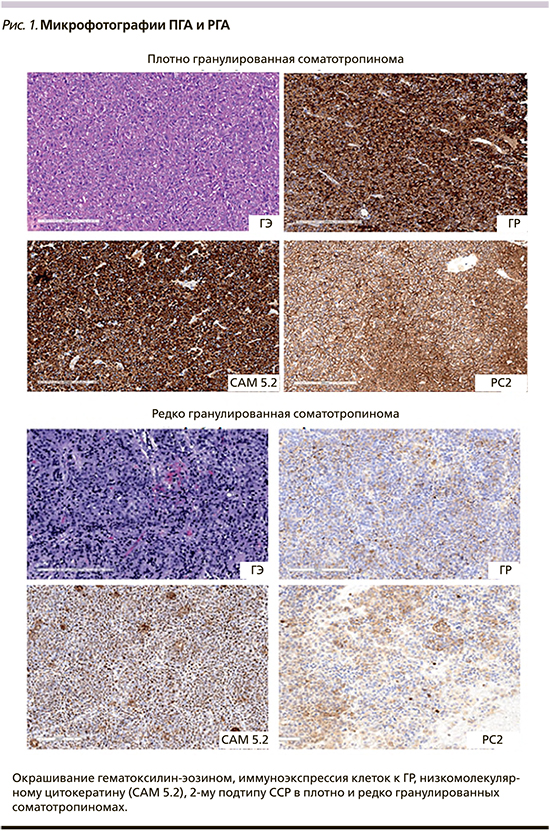
РГА, обнаруживаемые у 20-30% пациентов с АМ, состоят из слегка эозинофильных или хромофобных клеток. Электронная микроскопия демонстрирует большие скопления кератиновых нитей, а также наличие заметных юкстануклеарных кератиновых агрегатов, известных как «фиброзные тельца». Секреторные гранулы редкие, вследствие чего эти опухоли обладают слабой или очаговой иммуноэкспрессией ГР. При ИГА отмечается слабовыраженная и в меньшем количестве клеток соматотропином экспрессия 2-го и более выраженная экспрессия 5-го подтипов ССР (рис. 1). В отличие от ПГА этот вариант опухоли отличается повышенной пролиферативной активностью и высоким риском малигнизации. Индекс Ki-67 в большинстве случаев превышает 3%. РГА наблюдаются у пациентов с ранним дебютом заболевания, характеризуются большими размерами, активным экстраселлярным ростом, инвазивным распространением в окружающие ткани с развитием интраселлярной и интракраниальной компрессии. Несмотря на то что эти опухоли обладают относительно меньшей секреторной активностью по сравнению с ПГА, тем не менее их лечение представляет клиническую проблему, поскольку они проявляют склонность к послеоперационному продолженному росту и рецидивированию, зачастую резистентны к медикаментозному и/ или радиологическому лечению. Все эти характеристики дали основание включить РГА в особую группу опухолей «высокого риска».
Некоторые авторы описывают промежуточный вариант соматотрофных опухолей, клетки которых имеют высокую экспрессию 2-го подтипа ССР и присутствие фиброзных телец в небольшом количестве (менее 70% опухолевых клеток). Согласно классификации ВОЗ (2017), промежуточный вариант рекомендовано относить к категории ПГА, т.к. они обладают сходным клиническим течением и чувствительностью к АС1. Что же касается других морфологических подтипов соматотропином, то генетически детерминированные маммосоматотрофные аденомы, манифестирующие в раннем возрасте гипофизарным гигантизмом, являются заведомо устойчивыми к предъявляемому лечению, тогда как чувствительность к АС1 бицеллюлярных соматолактотрофных опухолей зависит от рецепторной экспрессии соматотрофного компонента [3—5].
Современный алгоритм медицинского пособия при АМ последовательно включает хирургическое лечение, медикаментозную, лучевую и цитостатическую терапию. При этом объем и характер лечебных мероприятий зависят от возраста пациента, его соматического статуса, величины масс-эффекта, радикальности проведенной аденомэктомии, секреторной и пролиферативной активности резидуальной опухолевой ткани, чувствительности к лекарственным препаратам.
Транссфеноидальная аденомэктомия, выполняемая квалифицированным нейрохирургом, является основным методом лечения большинства пациентов, поскольку является единственным средством, позволяющим достигать быстрого контроля заболевания. В зависимости от исходных размеров соматотрофной аденомы и выраженности масс-эффекта послеоперационный контроль наблюдается при микро-, макро- и инвазивных аденомах примерно в 75-90%, 40-50 и 24% случаев соответственно. К предикторам низкого оперативного контроля относятся большие размеры опухоли, инвазия в кавернозный синус, существенно повышенные уровни ГР и инсулиноподобного фактора роста-1 (ИРФ-1), молодой возраст пациентов, наличие генетических нарушений. Примерно у 50% прооперированных больных сохраняется активность заболевания, требующая подключения вторичной терапии, характер которой зависит от результатов ИГА удаленного материала, определяющего морфологический тип аденомы, особенности рецепторной экспрессии и пролиферативную активность опухолевых клеток [6-8].
Согласно международным рекомендациям, ведущими препаратами, используемыми для снижения опухолевой продукции ГР, являются пролонгированные формы АС1 (ланреотид и октреотид), способные в неселективной группе обеспечивать стойкий контроль АМ в 40-50% случаев. Наилучший результат наблюдается при лечении пациентов с ПГА, клетки которых преимущественно экспрессируют 2-й подтип ССР. Что же касается РГА, то в силу низкой экспрессии 2-го подтипа ССР эффективность фармакотерапии АС1 намного ниже. В отсутствие ожидаемого лечебного эффекта от приема АС1 последующий терапевтический маневр осуществляется путем подключения селективного агониста дофаминергических рецепторов (каберголина), перевода на лечение АС 2-й генерации (пасиреотида ЛАР) или добавления блокатора рецепторов ГР (пэгвисоманта) [9-11].
К сожалению, до настоящего времени отсутствует дифференцированная медикаментозная терапия (МТ) синдрома АМ с учетом особенностей рецепторной экспрессии отдельных гистологических вариантов соматотропином. Рекомендуемая консенсусными соглашениями практика последовательного подбора лечебных препаратов путем «ex juvantibus» подвергается активной критике, поскольку не отвечает принципам таргетной терапии [12, 13]. В последние годы появляется все больше работ, посвященных выявлению предикторов для каждого морфологического подтипа соматотрофных аденом, «золотым» стандартом среди которых является ИГА фрагментов удаленной опухолевой ткани. В научной литературе активно анализируется диагностическая ценность как отдельных маркеров, так и прогностических моделей, позволяющих определять дальнейший клинический сценарий заболевания и судить о чувствительности резидуальной аденомы к определенным видам вторичной МТ [14-17].
Цель настоящей работы: проведение клинико-морфологического сопоставления между клинической эффективностью длительной МТ АС1 и цитологическими особенностями ПГА и РГА с использованием результатов ИГА.
Методы
В ретроспективное исследование были включены 65 пациентов (23 мужчины) с верифицированным диагнозом АМ, входящих в Московский регистр больных АМ. Средний паспортный возраст составил 45,0±13,3 года, возраст диагноза - 41,6±13,7 года. Срок от начала появления первых симптомов до постановки диагноза (латентный период) составил 7,9±9,4 года. Исходные уровни ГР и ИРФ-1 составили 32,7±49,6 и 705,5±244 нг/мл соответственно. Объем опухоли (см3) определялся при проведении магнитно-резонансной томографии головного мозга с контрастным усилением по формуле DeChiro&Nelson. Всем больным в качестве первой линии лечения была проведена транссфеноидальная аденомэктомия, дополненная у 47 больных (20 мужчин) вторичной МТ пролонгированными формами АС1 (Соматулин Аутожель 120 мг в 28 дней подкожно и октреотид в дозе 10-30 мг в 28 дней внутримышечно). Средняя длительность вторичной фармакотерапии составила 21±16 месяцев. Для оценки эффективности МТ использовался показатель ИРФ-1-индекс (ИИ) - величина превышения уровня ИРФ-1 верхней возрастной нормы (ИРФ-1/ВВН). Наличие биохимической ремиссии регистрировали при величине ИИ<1. Величины снижения ИРФ-1 по сравнению с исходным уровнем через 3 и 6 месяцев лечения АС1 сопоставляли с показателями ИРФ-1 и ИИ через 12 месяцев лечения и при последнем визите, а также с длительностью неэффективного и эффективного лечения.
Окончательный морфологический диагноз был поставлен на базе Референс-Центра патоморфологических, иммуногистохимических и радиологических методов исследований ФГБУ «НМИЦ эндокринологии» Минздрава РФ путем ИГА готовых гистологических препаратов соматотрофных опухолей, полученных после трансназальной аденомэктомии и окрашенных гематоксилином и эозином. Для подтверждения диагноза гистологические препараты пересматривали при помощи светового микроскопа (Leica DM 1000, Германия) на увеличениях х40, х 100, х200, х400 с определением опухоли гипофиза, ее клеточного состава, митотической активности (на РПЗ при увеличении х40) и регрессивных изменений, а также отмечалось наличие ткани адено- и нейрогипофиза в соответствии с рекомендациями EPPG (European Pituitary Pathology Group) [18, 19]. Затем из предоставленных парафиновых блоков были выполнены дополнительные срезы и проведено иммуногистохимическое исследование с использованием автоматизированного иммуностейнера Leica BOND III и первичных АТ к ГР (разведение 1:400, Dako, поликлональные кроличьи), пролактину (разведение, 1:600, Dako, поликлональные кроличьи), низкомолекулярному цитокератину (разведение 1:100, моноклональные мышиные, клон CAM 5.2 Cell Marque), Ki-67 (клон MIB1, RTU, Leica), рецепторам соматостатина 2-го подтипа (разведение, 1:100, Epitomics, моноклональные кроличьи, клон EP 149), рецепторам соматостатина 5-го подтипа (разведение, 1:100, abcam, моноклональные кроличьи, клон UMB-5), с демаскирующей обработкой буфером с высоким pH. Экспрессию ГР и ПРЛ оценивали в виде процента клеток опухоли, окрашенных к данным гормонам. Экспрессия низкомолекулярного цитокератина (САМ 5.2) определялась как относительно равномерное окрашивание цитоплазмы либо в виде фиброзных телец. При наличии фиброзных телец более чем в 70% клеток опухоли соматотропиному относили к редко гранулированному варианту. Индекс метки Ki-67 подсчитывали как процентное соотношение окрашенных ядер клеток на 500-1000 клеток в опухоли. Подсчет экспрессии 2-го и 5-го подтипов ССР проводился по балльной шкале IRS (immunoreactive score system), в которой учитывались интенсивность и локализация окраски в клетке (мембране), а также процент клеток, окрашенных соответствующими АТ. Число итоговых баллов составило от 0 до 12. Отсутствие позитивных клеток соответствовало 0 баллов, присутствие менее 10% позитивных клеток - 1 баллу, 10-50% - 2, 51-80% - 3, более 81% - 4 баллам. Слабая интенсивность окраски соответствовала 1 баллу, умеренная - 2, выраженная - 3 баллам. Число баллов, присвоенных за число позитивных клеток и за интенсивность окраски, перемножали и вносили в итоговый протокол [20].
Статистический анализ производили с помощью пакета программ «Statistica-12». Меры центральной тенденции и дисперсии количественных признаков, имеющих приближенно нормальное распределение, представлены в виде среднего арифметического (М) и среднего квадратического отклонения (s). Анализ зависимостей проводили с использованием коэффициента ранговой корреляции Спирмена. С целью выявления прогностических факторов использовали множественный регрессионный анализ с расчетом регрессионных коэффициентов. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты
Согласно данным проведенного ИГА фрагментов оперативно удаленного опухолевого материала, у 34 больных (14 мужчин) выявлены РГА, у 27 (9 мужчин) - ПГА, у 4 (1 мужчина) - смешанные соматотрофные аденомы. Среди последних у 3 выявлены бицеллюлярные соматолактотрофные опухоли и у 1-й больной - редко гранулированная соматотрофная опухоль с ганглиоцитарным компонентом. Средний индекс метки Ki-67 в смешанных опухолях составил 20,1%. Согласно используемым критериям, 3 смешанные опухоли отнесены в разряд РГА и 1 - в разряд ПГА. Таким образом, в группу РГА вошли 37 больных (14 мужчин), в группу ПГА - 28 больных (9 мужчин). Клинико-лабораторные данные представлены в табл. 1.
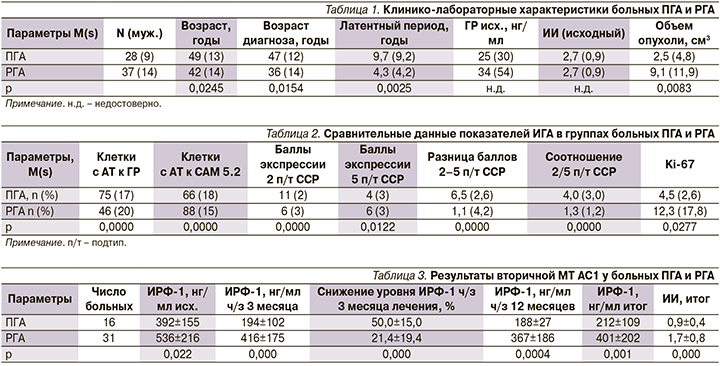
Как следует из табл. 1, у больных РГА отмечались более ранние значения паспортного возраста (42±14 против 49±13 лет; р=0,0245) и возраста диагноза (36±14 против 47±12 лет; р=0,0154). Несмотря на относительно короткий латентный период (4,3±4,2 против 9,7±9,2 года; р=0,0025), в этой группе отмечался больший исходный объем опухоли гипофиза по сравнению с группой ПГА (9,1±11,9 против 2,5±4,8 см3; р=0,0083), что указывает на повышенную митотическую активность и скорость роста РГА (рис. 2).
Что касается секреторной активности соматотрофных аденом, то ее показатели не имели статистически значимых межгрупповых различий. В табл. 2 представлены сравнительные иммуногистохимические характеристики ПГА и РГА.
Как следует из табл. 2, РГА отличаются от ПГА меньшим процентом клеток с АТ к соматотропному гормону (46±20 против 75±17%); большим процентом клеток с АТ к САМ 5.2 (88±15 против 66±18%); относительно низкой экспрессией 2-го подтипа (6±3 против 11±2 баллов); более высокой экспрессией 5-го подтипа ССР (6±3 против 4±3 баллов); меньшей разницей и соотношением баллов экспрессии 2-го и 5-го подтипов ССР (1,1±4,2 против 6,5±2,6 балла и 1,3±1,2 против 4,0±3,0 баллов) соответственно (для всех выше перечисленных различий р<0,001). Показательным является повышение индекса Ki-67 в РГА [12,3+17,8 против 4,5+2,6% (ПГА), (р=0,0277)], что в сочетании с увеличенным исходным объемом аденомы (см. выше) указывает на высокий пролиферативный потенциал данного патоморфологического варианта соматотропином, что подтверждают имеющиеся литературные данные [21].
Вторичную МТ АС1 получили 47 больных [51% (24) — Соматулин Аутожель 120 мг в 28 дней и 49% (23) - октреотид пролонгированного действия 20/30 мг в 28 дней]. Доза октреотида для больных РГА была выше и составила 26±6 мг в 28 дней против 16±5 мг в 28 дней для больных ПГА (р=0,0019). Каберголин в качестве дополнительной терапии получали 18 (48%) больных из 31 и 3 (19%) из 16 больных РГА и ПГА соответственно (р=0,0533). При этом недельная доза каберголина для больных РГА была также выше и составила 1,5±0,6 против 0,7±0,3 мг для больных ПГА соответственно (р=0,046). Из представленного следует, что пациентам с РГА проводилась более активная МТ АС1 с целью достижения контроля заболевания. Ниже в табл. 3 и рис. 3 представлены результаты вторичной фармакотерапии АС1.
Как следует из табл. 3, у пациентов с диагностированными ПГА зарегистрирована лучшая чувствительность к АС1, что проявляется большим процентом снижения уровня ИРФ-1 через 3 месяца от начала лечения (50,0±15,0 против 21,4±19,4%; р=0,049) и стойкой нормализацией концентрации ИРФ-1 на протяжении всего периода лечения. Тогда как у больных РГА, несмотря на повышенные дозы АС1 и длительное лечение, достичь биохимической ремиссии не удалось. Итоговый уровень ИИ составил 1,7±0,8 против 0,9±0,4 (р=0,000).
В ранней работе нами был представлен ретроспективный анализ результативности вторичной МТ АС1 для 267 пациентов, в ходе которого была выявлена корреляционная связь умеренной силы между величиной снижения уровня ИРФ-1 через 3 месяца лечения и величиной ИРФ-1 через 12 месяцев лечения (r=-0,51), итоговым уровнем ИРФ-1 на фоне многолетнего лечения АС1 (r=-0,43) и длительностью эффективной фармакотерапии (r=0,43; р<0,001) [22]. Наличие корреляции послужило основанием для включения данной терапевтической отрезной точки в общий список прогностических факторов, определяющих долгосрочную эффективность/ неэффективность использования АС1. В данной работе представлено продолжение статистического анализа с оценкой связи между обозначенным показателем и особенностями экспрессии опухолевых клеток. Результаты показывают, что величина снижения уровня ИРФ-1 через 3 месяца лечения при вторичной МТ АС1 прямо коррелирует с процентом клеток, экспрессирующих АТ к ГР (r=0,48; p=0,0019), числом баллов экспрессии 2-го подтипа ССР (r=0,48; p=0,001), разницей и соотношением баллов между 2-м и 5-м подтипами ССР (r=0,51; p=0,0004 и r=0,42; p=0,0058 соответственно). Дополнительно отмечается обратная корреляция между исходным показателем, с одной стороны, а также величиной пролиферативного индекса Ki-67 (r=-0,34; p=0,022) и процентом клеток с АТ к САМ 5.2 (r=-0,34; p=0,029), с другой. Показательно отсутствие статистически значимой корреляции между величиной снижения уровня ИРФ-1 через 3 месяца лечения и экспрессией 5-го подтипа CCP (r=-0,22; p=0,14), указывающее на специфичность действия АС1 именно на 2-й подтип ССР.
Также при клинико-морфологическом сопоставлении отмечено, что длительность эффективной МТ напрямую коррелирует с разницей и соотношением между 2-м и 5-м подтипами ССР (r=0,54; p=0,002 и r=0,55; p=0,0018 соответственно) и обратно коррелирует с числом баллов 5-го подтипа (r=-0,39; p=0,038). Напротив, длительность неэффективной фармакотерапии АС1 обратно коррелирует с числом баллов экспрессии 2-го подтипа ССР (r=-0,44; p=0,0039), разницей и соотношением баллов 2-го и 5-го подтипов ССР (r=-0,41; p=0,007 и r=-0,39; p=0,0129, соответственно) и имеет прямую корреляцию с процентом опухолевых клеток, экспрессирующих АТ к САМ 5,2 (r=0,38; p=0,014).
Итоговая величина ИИ прямо коррелирует с исходными показателями ИИ (r=0,75; p=0,000) и объема аденомы (r=0,53; p=0,000), подтверждая литературные данные о прогностическом значении данных показателей, определяющих вероятность контроля АМ [23].
Если судить о долгосрочном прогнозе эффективности МТ АС1, то он в первую очередь зависит от выраженности экспрессии 2-го подтипа ССР в аденоматозных клетках. По нашим данным, величина итогового уровня ИИ обратно коррелирует с экспрессией 2-го подтипа ССР (в баллах) (r=-0,42; p=0,0024), разницей баллов и соотношением 2/5 подтипов ССР (r=-0,43; p=0,0012 и r=-0,40; p=0,005 соответственно). Такая же обратная корреляция наблюдается между итоговым показателем ИИ и величинами снижения уровней ИРФ-1 через 3 и 6 месяцев лечения АС1 (r=-0,57 и r=-0,56 соответственно; p=0,000), доказывающая, что чем выше экспрессия 2-го подтипа ССР в опухолевых клетках, тем ниже величина итогового ИИ и, соответственно, тем лучше эффективность таргетной терапии (табл. 4, рис. 4).

Показательно отсутствие статистически значимой корреляции между итоговым ИИ и выраженностью 5-го подтипа ССР, что подтверждает направленное влияние АС1 на 2-й подтип ССР и свидетельствует о бесперспективности назначения данных препаратов при исходно низкой экспрессии 2-го подтипа в опухолевых клетках, поскольку отсутствует точка приложения специфического лечебного действия АС1.
По итогам множественного регрессионного анализа наиболее значимыми независимыми признаками, ассоциированными с процентом снижения уровня ИРФ-1 через 3 месяца лечения АС1, являются длительность эффективной МТ АС1 (месяцы) (в=0,56; p=0,034); выраженность экспрессии 2-го подтипа ССР (в=0,42; p=0,011); разница баллов экспрессии 2-го и 5-го подтипов ССР (в=0,39; p=0,015); итоговый уровень ИИ на фоне лечения (в=-0,45; p=0,006).
Полученные данные свидетельствуют о том, что исходя из величины снижения уровня ИРФ-1 через 3 месяца лечения можно судить о высокой или низкой экспрессии 2-го подтипа ССР в опухолевых клетках и прогнозировать эффективность долгосрочной фармакотерапии АС1.
Обсуждение
С учетом морфологической гетерогенности соматотрофных опухолей в настоящее время особенно актуальны поиск и стратификация возможных предикторов, позволяющих прогнозировать клиническое течение заболевания и эффективность лечебного пособия. В первую очередь это касается прогноза долгосрочной эффективности использования АС1 как препаратов 1-й линии первичной или вторичной МТ. За 30-летнюю историю клинического применения АС1 доказали свою клиническую эффективность в контроле АМ путем активизации 2-го подтипа ССР и стойкой супрессии опухолевой секреции ГР. При этом было установлено, что наибольшую чувствительность к АС1 проявляют плотно гранулированные аденомы, преимущественно экспрессирующие 2-й подтип ССР [24].
Что касается других морфологических подтипов соматотропином, то здесь терапевтические успехи АС1 в качестве монотерапии скромнее и потому для улучшения контроля АМ требуются добавление препаратов 2-й линии, повторное хирургическое или лучевое лечение. По данным L. Kasuki et al., у 20—25% больных, несмотря на многолетнее использование АС в максимальных дозах, не удается достигать биохимической ремиссии [25]. Таким образом, исходно нецелевое использование АС1 увеличивает длительность активной стадии, повышает коморбидПоэтому на современном этапе диагностическая задача заключается не только в ранней диагностике АМ, но и в определении рецепторного фенотипа опухоли, чтобы не допустить ошибок в назначении препарата и обеспечить персонализированный подход к лечению заболевания.
Среди предлагаемых диагностических маркеров рассматривают возраст пациентов (менее или более 40 лет), пол, индекс массы тела, длительность латентного периода, исходные уровни ГР и ИРФ-1, размер опухоли, интенсивность сигнала на Т2-взвешенных магнитно-резонансных изображениях, результаты теста с октреотидом, эффективные дозы АС1, уровень ИРФ-1 через 6 месяцев лечения АС1 [25-27]. Реальную помощь в решении данной проблемы оказывает метод ИГА опухолевого материала, результаты которого учитываются при построении прогностических моделей.
По данным M.R. Gadelha et al., наиболее значимым предиктором чувствительности к АС1 является экспрессия 2-го подтипа в опухолевых клетках. Отмечено, что экспрессия мРНК 2-го подтипа ССР, оцененная с помощью количественной полимеразной цепной реакции обратной транскриптазы в реальном времени, коррелировала со снижением уровней ГР и ИРФ-1 после 3 и 6 месяцев лечения октреотидом ЛАР, а также с уменьшением объема опухоли. Авторы заключают, что экспрессия белка 2-го подтипа ССР способна предсказать возможность биохимического контроля с 60%-ным положительным и 100%-ным отрицательным прогностическими значениями [26]. В исследовании E. Coopmans et al. показано, что у больных, резистентных к АС1, отмечалась более низкая экспрессия 2-го подтипа и более низкое соотношение 2/5 подтипов ССР [23]. Полученные нами данные клинико-морфологического сопоставления также показывают, что эффективность долгосрочной вторичной МТ напрямую зависят от выраженности экспрессии 2-го подтипа ССР, разницы и соотношения между 2-м и 5-м подтипами ССР.
В работе L.E. Wildemberg et al. была предложена прогностическая модель терапевтического ответа на вторичную фармакотерапию АС1 после нерадикально проведенной аденомэктомии. Модель включала следующие позиции: возраст диагноза, пол, уровни ГР и ИРФ-1 при диагнозе и перед МТ, экспрессию 2-го и 5-го подтипов ССР в баллах и выраженность цитокератиновой грануляции. Всего были проанализированы данные 153 пациентов. Пациенты с хорошей чувствительностью к АС1 были старше по возрасту, отличались более низкими исходными уровнями ГР и ИРФ-1 и чаще имели ПГА с высокой экспрессией 2-го подтипа ССР. Статистическая обработка результатов с помощью искусственного интеллекта позволила сформировать прогностическую модель, позволяющую с точностью до 86,3% прогнозировать долгосрочную эффективность АС1 [28].
В настоящей работе мы не ставили целевой задачей разработку прогностических моделей клинического течения заболевания, эффективности оперативного лечения и риска продолженного роста и рецидивирования. Главным посылом ретроспективного анализа являлось выявление корреляционной связи между результатами краткосрочного (3-месячного) лечения АС1 и морфологическими характеристиками соматотропином, что представляется важным для практического применения как при первичной, так и при вторичной МТ АС1 (в случае отсутствия возможностей получения послеоперационных данных ИГА). Полученные результаты подтверждают имеющиеся литературные данные о присутствии достоверных анамнестических, клинических и лабораторных различий между ПГА и РГА, лечение которых требует дифференцированного и комплексного подхода [26, 29].
Выводы
Исходя из представленных клинико-морфологических сопоставлений, можно сделать следующие выводы:
1. Характер клинического течения АМ и чувствительность к лечению АС1 определяются особенностями морфологического строения и рецепторного фенотипа соматотрофных аденом.
2. Наибольшая эффективность МТ АС1 наблюдалась в группе больных ПГА, отличающихся высокой экспрессией 2-го подтипа ССР. Предиктором результативности долгосрочной фармакотерапии является повышенная величина снижения уровня ИРФ-1 на фоне 3-месячного лечения АС1, обусловленная выраженностью экспрессии 2-го подтипа в опухолевых клетках
3. У больных РГА отмечаются низкие величины снижения уровня ИРФ-1 через 3 и 6 месяцев лечения АС1, обусловленные низкой экспрессией 2-го подтипа ССР, что объясняет неэффективность многолетней МТ, несмотря на относительно высокие дозы АС1 с активным подключением препаратов 2-й линии. Большие размеры РГА с экстраселлярным распространением и инвазивным ростом коррелируют с высоким показателем пролиферативного индекса Ki-67, что свидетельствует о повышенной пролиферативной активности опухолевых клеток и высоком риске продолженного роста резидуальной опухоли.
4. Величина снижения ИРФ-1 через 3 месяца лечения АС1 коррелирует с выраженностью экспрессии 2-го подтипа ССР в опухолевых клетках и, следовательно, в сочетании с другими предикторами может использоваться не только для прогнозирования чувствительности к АС1, но и для суждения о наличии конкретного морфологического подтипа соматотрофной аденомы и возможном сценарии дальнейшего опухолевого развития.


