Эндометриоз и бесплодие: а есть ли связь?
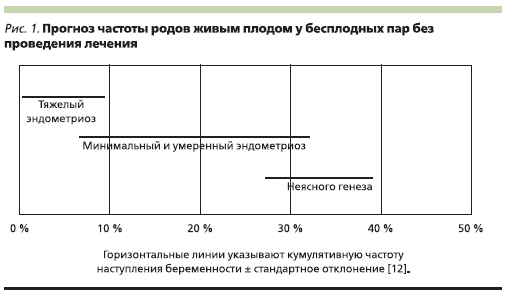
с ЭМ ниже, чем у женщин без ЭМ (0,02–0,10 и 0,15–0,20 соответственно) [26]. Подтверждена более высокая распространенность этого заболевания среди женщин с бесплодием по сравнению с женщинами, которым проведена добровольная хирургическая стерилизация [17].
Большинство данных о связи между ранними стадиями ЭМ и бесплодие получено в ходе проспективных исследований с использованием внутриматочной инсеминации спермой донора, при которой показатель ежемесячной фертильности составил 0,12 у женщин без ЭМ и 0,036 у пациенток с минимальными проявлениями болезни [29].
ИЛ-6, ИЛ-8 [6, 51], а также высоким содержанием фактора роста эндотелия сосудов, фактора роста фибробластов, инсулиноподобного фактора роста-1 и трансформирующего фактора роста-β [12, 44]. Эти факторы роста проявляют абсолютно разные биологические свойства, играют важную роль в миграции, пролиферации и дифференцировке мезенхимальных клеток в процессе эмбриогенеза и влияют на жизнеспособность эмбриона. Неадекватная продукция факторов роста и медиаторов воспаления приводит к дисбалансу процессов пролиферации и апоптоза [20]. Высокие концентрации цитокинов, факторов роста и активированных макрофагов, содержащихся в перитонеальной жидкости, являются токсичными для сперматозоидов [27].
реплика была: “Das war ja toll!” (“Вот это класс!”). Эпитет толл (классный) был позднее дан соответствующему гену в качестве его названия. В 1996 г. выяснилось, что этот ген отвечает не только за дорзо-вентральную поляризацию при эмбриональном развитии, но и за устойчивость дрозофилы к грибковой инфекции. Это открытие французского ученого Ж. Хоффмана было удостоено
Нобелевской премии 2011 г. В настоящее время известно 13 толл-подобных рецепторов млекопитающих, обозначенных аббревиатурами от TLR1 до TLR13, которые связывают различные
лиганды и продуцируются в организме различными типами клеток. У человека существует 10 толл-подобных рецепторов (от TLR1 до TLR10). Было показано, что TLR4 играет важную роль в патогенезе ЭМ. В эктопическом эндометрии экспрессия TLR4 гораздо выше, чем в нормальном.
У женщин с ЭМ в эндометрии можно выявить повышенные уровни аутоантител к антигенам эндометрия (иммуноглобулинам G – IgG и IgA) и лимфоцитов. Недавно было показано, что у таких пациенток значительно снижается синтез лигандов эндометрия к L-селектину – белку, который расположен на поверхности бластоцисты и обеспечивает удержание и нидацию эмбриона в эндометрий [40]. Также накапливаются сведения о мутациях и изменении экспрессии некоторых генов как в эктопическом, так и в нормальном эндометрии в различные фазы цикла.
показал, что у пациенток с ЭМ частота наступления беременности почти в 2 раза ниже, чем у женщин с трубноперитонеальным бесплодием [7]. Невысокие показатели экстракорпорального оплодотворения (ЭКО) при ЭМ связывают с более низким овариальным резервом, худшим качеством ооцитов и эмбрионов и нарушениями имплантации [45, 47].
Обследования пациенток с эндометриозом
случаях обследование должно включать сбор анамнеза (возраст менархе, характеристики менструального цикла, предыдущие беременности и их исходы, использование гормональной терапии, хирургический анамнез, семейный анамнез, касающийся ЭМ или гинекологических раков), физикальный осмотр (бимануальный и ректовагинальный, более информативны во время менструации) и визуализационные методы исследования: трансвагинальное ультразвуковое исследование (УЗИ), при необходимости – магнитно-резонансная томография, ректальное УЗИ, цистоскопия, колоноскопия. По рекомендациям Канадского руководства по ЭМ (2010), рутинное тестирование на СА-125 как часть диагностического исследования ЭМ выполняться не должно, хотя уровень СА-125 в сыворотке крови может быть несколько повышен при умеренных и тяжелых формах ЭМ [34].Результаты мета-анализа 23 исследований, в которых изучались уровни СА-125 в сыворотке крови у женщин
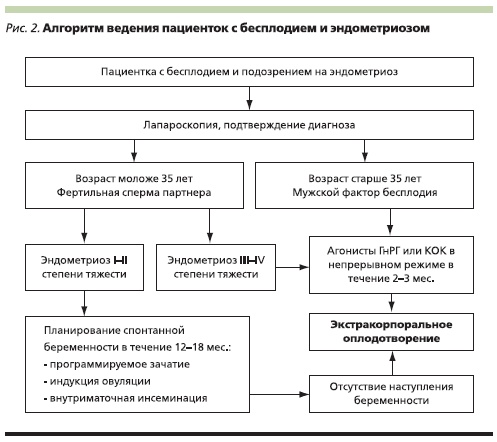
Лечение бесплодия при эндометриозе
Тактика ведения пациенток моложе 35 лет при фертильной сперме партнера
что подавление функции яичников для повышения фертильности при минимальных и умеренных формах ЭМ не эффективно. Национальные руководства разных стран – США (ASRM – American Society for Reproductive Medicine, 2006), Канады (2010), Британии (RCOG – Royal College of Obstetricians and Gynaecologists, 2006), Европы (ESHRE – European Society of Human Reproduction and Embryology, пересмотр 2008), России (Национальное руководство, 2011) не рекомендуют назначать гормональное
лечение с целью восстановления фертильности [2, 34, 41].
очагов с подлежащей брюшиной считается предпочтительным. На данный момент эффективность антибактериальных препаратов, кортикостероидов, нестероидных противовоспалительных средств и фибринолитиков в отношении профилактики развития спаек после хирургического лечения не подтверждена. Противоспаечные барьеры потенциально полезны. По данным некоторых клинических исследований, они снижают частоту формирования спаек, однако необходимы дальнейшие исследования, направленные на поиск более эффективных профилактических веществ, т. к. пока нет
данных об улучшении фертильности при использовании этих веществ [15].
Гормональная терапия лишь продлевает временнóй промежуток, отведенный на лечение, и задерживает наступление беременности.
нескольких неудачных циклов рекомендуется переходить к лечению с помощью ВРТ (ESHRE, пересмотр 2008).
хирургического лечения ЭМ умеренной и тяжелой степеней на частоту наступления беременности отсутствуют. Результаты трех нерандомизированных исследований свидетельствуют о существовании обратной связи между тяжестью болезни и частотой спонтанной беременности после хирургического лечения ЭМ, хотя статистическая значимость была достигнута только в одном исследовании [1]. Положительное влияние хирургического лечения глубоких инфильтративных форм ЭМ, в т. ч. ректовагинального, на сегодняшний день не доказано [49]. Вследствие этого большинство национальных руководств (канадских, американских, европейских) при ЭМ III–IV степеней тяжести рекомендуют после оперативного лечения переходить на программы ВРТ [1]. Некоторые авторы рекомендуют сразу направлять пациенток на ЭКО при подозрении на тяжелые формы ЭМ без предшествующего оперативного лечения [3].
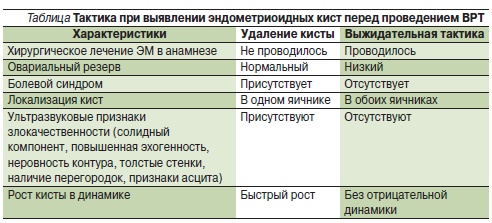
отметить отсутствие консенсуса касательно метода лечения ЭМК яичников у пациенток с бесплодием. Наличие ЭМК у женщин, планирующих лечение методом ВМИ или ЭКО, предположительно отрицательно влияет на результаты этих методов лечения, хотя литературные источники не предлагают единого мнения по данному вопросу [5, 37]. Преимуществом хирургического лечения кисты перед проведением ВМИ или ЭКО является получение гистологического диагноза. Недостатком является утрата овариальной ткани, окружающей кисту и содержащей фолликулы, что приводит к снижению овариального резерва и плохому ответу яичников на стимуляцию.
3 см не дает преимуществ по частоте наступления беременности по сравнению с выжидательной тактикой [8]. Все иностранные руководства по ЭМ рекомендуют удалять ЭМК размером более 3–4 см [1]. Это позволяет получать информацию об удаляемых тканях, может препятствовать развитию злокачественных опухолей, ослаблять тазовые боли и уменьшать дискомфорт при половом акте, снижать риск разрывов кист и перекрута придатков матки, облегчать трансвагинальный доступ к фолликулам в яичниках и, возможно, улучшать ответную реакцию яичников на стимуляцию [34]. В случае рецидива ЭМК, если хирургическое лечение ранее уже проводилось, тактика должна быть пересмотрена. Так как риск малигнизации низок и нет свидетельств об улучшении фертильности в результате проведенного лечения, а риск критической потери фолликулярного аппарата после операции повышается, решение о повторном хирургическом лечении должно быть основано на оценке симптомов и размере кисты: чем значительнее боль или больше размер образования, тем более вероятна потребность в повторном хирургическом вмешательстве (Канадское руководство по эндометриозу, 2010).
сохраняются рекомендации по проведению экономных операций, ставящих задачей удалить кисту с минимальным повреждением здоровой ткани яичников независимо от размера эндометриомы, хотя и обсуждаются тенденции по выжидательной тактике при небольших кистах [2].
Тактика ведения пациенток старше 35 лет при сопутствующих факторах бесплодия
Особенности программ ВРТ у пациенток с эндометриозом
как правило, сопровождается более выраженным болевым синдромом. Раздражение брюшины после пункции фолликулов требует более пристального внимания и более частого проведения дифференциальной диагностики с внутрибрюшным кровотечением. Эффективность программ ВРТ у таких пациенток ниже, чем при других заболеваниях.
После корректировки данных оказалось, что пациентки с ЭМ, прошедшие лечение методом ЭКО, имеют на 35 % меньше шансов забеременеть (отношение шансов – 0,63; 95 % доверительный интервал [ДИ] – 0,51–0,77). Прочие параметры, такие как пиковая концентрация эстрадиола, среднее число полученных ооцитов, частота оплодотворения, частота имплантации, также были значимо ниже у женщин с ЭМ по сравнению с пациентками с трубно-перитонеальным бесплодием. Исходя из этого, можно предположить, что наличие ЭМ оказывает влияние на многочисленные факторы, определяющие положительный исход применения метода ЭКО.
ЭМ, можно проанализировать данные, полученные из программ ЭКО с донорскими ооцитами. Исследование, в котором были проанализированы результаты 170 доноров ооцитов, не показало статистически значимых результатов, а только тенденцию к более низкой частоте имплантации у реципиентов, если у донора был ЭМ, а также тенденцию к более низкой частоте имплантации у реципиентов, больных ЭМ, что подтвердило влияние ЭМ на эндометрий и качество ооцитов [30]. Однако для окончательных выводов требуется проведение более крупных исследований.
ЭКО. Частота наступления клинической беременности оказалась намного (почти в 4 раза) выше у тех пациенток, которые в течение 3–6 месяцев перед программой ЭКО получали агонисты гонадотропинилизинг-гормонов (ГнРГ) для подавления функции яичников (относительный риск = 4,28, 95 % ДИ – 2,0–9,15). Однако при длительной подготовке агонистами ГнРГ наблюдается выраженное подавление функции яичников, что проявляется увеличением потребности в гонадотропинах во время стимуляции, медленным ростом фолликулов и эндометрия. В связи с этим канадские и российские руководства рекомендуют проводить супрессивную терапию не более 3 месяцев [2, 34]. По данным
Канадского руководства по ЭМ, подавление функции яичников с помощью агонистов ГнРГ в комбинации с возвратной гормональной терапией перед программой ЭКО у женщин с тазовой болью, ЭМ и бесплодием, значительно улучшает качество жизни и уменьшает дискомфорт во время стимуляции яичников и пункции фолликулов [34].
оральные контрацептивы (КОК) или прогестины. De Ziegler и соавт. показали, что использование КОК в течение 6–8 недель в непрерывном режиме [16] позволяет женщинам с ЭМ добиваться результатов, сопоставимых с таковыми для пациенток без ЭМ, а доза гонадотропинов на последующую стимуляцию при этом была ниже.
ЭМ [36]. Японские исследователи [52] также показали, что диеногест ингибирует экспрессию ароматазы и циклооксигеназы-2, что приводит к сниже-нию выработки простагландинов Е2, которые играют негативную роль при ЭМ (способствуют синтезу эстрогенов, подавляют апоптоз и способствуют
клеточной пролиферации за счет фактора роста фибробластов-8) [42].
влиянии на минеральную плотность костной ткани. Оценка эффективности в лечении ЭМ в исследованиях, вошедших в мета-анализ, проводилась по выраженности болевого синдрома (дисменореи, диспареунии и хронической тазовой боли) [21]. Влияние диеногеста на репродуктивные исходы оценивалось в многоцентровом РКИ M. Cosson и соавт. [14]. После хирургического лечения ЭМ 59 пациенток в течение 16 недель получали диеногест, а 61 женщина – трипторелин в виде депо по 3,75 мг ежемесячно. До лечения 86 пациенток предъявляли жалобы на бесплодие (45 в группе диеногеста и 41 в группе трипторелина). В группе диеногеста беременность наступила в 33 % случаев и завершилась родами для 13 из 15 женщин. В группе трипторелина забеременели 29 % пациенток и родили 9 из 12. Общая частота родов в группе диеногеста составила 29 %, а в группе трипторелина – 22 %. Разница между группами свидетельствует в пользу диеногеста, но была статистически недостоверной. Таким образом, и в случаях бесплодия диеногест не уступал агонистам ГнРГ, при этом он не увеличивал риск самопроизвольных абортов. Исследований об использовании диеногеста перед ЭКО пока нет, однако схожая эффективность диеногеста и агонистов ГнРГ позволяет рассматривать этот гестаген в качестве возможной альтернативы при подготовке к программам ВРТ. Результаты сравнительных исследований позволят сделать окончательные выводы о целесообразности такого подхода.
Какой протокол индукции суперовуляции использовать при эндометриозе?
ЭКО/ИКСИ (от англ. ICSI — Intra Cytoplasmic Sperm Injection) одинаково эффективна при использовании протоколов с агонистами как ГнРГ, так и ГнРГ в отношении имплантации и частоты наступления клинической беременности. Однако предпочтение все же должно быть отдано протоколам с агонистами ГнРГ из-за большего количества получаемых ооцитов в фазе MII и эмбрионов [38] (уровень доказательности 1b).
хорошего качества. Частота наступления клинической беременности и частота имплантации в данных группах были сопоставимыми, однако исследование не обладало достаточной мощностью для оценки данных параметров [38].
Заключение
ЭМ может закончиться многократными попытками ЭКО. Тактика ведения таких пациенток также очень вариабельна. В нашей стране приветствуется индивидуальный подход к лечению той или иной нозологии, но в то же время нельзя терять драгоценное время, которое так важно, когда речь
идет о репродуктивной функции женщины.
в зависимости от клинической ситуации, пока качество ооцитов позволяет добиваться наступления такой желанной беременности.


