Ожирение и ассоциированный с ним метаболический синдром (МС), по определению экспертов ВОЗ “…пандемия XXI века”, – интернациональная проблема в современном мире. По данным ВОЗ,
с 1980 г. число лиц во всем мире, страдающих ожирением, более чем удвоилось, а в 2008 г. уже 1,5 млрд взрослых людей в возрасте 20 лет и старше страдали от избыточной массы тела. Из этого числа свыше 200 млн лиц мужского пола и почти 300 млн лиц женского пола имели ожирение. В 2010 г.
почти 43 млн детей в возрасте до 5 лет имели избыточную массу тела.
Шестьдесят пять процентов населения нашей планеты проживают в странах, где избыточная масса тела и ожирение приводят к смерти бóльшее, чем пониженная масса тела, число людей. На клинико-стратегическом уровне избыточная масса тела и ожирение относятся к числу пяти основных факторов риска смерти. Каждый год в мире умирают 2,8 млн взрослых людей по причине избыточной массы тела
или ожирения.
Кроме того, 44 % случаев диабета, 23 % случаев ишемической болезни сердца и от 7 до 41 % случаев онкологических заболеваний обусловлены избыточной массой тела и ожирением [10].
Избыточная масса тела и ожирение определяются как аномальные и излишние жировые отложения, которые могут нанести ущерб здоровью. Жировая ткань – это не просто пассивный накопитель жира, “аккумулятор энергии”, она является активным ауто-, пара- и эндокринным органом, способным синтезировать и секретировать в кровоток различные биологически активные соединения пептидной и непептидной природы, которые играют важную роль в гомеокинезе сердечно-сосудистой системы. Адипоциты – функциональные единицы жировой ткани синтезируют лептин, ангиотензиноген, инсулиноподобный фактор роста-1 (ИФР-1), фактор некроза опухолей α (ФНО-α), ингибитор активатора плазминогена-1 (ИАП-1), интерлейкин-6 (ИЛ-6), которые являются ключевым фактором формирования артериальной гипертензии (АГ) и атеросклероза.
Индекс массы тела (ИМТ), используемый в качестве оценки избыточной массы тела или классификации ожирения, рассчитывается как отношение массы тела в килограммах к квадрату роста в метрах (кг/м2). По определению ВОЗ, ИМТ больше или равен 25 кг/м2 – избыточная масса тела, ИМТ больше или равен 30 кг/м2 – ожирение. ИМТ является наиболее удобной мерой оценки уровня ожирения и избыточной массы тела человека, поскольку он одинаков для обоих полов и всех возрастных категорий взрослых. Однако ИМТ следует считать приблизительным критерием, т. к. он может не соответствовать одинаковой степени упитанности и типа ожирения для различных индивидуумов.
Увеличение массы тела выше нормативной (норма ИМТ < 25 кг/м2) на 1 кг на 9 % повышает риск развития нарушения толерантности к глюкозе (НТГ) – предшественника сахарного диабета 2 типа (СД2). И наоборот, потеря массы тела у больного СД2 с ожирением сопровождается снижением риска
сердечно-сосудистых заболеваний на 28 % и смертности на 25 %.
В настоящее время терапевтические цели лечения СД2, ассоциированного с ожирением, расшились. В связи с высоким риском развития макро- и микрососудистых осложнений учитываются не только показатели углеводного обмена но и липидного спектра крови. Поэтому основные задачи лечения больных СД2 с избыточной массой тела заключаются в снижении массы тела, нормализации уровня гликемии, уровней липидов и артериального давления (АД). В табл. 1 представлены терапевтические цели при МС, ассоциированном с ожирением, НТГ и/или СД2 [1–8].
Таблица 1. Показатели углеводного и липидного обменов при МС, ассоциированном с ожирением, НТГ и/или СД2.
Для достижения компенсации углеводного обмена врачи используют в клинической практике шесть классов пероральных сахароснижающих лекарственных препаратов с различными механизмами действия: производные сульфонилмочевины (глибенкламид, гликлазид), бигуаниды (метформин),
тиазолидиндионы (пиоглитазон, росиглитазон), ингибиторы α-глюкозидазы (акарбоза), ингибиторы дипептидилпептидазы-4 (ситаглиптин, вилдаглиптин), инкретин миметики (эксенатид).
Сахарный диабет 2 типа – хроническое заболевание с тенденцией к прогрессированию, эффективность монотерапии со временем снижается, что обусловливает необходимость использования комбинаций из вышеперечисленных препаратов и разновидности инсулина. Эффективность коррекции гипергликемии контролируется достижением целевого уровня гликированного гемоглобина (HbA1c) < 7,0 %.
Для некоторых гипогликемических препаратов (инсулина, производных сульфонилмочевины, тиазолидиндионов) одним из побочных эффектов является увеличение массы тела на фоне улучшения углеводного профиля крови из расчета плюс 2 кг на 1 % снижения уровня HbA1c .К другим нежелательным клиническим эффектам этих средств относятся эпизоды гликемии и отеки, что снижает их терапевтическую ценность.
В последние годы появилась новая группа препаратов для лечения НТГ и СД2 – инкретиномиметики.
Инкретины – эндогенные инсулинотропные пептиды: глюкагоноподобный пептид-1 (ГПП-1) и глюкагонозависимый инсулинотропный пептид (ГИП). Эти эндокринотропные пептиды высвобождаются в ответ на прием пищи и находятся под контролем нейронных и эндокринных стимулов. Эти инкретины различными путями оказывают стимулирующее влияние в первую очередь на β-клетки поджелудочной железы, активируя секрецию инсулина [2, 4, 9].
В 1964 г. Elrick и соавт. описали “инкретиновый эффект”, в результате которого секреция инсулина в ответ на пероральный прием глюкозы значительно превышает секрецию инсулина β-клетками поджелудочной железы в ответ на внутривенное введение того же количества глюкозы. В клинических исследованиях установлено, что вышеописанные инкретиновые пептиды, вырабатываемые в клетках кишечника, ответственны за 60–70 % постпрандиальной секреции инсулина у здоровых пациентов. Именно этот вклад в секрецию инсулина и называют “инкретиновым эффектом”.
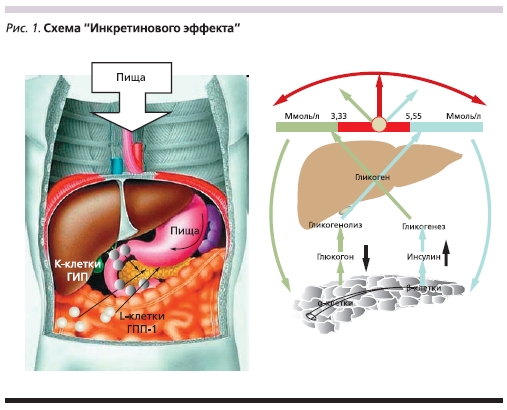
Инкретины – гормоноподобные пептиды, синтезируются преимущественно в тонком кишечнике: ГИП
секретируется К-клетками двенадцатиперстной и тощей кишки в ответ на прием пищи, богатой углеводами и жирами, ГПП-1 секретируется L-клетками подвздошной и начальными отделами толстой кишки (рис. 1). Хотя ГИП и ГПП-1 оказывают схожее действие – усиливают постпрандиальную секрецию инсулина, между этими инкретиновыми гормонами существуют различия в биологических воздействиях на углеводный и липидный метаболизм. Точкой приложения ГИП являются β-клетки поджелудочной железы: активизируется глюкозозависимая секреция инсулина, повышается их пролиферация и жизнеспособность. В экспериментах in vivo под действием ГИП в β-клетках поджелудочной железы усиливаются транскрипция гена и биосинтез инсулина.
ГПП-1 оказывает панкреатические (через взаимодействие со специфическими рецепторами на мембране β-клеток поджелудочной железы) и внепанкреатические биологические (через взаимодействие с рецепторами, тропными к ГПП-1) эффекты в жировой ткани (адипоцитах), сердце, головном мозге, коре надпочечников. При взаимодействии ГПП-1 с β-клетками поджелудочной железы запускается пострецепторный внутриклеточный каскад: повышаются концентрации цАМФ и Са в цитоплазме, активизируется протеинкиназа А и экзоцитоз инсулинсодержащих гранул. ГПП-1 контролирует функциональное состояние внутриклеточных транспортеров глюкозы (ГЛЮТы 1–4) и гена проинсулина, что суммарно увеличивает периферическую утилизацию глюкозы и усиливает транскрипцию гена инсулина. В экспериментах на животных и in vivo ГПП-1 снижает скорость апоптоза β-клеток в изолированных клеточных культурах за счет уменьшения фрагментации ДНК, стимулирует неогенез β-клеток, способствует пролиферации островковых клеток из стволовых клеток
поджелудочной железы, что суммарно приводит к увеличению массы β-клеток. Восстановление клеточной массы поджелудочной железы – наиболее значимый биологический эффект ГПП-1.
Помимо глюкозозависимой активации секреции инсулина ГПП-1 оказывает глюкозозависимую супрессию глюкагона в постпрандиальном периоде и снижает гликогенолиз без развития гипогликемии. В свою очередь ГИП участвует в метаболизме липидов адипоцитов – функциональных единицах жировой ткани.
К числу внепанкреатических эффектов ГПП-1 относится снижение скорости поступления пищи из желудка в кишечник, что сопровождается уменьшением подъема концентрации ГИП с подавлением аппетита, ускорением чувства насыщения, уменьшением потребности в приеме жидкостей и снижением массы тела. Кроме того, ГПП-1 оказывает прямое протективное действие на миокард при ишемических состояниях.
ГПП-1 и ГИП – коротко живущие биологически активные аминокислотные соединения с периодами полужизни от 1 до 2 минут для ГПП-1 и до 5–6 минут для ГПП. Инкретины быстро разрушаются под действием фермента дипептидилпептидазы-4 (ДПП-4). ДПП-4 расщепляет белки, которые содержатся в структуре аланина во второй позиции, что приводит к утрате биологической активности инкретинов. ДПП-4 расположены во многих тканях организма человека: головном мозге, легких, почках, надпочечниках, поджелудочной железе, кишечнике, лимфоцитах. Многие нейропептиды, цитокины, химокины, факторы клеточного роста являются потенциальными субстратами для ДДП-4.
ДПП-4 – фермент, cекретируемый клетками расположенных в эндотелии сосудов слизистой оболочки кишечника, где локализуются L-клетки, непосредственно на месте инактивируют ГПП-1, что и определяет короткий период его полужизни.
Использование нативного ГПП-1 в клинической практике при лечении НТГ или СД2 невозможно из-за его быстрой деградации. В связи с этим был создан длительно действующий аналог ГПП-1 – миметик инкретинов эксенатид (Баета), который обладает всеми свойствами нативного ГПП-1, но устойчив к энзиматическому действию ДПП-4. Эксенатид выделен из слюны ящерицы Gila Monster. Устойчивость ГПП-1 от рептилии обусловлена удлинением цепочки аминокислот до 39 компонентов, в то время
как человеческий нативный ГПП-1 имеет 36 аминокислотных компонентов [2, 5, 6, 8].
Эксенатид при взаимодействии с чувствительными рецепторами ГПП-1 разных тканей вызывает идентичные эффекты нативного ГПП-1. Эксенатид, оказывая инсулинотропное глюкозозависимое действие на β-клетки поджелудочной железы, одновременно активирует как 1-ю (0–10-я минуты)
так и 2-ю (10–120-я минуты) фазы секреции инсулина. При достижении нормогликемии (5 ммоль/л) секреция инсулина снижается и риск развития гипогликемии практически отсутствует.
Одновременно эксенатид оказывает супрессивное действие на α-клетки поджелудочной железы, что сопровождается снижением тощаковой и постпрандиальной секреции глюкагона. При этом биологические эффекты эксенатида нейтральны при наличии гипогликемии [5, 8].
Клиническое внепанкреатическое действие эксенатида манифестируется замедлением пассажа жидкой и твердой пищи из желудочно-кишечного тракта на 1,3 и 1,8 часа соответственно, что приводит к уменьшению потребности в приеме пищи.
Таким образом, все вышеизложенное явилось поводом для проведения исследования, целью которого явилась оценка эффективности инкретинового эффекта гликемического контроля у больных на ранних этапах МС (ИМТ ≥ 25 кг/м2).
Материал и методы
Были отобраны и обследованы 69 пациентов в возрасте от 20 до 55 лет:из них 54 пациента с ИМТ ≥ 25 кг/м2 – исследуемая группа и 15 практически здоровых лиц с ИМТ < 25 кг/м2 – контрольная группа. В группе исследования были 23 мужчины и 31 женщина в возрасте от 20 до 55 лет, средний возраст составил 43,3 ± 4,7 года, в группе контроля – 5 мужчин и 10 женщин в возрасте от 20 до 50 лет (средний возраст по группе – 44,5 ± 3,5 года). После проведенного обследования пациентам был регламентирован режим питания и диеты, направленные на снижение массы тела. Основу рациона питания составили кисломолочные продукты, птица, рыба, мясо и грубоволокнистые овощи. Содержание холестерина в рекомендуемых продуктах не учитывалось.
Пациентам с НТГ (43 человека) в качестве сахаропонижающего препарата был назначен эксенатид (Баета) 10 мкг 2 раза в сутки. У 7 больных СД2 эксенатид сочетался с метформином в дозе 1 г/сут. Одновременно на протяжении всего периода наблюдения всем пациентам в качестве гиполипидемической терапии был назначен фенофибрат Трайкор 145 мг 1 раз/сут, а в качестве антиоксиданта были включены коэнзим Q10 60 мг + витамин Е 9 мг/сут. При исходной гипомагниемии (Mg++ ≤ 0,6 ммоль/л) одновременно внутривенно капельно в течение первых 15 дней вводили сульфат
магния из расчета 0,5–0,6 г/ч (до 5–6 г/сут) с последующим переходом на магния оротат 3 г/сут перорально. Двенадцати пациентам с АГ был добавлен бисопролол от 1,25 до 2,5 мг/сут.
Обследование отобранных пациентов с ожирением включало лабораторную диагностику: общий и биохимический анализ крови с липидограммой; пероральный тест на толерантность к глюкозе (ПТТГ) с определением уровня гликемии натощак через 30, 60 и 120 минут; определение уровня иммунореактивного инсулина и С-пептида в плазме крови натощак, через 30, 60 и 120 минут после
нагрузки глюкозой; вычисление индекса инсулинорезистентности (HOMOIR);определение уровня HbA1c; определение концентрации магния в плазме крови. Определение индекса HOMO IR обследованных больных проводили по методу HOMA (HOmeostasis Model Assessment), предложенному D.M. Matthews и соавт. (1985):

Об инсулинорезистентности говорили при HOMO IR > 2,77 [7].
Активность процессов перекисного окисления липидов (ПОЛ) оценивали по уровню концентрации продуктов их деградации – малонового деальдегита (МДА) с помощью реактивов “Агат-Мед” (Москва, Россия) спектрофотометрическим методом при длине волны 532 нм на спектрофотометре СФ 26 (референтные значения МДА ≤ 4,8 мкмоль/л).
Результаты исследования
В зависимости от результатов ПГТТ пациенты исследуемой группы были распределены на 3 подгруппы по критериям Американской ассоциации диабета:
1-я подгруппа – без нарушений углеводного обмена (уровень глюкозы в крови через 2 часа после нагрузки < 7,8 ммоль/л) – 7 пациентов;
2-я подгруппа – группа с НТГ (7,8 ммоль/л ≤ глюкоза в крови через 2 часа после нагрузки < 11 ммоль/л) – 34 пациента;
3-я подгруппа с впервые выявленным СД2 (уровень глюкозы в крови через 2 часа после нагрузки > 11 ммоль/л) – 13 пациентов (табл. 2).
Таблица 2. Распределение пациентов в подгруппах по возрасту и ИМТ.
Как видно из табл. 2, средний возраст пациентов 1-й подгруппы (без нарушений углеводного обмена) был на 10 лет меньше, чем в двух других подгруппах, что подтверждает известное положение – возраст играет детерминирующую роль в реализации клинических проявлений ИР, формирующих МС, уровень которого нарастал по подгруппам. Повторное обследование проведено через 4, 12 и 24 недели от начала лечения. Результаты обследования и лечения в конечной точке представлены в
табл. 3.
Таблица 3. Результаты обследования и лечения.
Как видно из табл. 3, исследуемая группа (ИМТ > 25 кг/м2) значительно (статистически достоверно) отличалась от контрольной (ИМТ < 25 кг/м2) по всем параметрам клинического и лабораторного обследований. Относительная нормализация уровня тощаковой гликемии – 5,1 ± 0,1 ммоль/л в исследуемой группе на фоне ИР поддерживалась компенсаторной гиперинсулинемией – ИРИ = 13,1 ± 1,1 мкМЕ/мл, что превышало контрольную величину (2,5 ± 0,4 мкМЕ/мл) пропорционально ИР в
6 раз. Наличие ИР в группе исследования было документировано расчетом HOMA IR, который в различной степени выраженности встречался в 100 % случаев, в среднем по группе составил 3,0 ± 0,2 и превысил аналогичный показатель контрольной группы (0,52 ± 0,12) практически в 6 раз.
Наличие латентной гипергликемии в исследуемой группе манифестировалось увеличением уровня HbA1c до 6,6 ± 0,3 %, что статистически достоверно (p < 0,01) превышало аналогичный показатель в контрольной группе (5,1 ± 0,2 %) на 29,4 %.
Ранее, по данным различных авторов, при анализе клинического опыта ведения больных МС выявлена реверсия (взаимовлияние) между “дефицитом магния” и ИР [15]. Гипомагнезиемия усугубляет ИР, в свою очередь ИР способствует снижению внутриклеточной концентрации Mg, что согласуется с результатами нашего исследования.
В нашем исследовании формирование избыточной массы тела – ИМТ ≥ 25 кг/м2 – в 68,1 % случаев сопровождается гипомагниемией (Mg сыворотки < 0,65 ммоль/л): в исследуемой группе пациентов уровень магния в сыворотке крови в среднем составил 0,59 ± 0,02 ммоль/л и был статистически достоверно ниже, чем в контрольной группе, на 30,6 % (p < 0,01), что способствовало формированию ИР и активации “оксидативного стресса”, документируемой статистически достоверным увеличением МДА (маркер ПОЛ) на 36,1 % (p < 0,01) по отношению к контрольной группе.
Одновременно выявлено, что по мере увеличения возраста и ИМТ “дефицит магния” нарастает и чаще
встречается среди пациентов старше 40 лет, а при ИМТ ≥ 35 кг/м2 гипомагнезиемия (Mg сыворотка = 0,57 ± 0,01 ммоль/л) имеет место в 100 % случаев.
Как видно из табл. 3, к концу комплексного лечения в целом по группе были достигнуты целевые уровни АД (120,7 ± 5,8/75,8 ± 3,8 мм рт. ст.) со статистически достоверным снижением ИМТ в среднем на 8,5 % – от 32,7 ± 0,8 до 29,9 ± 0,5 кг/м2 (p < 0,05).
На фоне снижения ИМТ восстановление чувствительности инсулиновых рецепторов, документируемое статистически достоверным снижением HOMA IR на 43,3 % (от 3,0 ± 0,2 до 1,7 ± 0,1, p < 0,001) и концентрации тощакового ИРИ на 40,5 % (от 13,1 ± 1,1 до 7,8 ± 1,1 мкМЕ/мл, p < 0,01), сопровождалось нормализацией гликемического профиля: концентрация глюкозы натощак уменьшилась на 3,9 % и HbA1c % – на 10,8 % (p < 0,05). При суточном мониторировании гликемического профиля (CGMS – Continuous Glucose Monitoring System) к концу контрольного исследования (24 недели) отмечено практически полное отсутствие эпизодов гипергликемических
постпрандиальных эпизодов, документируемое при графическом анализе, что также способствовало снижению уровня HbA1c (рис. 2).
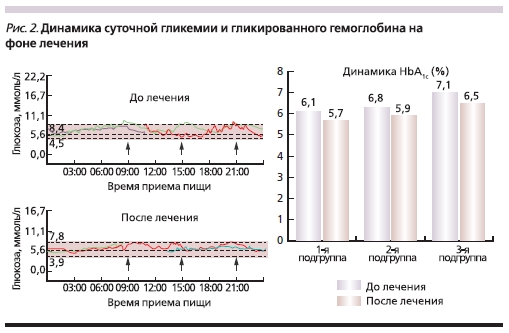
К концу лечения в целом по группе отмечено статистически достоверное изменение со стороны метаболизма липидов в сторону антиатерогенности: ИА – интегральный показатель липидного спектра крови статистически достоверно снизился на 24,8 % (p < 0,01).
Заключение
Таким образом, МС имеет стадийность развития: от латентной формы инсулинорезистентности на ранних этапах развития ожирения, проявляемой при ПТТГ, последовательно проходит через стадию НТГ с последующим развитием СД2.
Суточное мониторирование уровней гликемии позволяет объективно оценивать характер и уровни колебаний гликемического профиля, корректно определять режим и характер питания, алгоритм лечения МС лекарственными препаратами на ранних этапах его развития – инкретиномиметики (эксенатид) в сочетании с антиоксидантами и препаратами магния, добиваться эффективной антигипертензивной терапии и предупреждать сосудистые осложнения при этой патологии.


