Неалкогольной жировой болезни печени (НАЖБП) в настоящее время уделяется большое внимание в связи с ростом распространенности основных предикторов этой патологии – ожирения и сахарного диабета (СД), принимающих характер эпидемии в развитых странах мира [1, 2]. Отложение липидов в печени является первым этапом развития НАЖБП, которое может приводить к развитию эффекта липотоксичности, инициации воспаления и прогрессированию заболевания [3, 4]. Возникновение НАЖБП ассоциировано с риском развития сердечнососудистой патологии и уменьшением продолжительности жизни пациентов [5, 6]. В связи с этим основные детерминанты, в т. ч. эпидемиологические аспекты, патогенез и принципы лечения этого заболевания, продолжают уточняться.
С нашей точки зрения, большой интерес представляют результаты эпидемиологического исследования НАЖБП в России, при регистрации получившего наименование по протоколу DIREG_L_01903 [7]. Исследование осуществлялось в 16 городах страны. Всего обследовано 30 417 человек в возрасте от 18 до 80 лет (13 209 мужчин, 17 208 женщин). Средний возраст пациентов был равен 47,8 года. НАЖБП диагностировалась с помощью критериев, примененных в итальянском исследовании Dionysos [8].
Таблица.Факторы риска НАЖБП у населения России.
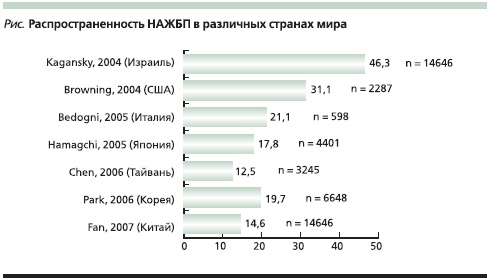
Распространенность НАЖБП у взрослого городского населения России составила 27,0 %. Распространенность стеатоза печени составила 21,7 %; неалкогольного стеатогепатита (НАСГ) – 4,5 %; цирроза печени – 0,8 %. Обращает на себя внимание такой факт: в анамнезе у обследованных пациентов встречаемость НАЖБП составила только 1,0 %, что свидетельствует прежде всего о недостаточной осведомленности врачей и пациентов о сущности и критериях диагностики данного заболевания. Ведущими факторами риска НАЖБП у населения России являлись метаболический синдром и его компоненты: абдоминальное ожирение, гипертриглицеридемия, гипергликемия и СД 2 типа, артериальная гипертензия (см. таблицу). Распространенность НАЖБП в России не имела существенных отличий от аналогичных показателей в других странах мира (см. рисунок).
Патогенез НАЖБП в настоящее время наиболее адекватно объясняется теорией двух ступеней [2]. На первой ступени происходит накопление триглицеридов, насыщенных жирных кислот (ЖК) и свободного холестерина в печени. На второй ступени прежде всего свободные ЖК и свободный холестерин реализуют эффект липотоксичности [9]. Насыщенные ЖК влияют на Fas-рецепторы и за счет этого стимулируют апоптоз гепатоцитов, что в свою очередь вызывает повреждение печени [10]. Важнейшим механизмом, обусловливающим переход от стеатоза к стеатогепатиту, является митохондриальная дисфункция [11]. Она заключается в активации каспазы, снижении митохондриального трансмембранного потенциала, продукции свободных радикалов и снижении митохондриальных структурных взаимодействий[12]. Хотя взаимосвязь между митохондриальной дисфункцией и прогрессированием НАЖБП хорошо задокументирована, молекулярные механизмы этого процесса по-прежнему недостаточно ясны. Сейчас большое значение в инициации митохондриальной дисфункции придается насыщенным ЖК [13] и свободному холестерину [14]. Среди факторов риска НАЖБП выделяют в первую очередь диету с высоким содержанием насыщенных жиров, низким содержанием антиоксидантов и ненасыщенных ЖК [15]. Другим важным комплексом факторов риска является генетическая предрасположенность, которая проявляется в виде полиморфизма генов, кодирующих транспортный микросомальный белок триглицеридов, фосфатидилэтаноламинтрансферазу, супероксиддисмутазу-2, фактор некроза опухоли α [16].
Лечение НАЖБП включает мероприятия по снижению веса, применение инсулиновых сенситайзеров, назначение гепатопротекторов и антиоксидантов. Лечение ожирения – это рациональная цель для терапии НАЖБП, т. к. снижение веса уменьшает/ослабляет большинство факторов повреждения печени, включая инсулинорезистентность, содержание жирных кислот в печени и выработку провоспалительных и профибротических адипокинов. Высокое содержание насыщенных жиров и мяса в диете повышает инсулинорезистентность, а высокое содержание ненасыщенных жиров и клетчатки снижает ее у пациентов с НАЖБП [15]. Показано, что снижение веса приводит к снижению инсулинорезистентности и улучшению клинического течения НАСГ [17]. В последнее время становятся все более активными попытки применения бариатрической хирургии для улучшения течения НАЖБП [18].
Большое внимание в развитии терапии НАЖБП уделяется инсулиновым сенситайзерам. Применение метформина в течение 12 месяцев у пациентов с НАЖБП без СД в дозе 2 г в день ассоциировалось с нормализацией аминотрансфераз и снижением содержания жира в печени [19]. Активно применяются в последнее время тиазолидиндионы. Плацебо-контролируемое исследование пиоглитазона показало отчетливое улучшение показателей стеатоза и воспаления у пациентов с НАСГ [20]. Мета-анализ, опубликованный в 2010 г., продемонстрировал отчетливую эффективность тиазолидиндионов в лечении НАСГ, тогда как эффективность метформина в сравнении с плацебо не была подтверждена [21].
На специальном симпозиуме, посвященном стеатогепатиту, проведенном в рамках Digestive Disease Week, состоявшемся в мае 2011 г. в Чикаго, C.K. Argo в качестве ведущих гепатопротекторов для лечения НАСГ назвал эссенциальные фосфолипиды и урсодеоксихолевую кислоту (УДХК). Фосфатидилхолин играет важнейшую роль в механизме обратного транспорта холестерина, участвуя в формировании липопротеидов, изменяет метаболизм простагландинов и арахидоновой кислоты, ослабляет воспаление в печени, восстанавливает активность S-аденозилметионинсинтетазы, снижает активацию звездчатых клеток и синтез коллагена. Доказательная база эффективности этого препарата весьма широка. В.В. Цуканов и соавт. применяли комбинацию гипокалорийной диеты, фосфатидилхолин в дозе 300 мг 4 раза в день и метформина в дозе850 мг 2 раза в день в течение 60 дней для лечения пациентов с НАСГ. Был получен отчетливый эффект, выраженный в снижении уровня АЛТ и нормализации показателей липидного обмена [22]. P. Andreone и соавт. в плацебо-контролируемом исследовании использовали сочетание фосфатидилхолина и силибинина для лечения 143 лиц с НАСГ в течение 12 месяцев. Авторы показали достоверное снижение уровня трансаминаз в группе пациентов, получавших фосфатидилхолин и силибинин по сравнению с группой плацебо [23]. L. Spadaro и соавт. установили отчетливое снижение выработки фактора некроза опухоли α у больных НАСГ в результате лечения полиненасыщенными ЖК [24].
В течение последнего года опубликовано два крупных плацебоконтролируемых исследования эффективности УДХК при лечении НАСГ. В первом из них 126 пациентов с морфологически подтвержденным НАСГ принимали высокие дозы УДХК (28–5 мг/кг/сут) или плацебо в течение одного года. Авторы продемонстрировали отчетливое снижение в группе получавших УДХК уровней АЛТ, γ-глутамилтранспептидазы, фибротеста и содержания глюкозы [25]. В другом плацебо-контролируемом исследовании 185 пациентов с морфологически верифицированным НАСГ получали высокие дозы УДХК (23–8 мг/кг/сут) в течение 18 месяцев. Уровень АЛТ и гистологические параметры не различались через 18 месяцев в группах, получавших УДХК и плацебо [26]. Возникает вопрос: как интерпретировать расхождения, полученные в этих работах? Анализировавшие эту ситуацию швейцарские авторы считают, что исследования эффективности желчных кислот необходимо продолжать. В настоящее время очевидно, что УДХК необходимо применять в высоких дозах, желательно в составе комбинированной терапии [27]. Систематически среди препаратов, применяющихся для лечения НАЖБП, упоминаются антиоксидантные средства. Отмечается возможное влияние на течение данной патологии витамина Е [28] и бетаина [29].
В целом, завершая данный обзор, необходимо подчеркнуть весьма высокую распространенность НАЖБП среди населения России и недостаточную осведомленность практических врачей о диагностике и принципах лечения этой патологии. Основными факторами риска НАЖБП являются ожирение, СД 2 типа, гиперлипидемия, метаболический синдром. Нелекарственными методами лечения НАЖБП – применение низкокалорийной диеты с достаточным количеством полиненасыщенных жиров и пищевых волокон, дозированных физических нагрузок с целью снижения веса. Среди лекарственных препаратов ведущие позиции занимают инсулиновые сенситайзеры, эссенциальные фосфолипиды, УДХК и антиоксиданты.
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО “Московский государственный
медико-стоматологический университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58, e-mail: proped@mail.ru;
Цуканов Владислав Владимирович – доктор медицинских наук, профессор, руководитель
гастроэнтерологического отделения, Учреждение РАМН НИИ медицинских проблем Севера СО РАМН.
Тел. 8 (391) 212-53-63, e-mail: gastro@impn.ru;
Лукичева Эллина Викторовна – врач КГБУЗ “Краевая клиническая больница”.
E-mail: ellinaq@yandex.ru;
Самсонов Алексей Андреевич – доктор медицинских наук, профессор кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО “Московский государственный
медико-стоматологический университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58, e-mail: aleksey.samsonov@gmail.com;
Васютин Александр Викторович – младший научный сотрудник гастроэнтерологического отделения,
Учреждение РАМН НИИ медицинских проблем Севера СО РАМН.
E-mail: alexander@kraslan.ru;
Никушкина Ирина Николаевна – доктор медицинских наук, профессор кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО “Московский государственный
медико-стоматологический университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58



