Судорогами называют непроизвольные мышечные сокращения, существенно различающиеся по продолжительности, интенсивности и локализации, этиологии и патогенезу. В зависимости от механизма развития выделяют эпилептические и неэпилептические судороги. Последние могут быть связаны с патологией центральной и периферической нервной системы. Хорошо известно, что развитию судорог способствуют нарушения минерального баланса: в частности гипомагнезиемия [1–11]. Дефицит магния часто не учитывают при анализе патофизиологии судорог различной этиологии. Между тем участие магния в нервно-мышечной работе убедительно доказано с помощью методов доказательной медицины и результатами эпидемиологических исследований [6, 13–15].
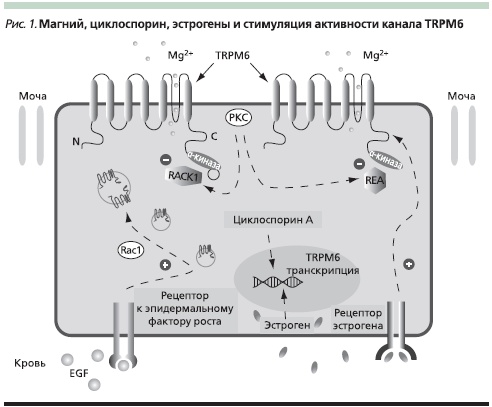
В исследованиях Wijst и соавт. (2009) установлено, что одним из основных регуляторов судорог, зависимых от уровня магния в крови, является магниевый канал TRPM6. На экспрессию этого гена влияют определенные гормоны (например, эстрогены) и определенные лекарства (например, циклоспорин), меняющие кислотно-основной баланс и способные повышать судорожную готовность и даже ее провоцировать (циклоспорин А). Длительный прием препаратов, содержащих эстрогены (средства для заместительной терапии и оральные контрацептивы), также провоцирует активность канала и усиливает потери магния, приводя к магнийдефицитным судорогам (рис. 1). Активность канала TRPM6 зависит от уровня внутриклеточного магния, рН и АТФ. Эпидермальный фактор роста и рецепторы эстрогенов тоже могут непосредственно стимулировать активность канала TRPM, который регулирует абсорбцию магния в дистальных канальцах почек. Активность канала также моделируется рядом белков (RACK1, REA, RAC1) [14].
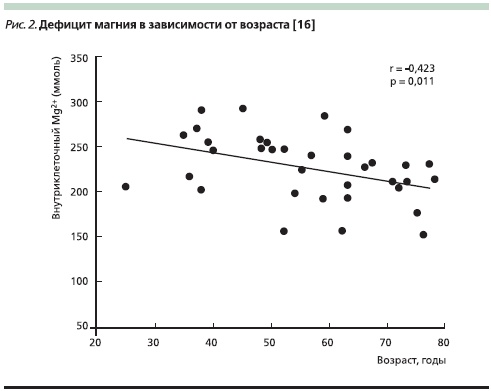
C возрастом в 2–3 раза увеличивается вероятность судорог икроножных мышц, подергиваний отдельных мышц спины и т. д., падает уровень магния (рис. 2). Основные механизмы снижения уровня магния с возрастом включают неадекватное его потребление, уменьшение абсорбции, что, возможно, связано с уменьшением потребления витамина D, увеличение потерь с мочой при приеме диуретиков и вследствие вышеперечисленных болезней пожилого возраста. Поэтому поддержание уровня магния на оптимальном уровне у пожилых является хорошей рабочей темой для изучения в рамках крупномасштабных клинических исследований качества жизни [16].
Одно из первых внутривенных введений магния было произведено французским акушером М. Бертраном в 1906 г. для снятия судорог при эклампсии. Преэклампсия встречается у 5–50 % женщин и приводит к самому тяжелому осложнению беременности – эклампсии. Общепризнанной терапией является внутривенное введение сульфата магния. Проведено сравнительное исследование экспрессии генов в 10 плацентах, полученных после физиологических родов, 10 – от пациенток, перенесших преэклампсию, и 8 плацент пациенток с преэклампсией, получавших сульфат магния, показавшее, что у женщин с преэклампсией повышены (р < 0,001) уровни экспрессии генов рецептора, подобного рецептору кальцитонина (CRLR – calcitonine receptor-like receptor); белка, модифицирующего активность рецепторов (RAMP-1) и индуцибельной синтетазы оксида азота (iNOS). Применение сульфата магния приводит к статистически более значимой (р < 0,05), более высокой экспрессии генов кальцитонин-связанного пептида (СGRP), гена CRLR и эндотелиальной синтетазы (eNOS). Эти изменения соответствуют релаксации эндотелия сосудов, ослаблению спазма и судорожной готовности. Кальцитонин-связанный пептид, кодируемый геном СGRP, стимулирует вазодилатацию посредством активации CRLR с участием белка RAMP-1 [15].
Во врачебной практике наиболее известны болезненные судороги отдельных мышц. Они связаны с возникновением в мышцах (чаще после перегрузок) участков локального спазма: писчий спазм, ночные судороги икроножных мышц, спазм наружной крыловидной мышцы при открывании рта, судороги различных групп мышц у спортсменов. Участки локального мышечного спазма прощупываются в виде уплотнений, надавливание на которые болезненно. Мышечные перегрузки – далеко не единственная причина судорог. Известны токсические судороги; судороги при дефиците пиридоксина; при гипогликемии; возникающие под действием психогенных факторов, при чрезмерной физической нагрузке и перенапряжении мышц, столбняке, метаболических расстройствах и др. Особенно легко судороги возникают у детей, что бывает обусловлено своевременно незавершенным структурно-функциональным созреванием мозга, внутриутробными поражениями центральной нервной системы и пороками развития.
Регулярно повторяющиеся судороги указывают на первичность дефицита магния и описываются как “спазмофилия”, “конституциональная тетания”, “нормокальциевая тетания”. Терапия кальцием больных этой группы может еще больше усилить клинические проявления спазмофилии и судороги, в то время как патофизиологическим лечением является применение именно препаратов магния [3].
Ниже мы рассмотрим биохимию мышечного сокращения, физиологическую роль магния, взаимосвязь дефицита магния и судорог, особенности магнезиальной терапии, синергичный эффект магния и одного из его фармакологических носителей – оротовой кислоты [4].
Биохимия мышечного сокращения
Скелетная мышца состоит из миллионов мышечных волокон, связанных между собой соединительнотканными волокнами. Мышечное сокращение представляет собой укорочение или изменение напряжения мышечных волокон, составляющих мышцу. Различают следующие виды сокращений: изометрическое, при котором длина мышечных волокон остается неизменной, а напряжение их возрастает, и изотоническое – с укорочением и утолщением мышцы, но без существенного изменения ее напряжения. Изометрическим и изотоническим сокращениями мышц представлены регулярные циклы сокращения-расслабления, а судороги возникают при нарушении цикличности этого процесса.
Структурной единицей мышечного волокна являются миофибриллы – организованные особым образом пучки белков, располагающиеся вдоль клетки. В сокращении участвуют два белка – миозин и актин, локализующиеся в боковой цепи мышечного волокна.
Сокращение мышцы вызывает нервный импульс, который через нервно-мышечный синапс при посредстве медиатора трансформируется в механический эффект. Нервный импульс в фазе потенциала действия вызывает высвобождение ионов Ca2+, которые взаимодействуют с белками мышечных клеток и вызывают сокращение миофибрилл. Ионы магния, наоборот, являются физиологическим антагонистом кальция и опосредуют расслабление миофибрилл.
Помимо участия в функционировании миофибрилл магний играет непреходящую роль в передаче нервного импульса. Магний – физиологический регулятор возбудимости клетки, необходимый для деполяризации клеточной мембраны нервных и мышечных клеток. При недостатке магния клетка становится сверхвозбудимой. Наиболее очевидным молекулярным механизмом влияния магния на возбудимость нейронов является ингибирование активности NMDA-рецепторов (глутаматных рецепторов). Активация NMDA-рецепторов необходима для быстрой синаптической передачи сигнала в головном мозге, которая происходит в результате изменения потока натрия (калия) через мембрану. Чрезмерная стимуляция NMDA-рецепторов может привести к судорогам эпилептического типа, в то время как их блокирование магнием снижает возбудимость нервных путей.
Поскольку магний играет фундаментальную роль в физиологии передачи нервного импульса и сокращении миофибрилл, снижение его уровня приводит к повышению нервно-мышечной возбудимости и вызывает тетанию.
Известны следующие симптомы дефицита магния в организме [13]:
- дрожание (тремор) – вид гиперкинеза, появление автоматических насильственных чрезмерных движений, мешающих выполнению произвольных двигательных актов;
- тик – быстрые непроизвольные сокращения мышц, обычно – круговой спазм мышцы глаза или лицевых мышц, что вызывает подергивание уголков рта;
- коленный рефлекс – разгибание нижней конечности в коленном суставе при ударе по сухожилию четырехглавой мышцы бедра ниже коленной чашечки; оценивают его повышение (оживление), снижение, утрату (при повреждении рефлекторной дуги);
- симптом Хвостека – вызывается легким постукиванием пальцем или молоточком по стволу лицевого нерва, чаще всего – в области бифуркации лицевого нерва; симптом Хвостека – косвенный признак дефицита магния, он встречается у 4 из 5 обследованных пациентов с дефицитом магния;
- симптом, определяемый в пробе со жгутом: при пережатии плеча жгутом или манжетой на 2–3 минуты после исчезновения пульса развивается тетаническая судорожная контрактура кисти.
Клинически при латентном дефиците магния можно выявить следующие специфические нервно-мышечные знаки, связанные с повышенной судорожной готовностью:
- покалывания в области стоп и ладоней (парестезии), связанные с перевозбуждением чувствительных окончаний;
- гиперактивность: человек не может долго находиться на одном месте, постоянно двигается – даже во сне (синдром “беспокойных ног”, связан с повышенной возбудимостью скелетной мускулатуры);
- мышечные контрактуры, судороги (затрудненная реполяризация клеток);
- ощущение “перебоев” в работе сердца, экстрасистолия;
- пищеварительные нарушения: поносы, иногда запоры, боли в животе, ощущение “комка” в горле (спазм в области глотки);
- расстройства мочеиспускания: частые позывы, боли в области мочевого пузыря [6, 7, 13].
Магнезиальная терапия, ее особенности
Потребность в магнии оценена в различных эпидемиологических исследованиях. Интересно проанализировать последнее крупное исследование по оценке потребления магния, проведенное в Китае (2009) [15]. При оценке рациона питания у 324 человек (55–70 лет) показано, что среднее содержание магния в эритроцитах было значительно ниже (2,0 ммоль/л) у пациентов с повышенным давлением и верифицированным диагнозом артериальной гипертензии (АГ) по сравнению с нормотониками (2,2 ммоль/л; р < 0,005). Диетарное потребление магния было значительно ниже в группах пациентов с диагнозом АГ (316 мг/сут), сахарным диабетом (323 мг/сут) по сравнению с лицами, имеющими нормальные показатели сахара крови и артериального давления (374 мг/сут; р < 0,05). При потреблении магния ниже нормы мышечные судороги развиваются в период от 1 до 6 недель. В России текущая физиологическая суточная потребность в магнии у взрослых – около 400 мг/сут (максимально – до 800 мг/сут). Сбалансированный рацион должен содержать магний в количестве ≈ 400 мг/сут, из которого у здорового человека адсорбируется около 200 мг.
Уменьшение количества ежедневно принимаемого магния может компенсироваться возрастающей адсорбцией магния в кишечнике и уменьшением выделения его через почки. Этому можно способствовать, употребляя определенные пищевые продукты. Так, в свежих овощах и фруктах содержится относительно больше активно усвояемого магния, чем в других продуктах. Необходимое количество магния определяют из расчета 5 мг/кг/сут. Некоторым людям необходимо бόльшее количество магния из-за значительных его потерь. Детям требуется от 5 до 10 мг/кг/сут, беременным женщинам (или кормящим матерям) – 10–15 мг/кг/сут, спортсменам или лицам, занимающимся тяжелым физическим трудом (в зависимости от нагрузки), – от 10 до 15 мг/кг/сут.
Различают первичный и вторичный дефициты магния. Первичный дефицит магния обусловлен врожденными нарушениями минерального обмена: почечной тубулопатией, снижением всасывания магния в кишечнике и др. Вторичный дефицит магния возникает при недостаточном восполнении его потерь (с пищей, питьем). Механизм такого состояния заключается не только в недостаточном поступлении магния, но и в усилении потерь с мочой. Вторичный дефицит магния может возникать также при нарушении регуляции ионного метаболизма, при глутеновой энтеропатии, укорочении кишечника после его резекции и пр. Если причина вторичного дефицита магния известна, ситуацию удается нормализовать, воздействуя на первопричину дефицита.
При дефиците магния любой этиологии показана коррекция его содержания в организме. У здорового человека концентрация магния в сыворотке крови поддерживается в достаточно узком диапазоне (норма – 0,75–1,26 ммоль/л, у беременных нижняя граница > 0,81 ммоль/л). Этот внеклеточный магний находится в процессе непрерывного обмена с магниевыми запасами костей и мышечной ткани. Во многих случаях компенсировать недостаток магния только диетическими мероприятиями не удается, и тогда возникает необходимость в применении фармакологических препаратов, содержащих магний. К недостаткам магниевых препаратов I поколения относят не только относительно низкую всасываемость и усвояемость, но и его замедленное включение в метаболизм. В последние 20 лет отмечается довольно стойкая тенденция к переходу на применение II и последующих поколений магнийсодержащих препаратов, в которых минерал содержится в виде органической соли или комплекса с аминокислотами (например, оротат магния).
Органические соли магния не только значительно лучше усваиваются организмом, но и реже дают побочные эффекты. В настоящее время продолжают применять препараты магния на основе многочисленных органических солей: оротат, аспарагинат, лактат, цитрат магния и др. Терапия препаратами магния эффективнее, если вводить их одновременно с т. н. магниевыми протекторами – соединениями, усиливающими абсорбцию магния и его транспорт в клетку. К магниевым протекторам относятся оротовая кислота, витамины В6, D, В1, А, С и Е, рибоксин, карнитин, таурин и препараты кальция, т. к. все эти вещества повышают содержание магния в клетке.
При судорогах, обусловленных гипокальциемией, гипомагниемией, алкалозом, требуется внутривенное введение кальция и/или магния с последующим их применением [8]. У больных эпилепсией комплексную терапию дополняют препаратами магния [12].
Препараты оротовой кислоты (оротата) применяют при нарушениях белкового обмена (в постинфарктном периоде, при голодании, заболеваниях печени, в спортивной медицине и т. д.). Оротовая кислота является производным пиримидинового основания урацила, участвует в биосинтезе пиримидиновых нуклеотидов, уридинмонофосфата (УМФ) и цитидинмонофосфата. Повышение концентрации оротата в результате приема солей оротовой кислоты значительно увеличивает концентрацию УМФ, уридиндифосфата (УДФ) и уридинтрифосфата (УTФ) [5].
Механизм действия оротовой кислоты состоит в увеличении синтеза УМФ и других уридинфосфатов, которые являются сигнальными молекулами, взаимодействующими с пуринергическими рецепторами и способствующими расслаблению гладкомышечной и поперечнополосатой мускулатуры. Оротовая кислота, как и тиамин, и пиридоксин, способствует перемещению магния в клетку. Поэтому сочетание магния с оротовой кислотой усиливает эффект устранения судорог.
Рассматривая вопрос о лечении магнийдефицитных судорог, следует обратить внимание на препарат МагнеротR (оротат магния; Worwag Pharma GmbH & Co., Германия). В 1 таблетке препарата содержится 500 мг оротата магния, или 32,8 мг чистого магния. Эта соль мало растворима в воде, не связывает соляную кислоту желудочного сока, не оказывает послабляющего действия в отличие от некоторых других солей магния. Оротат магния – хороший источник элементного магния, что важно при внеклеточном дефиците магния в организме [3].
Соли оротовой кислоты используются в качестве переносчиков минералов, поскольку оротовая кислота повышает клеточную биодоступность катионов. В данном случае оротовая кислота является своеобразным транспортером иона магния в клетку. Таким образом, обеспечивая высокую биодоступность магния, Магнерот® обладает рядом дополнительных синергичных свойств, связанных с биологической ролью аниона оротовой кислоты. Этот препарат магния обладает анаболическими, гепатопротекторными, урикозурическими свойствами и может применяться длительными курсами.
У больных после операций на сердце восстановительный период реже осложняется перебоями в сердце и аритмией, протекает более благоприятно на фоне метаболической терапии, в т. ч. и оротатом магния [10]. Оротат магния может использоваться как средство вспомогательной терапии у лиц с серьезной сердечной недостаточностью, тахиаритмией и экстрасистолией [11]. Однако при столбнячных судорогах сульфат магния считается неэффективным [9].
Магний и оротовая кислота положительно влияют на энергетический метаболизм, структуру мышечной и соединительной тканей и сосудистый тонус, способствуя уменьшению содержания катехоламинов в плазме крови, существенно снижают гиперреактивность мышечной клетки, что обеспечивает их противосудорожное действие. Совместное применение магния и оротата потенцирует их эффект при магнийдефицитных судорогах, возникающих по разным причинам и имеющих разные механизмы развития.
Информация об авторах:
Громова Ольга Алексеевна – доктор медицинских наук, профессор, заведующая курсом клинической фармакологиикафедры клинической фармакологии Ивановской государственной медицинской академии.
E-mail: unesco.gromova@gmail.com;
Егорова Евгения Юрьевна – кандидат медицинский наук, доцент кафедры физической культурыи безопасности жизнедеятельности ГОУ ВПО “Ивановский государственный университет”.
E-mail: egorovaevgenya@inbox.ru;
Торшин Иван Юрьевич – кандидат химических наук, консультант Российского центраинститута микроэлементов ЮНЕСКО.
E-mail: unesco.gromova@gmail.com



