Введение
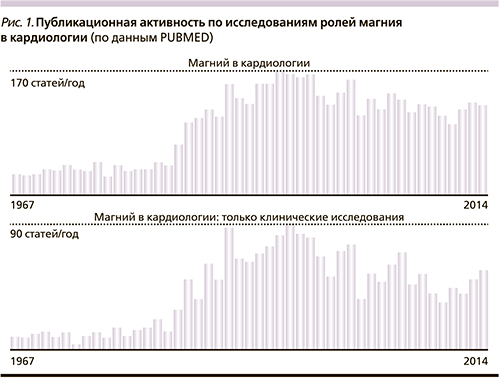
В течение последних 40 лет кардиопротекторные свойства магния находятся под пристальным вниманием кардиологов и терапевтов. Например, результаты большого мета-анализа, представленные в работе R. Ioannidis (2001) [1], указывают на достоверную корреляцию между магниевым дефицитом и риском возникновения инфаркта миокарда (ИМ), эклампсии у беременных, а также на позитивную статистику предотвращения инфарктов и эклампсии при коррекции магниевого дефицита. Отмечается постоянный исследовательский интерес к кардиологическим ролям магния (рис. 1).
Впервые серьезная клиническая иллюстрация возможностей влияния магнезиальной терапии на исходы острого инфаркта миокарда (ОИМ) была получена в исследовании LIMIT-2 (Second Leicester Intravenous Magnesium Intervention Trial, 1987–1992) [2]. В этом рандомизированном плацебо-контролируемом двойном слепом исследовании 2316 пациентов с подозрением на ОИМ получали дополнительно к стандартному лечению 8 ммоль сульфата магния (MgSO4) внутривенно в течение 5 минут и далее 65 ммоль MgSO4 в течение суток.
В контрольной группе вместо раствора магния применяли физиологический раствор в качестве плацебо. В период пребывания в кардиореанимационном отделении частота развития левожелудочковой недостаточности у больных, получавших магний, снизилась на четверть по сравнению с контрольной группой (р=0,009). В контрольной группе летальность в течение первых 28 дней после ОИМ составила 10,3%, а в группе, получавшей магний, – только 7,8% (снижение на 24%, р=0,004). По конечным точкам смертность от ИБС снизилась на 21% (р=0,001), а общая – на 16% (р=0,03) [2].
Результаты исследования LIMIT-2 актуальны и по сей день. Они говорят по меньшей мере о принципиальной возможности благоприятного влияния магнезиальной терапии на течение и исходы ОИМ. В случаях, когда в силу различных причин (материальных, технических, противопоказаний к препаратам, пожилого возраста, наличия стойких нарушений ритма сердца) реализовать современные стандарты лечения (сочетания нитратов, ингибиторов ангиотензинпревращающего фермента – АПФ, β-адреноблокаторов, препаратов для тромболизиса и др.) невозможно, магниевая терапия может оказаться тем шансом, который позволит сохранить жизнь больного ОИМ. Патологоанатомические исследования пораженных ишемией областей миокарда показали, что смерть от ИМ сопровождается повышенным содержанием натрия и кальция в ишемическом очаге на фоне снижения уровней калия и магния [3].
В 2002 г. было проведено исследование MagNET, которое не показало достоверной разницы смертности пациентов от ИМ с введением магния в протокол лечения и без него. Однако международное магниевое сообщество признало исследование MagNET не отвечающим стандартам доказательной медицины по ряду параметров. Например, назначение препаратов магния проводилось без учета исходного уровня магния в организме пациентов. При сравнении групп не учитывалась сопутствующая фармакотерапия препаратами, способными серьезно повлиять не только на концентрацию магния (диуретики, β-адреноблокаторы, ингибиторы АПФ, антикальциевые препараты, антибиотики, антациды и т.д.), но и на смертность при ОИМ, и на выживаемость после ИМ. В связи с тем что исследование MagNET было проведено с рядом явных нарушений методологии сбора и анализа данных, в протоколе Европейского общества по изучению биологического и медицинского значения магния указано, что малодостоверные результаты исследования MagNET связаны с неадекватной стратификацией когорты пациентов и отсутствием анализа уровня магния у индивидуальных пациентов [4].
В настоящее время доказательная база продолжает пополняться новыми исследованиями, в которых подтверждается и уточняется клиническая эффективность целевой терапии ОИМ и других форм ИБС магнием [5, 6]. Большинство этих исследований указывают на пониженное содержание магния в сыворотке крови и в эритроцитах.
В этой работе представлены результаты систематического анализа литературы по взаимосвязи ИБС с дефицитом магния. Далее последовательно рассмотрены клинико-эпидемиологические данные по взаимосвязи гипомагнеземии с риском ИБС (в т.ч. нестабильной стенокардии), смертностью от сердечно-сосудистых причин, нарушениями функционирования тканей миокарда (включая митохондриальную недостаточность), результаты исследования коморбидных ИБС-заболеваний, связи между суточным потреблением магния и риском сердечно-сосудистой патологии. Затем рассмотрены эффекты воздействия магния на фармакодинамику кардиопрепаратов и пероральное использование препаратов магния на основе органических солей в профилактике и терапии ИБС.
 Гипомагнеземия и сердечно-сосудистый риск: клинико-эпидемиологические данные
Гипомагнеземия и сердечно-сосудистый риск: клинико-эпидемиологические данные
К настоящему времени в протеоме человека найдено более 700 магний-связывающих белков [7]. Дефицит магния в жидкостях и клетках организма неизбежно приводит к падению активности всех этих белков, в результате чего тонко налаженная система биохимических процессов организма становится более хаотичной.
Поэтому уровни магния в плазме крови и в эритроцитах являются одной из констант, принципиально важных для физиологического функционирования всех систем организма. В частности, сниженные уровня магния в плазме крови ассоциированы с повышенным артериальным давлением (АД), эндотелиальной дисфункцией, инсулинорезистентностью, кальцификацией сосудистых стенок, хроническим воспалением, нарушениями ритма сердца и более высокой смертностью [7].
Результаты многочисленных кли-нико-эпидемиологических исследований подтверждают эти выводы, следующие из фундаментальных исследований. Ниже рассмотрены результаты клинических исследований, указывающие на связь между гипомагнеземией и ИБС, ожирением, атеросклерозом, риском развития аритмий, а также общей и сердечно-сосудистой смертностью.
Гипомагнеземия и ИБС
Соотношения между уровнями электролитов в сыворотке являются важными биомаркерами ОИМ. С риском ОИМ ассоциированы как гипермагнеземия, так и нарушения соотношений уровней натрия, калия и магния. Так, в сравнительном исследовании пациентов, перенесших ОИМ, и участников контрольной группы без заболевания уровни магния в контрольной группе составили 0,90±0,11 ммоль, а у пациентов с ОИМ – 0,71±0,07 мг/дл (n=100; р<0,001) [8].
Исследование 60 пациентов с ОИМ и 100 человек контрольной группы показало, что соотношения Са:Mg, K:Mg и Na:K были значительно выше у пациентов с ОИМ по сравнению с контрольной группой (р<0,001). Анализ предикторов методами машинного обучения позволил установить пороговые значения соотношений, оптимальные для наиболее точной диагностики – Na:Mg (40,9), Са:Mg (3,4) и К:Mg (2,7) [9].
Мета-анализ 16 проспективных исследований показал, что гипомагнеземия и более низкое диетарное потребление магния достоверно ассоциированы с повышенным риском ИБС. Мета-анализ включил 313 041 участника (11 995 случаев сердечно-сосудистой патологии, в т.ч. 7534 случая ИБС и 2686 – ИБС с летальным исходом). Повышение уровней магния плазмы на каждые 0,2 ммоль/л было связано с 30%-ным снижением риска сердечно-сосудистых заболеваний вообще (относительный риск [ОР]=0,70, 95% доверительный интервал [ДИ] – 0,56–0,88), с 17%-ным снижением риска ИБС (ОР=0,83, 95% ДИ – 0,75–1,05) и 39%-ным снижением риска смертности от ИБС (ОР=0,61, 95% ДИ 0,37–1,00). Повышение суточного потребления магния на каждые 200 мг/сут было связано с 22%-ным снижением риска ИБС (ОР=0,78, 95% ДИ – 0,67–0,92) [10].
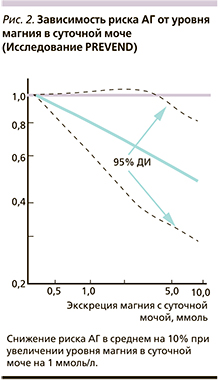
Более высокие уровни магния в суточной моче соответствуют сниженному риску артериальной гипертензии (АГ), одного из основных компонентов в этиологии ИБС. Среди участников исследования PREVEND (Prevention of Renal and Vascular End-Stage Disease, n=5511, 28–75 лет) за 8 лет наблюдений у 1172 участников зарегистрировано повышенное АД (систолическое АД≥140 мм рт. ст., диастолическое АД≥90 мм рт. ст. или систематический прием антигипертензивных препаратов). Отмечено снижение риска АГ в среднем на 10% при увеличении уровня магния в суточной моче на 1 ммоль/л после поправок на возраст, пол, индекс массы тела (ИМТ), курение, потребление алкоголя, семейный анамнез [11] (рис. 2).
Отечественное исследование нарушений суточного профиля АД в группе беременных (n=377, 18–42 лет) с различными формами АГ показало, что гипертензивные осложнения беременности формируются постепенно; их развитию предшествует этап вегетативных, метаболических отклонений, эндотелиальной дисфункции, дефицита вазодилатации, проявляющихся в повышенных показателях периферического сосудистого сопротивления, диастолического АД и нарушении суточного ритма АД с недостаточным его ночным снижением на фоне дефицита магния. Выявление ранних маркеров гестационной АГ и преэклампсии позволяет использовать период доклинических проявлений для своевременной компенсации дефицита магния и улучшения регуляции сердечно-сосудистой системы [12].
Патофизиологическими компонентами ИБС являются АГ, ожирение и атеросклероз. Связь между дефицитом магния и АГ была рассмотрена в отдельной работе [13]. Гипомагнеземия приводит к снижению активности белков энергетического метаболизма, и в частности метаболизма жирных кислот (ацетил-СоА-лигазы жирных кислот и др.). Поэтому дефицит магния неразрывно связан с метаболическими нарушениями. Например, в исследовании 427 участников 20–65 лет установлена ассоциация между гипомагнеземией (уровни магния в сыворотке <0,7 ммоль/л) и метаболическим ожирением при нормальной массе тела. После поправок на семейный анамнез, диабет, возраст, ИМТ, окружность талии гипомагнеземия существенно повышала риск метаболического ожирения (ОР=6,4, 95% ДИ – 2,3–2,4) [14].
В крупномасштабном исследовании ARIC (Atherosclerosis Risk in Communities, n=15 248, возраст – 45–64 года) установлен ряд ассоциаций недостаточности магния с различными аспектами ИБС, в т.ч. с атеросклерозом. Суточное потребление магния было обратно пропорционально уровням инсулина сыворотки натощак, липопротеидов высокой плотности, систолическому и диастолическому АД. Более низкие уровни магния соответствовали более быстрому прогрессированию атеросклероза. Повышение концентрации магния в сыворотке на каждые 0,1 ммоль/л соответствовало снижению средней толщины сосудистой стенки сонной артерии на 0,012 мм (р=0,006) после поправок на возраст, ИМТ, курение, АГ и другие факторы [15].
Важно подчеркнуть, что прием диуретиков обязательно сопровождается повышенным выведением магния с мочой. Это приводит к ослаблению зависимости между толщиной пораженной атеросклерозом сосудистой стенки и уровнем магния в крови. Так, в том же исследовании ARIC было показано, что среди пациентов, принимавших диуретики, повышение концентрации магния в сыворотке на каждые 0,1 ммоль/л средняя толщина сосудистой стенки сонной артерии снижалась всего на 0,012 мм (р=0,006) [15]. Таким образом, для повышения эффективности применения кардиологические препараты магния их следует принимать отдельно от диуретиков.
Заметим, что нормализация уровней магния в плазме/сыворотке крови ассоциирована со сниженным риском и другого ишемического заболевания – ишемического инсульта (ИИ). Как известно, ИИ характеризуется тем же набором патофизиологических механизмов, что и ИБС – АГ, атеросклероз, избыточная масса тела. В крупномасштабном исследовании ARIC (n=14 221, возраст – 45–64 года) было установлено, что более высокие уровни магния в сыворотке соответствуют снижению риска ИИ. За 15 лет наблюдений задокументировано 577 случаев ИИ. Отмечена дозозависимая корреляция между уровнями магния в сыворотке крови и риском ИИ: по сравнению с низкими уровнями магния (<0,75 ммоль/л) риск ИИ снижался на 22% при Mg(сыв)>0,8 ммоль/л (ОР=0,78, 95% ДИ – 0,62–0,96) и на 30% при Mg(сыв)>0,85 ммоль/л (ОР=0,70; 95% ДИ – 0,56–0,88; р=0,005) [16].
По данным крупномасштабного исследования ARIC (n=14 290, средний возраст – 54 года; 53% женщин), дефицит магния также ассоциирован с коморбидным ИБС-заболеванием – фибрилляцией предсердий (ФП). В течение 21 года наблюдений было выявлено 1755 случаев ФП. При этом уровни магния сыворотки были ассоциированы с более высоким риском ФП: по сравнению со средним квинтилем концентраций магния в сыворотке (≥0,80–0,83 ммоль/л) риск ФП у пациентов в самом низком квинтиле (≤0,78 ммоль/л) был повышен на 34% (ОР=1,34, 95% ДИ – 1,16–1,54) [17]. Как известно, ФП является одной из наиболее частых причин сердечно-сосудистой смертности.
Гипомагнеземия и смертность, в т.ч. от сердечно-сосудистых причин
Рассмотренные выше взаимосвязи магния с риском ИБС, АГ, атеросклерозом и риском аритмий позволяют предположить, что обеспеченность организма магнием может существенно влиять на продолжительность жизни. Клинико-эпидемиологические исследования показали, что гипомагнеземия является достоверным предиктором сердечно-сосудистой и общей смертности среди населения, также способствуя ускоренной потере функции почек у реципиентов почечного трансплантата и у пациентов с диабетом.
В исследовании когорты медсестер Nurses’ Health Study (n=88 375) дефицит магния был ассоциирован с повышенным риском внезапной сердечной смерти (ВСС, диагноз – I46.1 по Международной классификации болезней 10-го пересмотра – МКБ-10). За 26 лет наблюдений было зарегистрировано 505 случаев внезапной смерти от аритмии. Установлено, что более высокие уровни магния в плазме крови были достоверно ассоциированы со значительным снижением риска ВСС. По сравнению с квартилью пациенток с самыми низкими уровнями магния в плазме (менее 0,79 ммоль/л) у пациенток в квартиле с самыми высокими уровнями магния в плазме (более 0,88 ммоль/л) риск ВСС был снижен почти в 5 раз (ОР=0,23, 95% ДИ – 0,09–0,60). При этом возрастание уровней магния в плазме на каждый 0,1 ммоль/л соответствовало снижению риска на 41% (95% ДИ – 15–58%) [18].
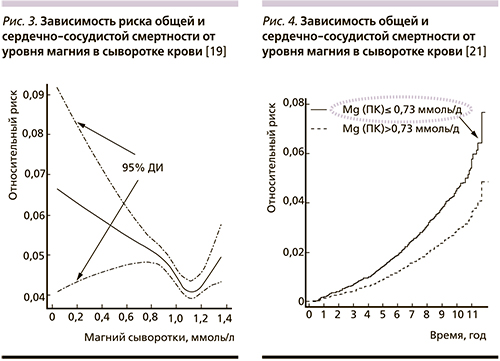
Гипомагнеземия и другие нарушения электролитного баланса часто возникают у пациентов с нарушениями почечной функции, приводя к повышению смертности. Например, гипомагнеземия является значимым предиктором смертности у пациентов на гемодиализе. Наблюдения за германской когортой из 142 555 пациентов на гемодиализе в течение 1 года позволили зарегистрировать 11 454 смертей (4774 – от сердечно-сосудистых причин). Гипомагниемия являлась достоверным фактором риска общей и сердечно-сосудистой смертности [19] (рис. 3).
При наблюдении за когортой 1650 пациентов с хронической патологией почек в течение 5 лет было зарегистрировано 284 смертельных исхода. После поправок на другие факторы риска (включая возраст, пол, диабет, функцию почек и АГ) повышение уровней магния в сыворотке на каждые 0,1 ммоль/л соответствовало снижению риска смертельного исхода на 18% (95% ДИ – 10–25%; р=0,002). У пациентов с самыми низкими уровнями магния сыворотки (<0,76 ммоль/л) по сравнению с самыми высокими (>0,92 ммоль/л) установлено повышение риска на 61% (95% ДИ – 11–133%; р=0,012) [20].
По данным крупномасштабного исследования (n=4203), гипомагнеземия достоверно ассоциирована с повышенной сердечно-сосудистой и общей смертностью. За 10 лет наблюдений зарегистрировано 417 смертельных исхода. Смертность от всех причин в подгруппе пациентов с уровнями магния в сыворотке ≤0,73 ммоль/л была значительно выше (11 случаев на 1000 человек) по сравнению с подгруппой пациентов с более высокими уровнями (1,5 случая на 1000 человек). Смертность от сердечно-сосудистых причин также была выше на фоне гипомагнеземиии (3,4 случая на 1000 человек, контроль – 1,5 случая на 1000 человек) [21] (рис. 4).
Компенсация дефицита магния может оказывать существенное влияние на риск внезапной сердечно-сосудистой смерти среди пациентов с шизофренией. Шизофрения, как и другие пограничные нервно-психические расстройства (ПНПР), является разрушительным психическим расстройством, влияющим на познавательные способности, эмоциональное состояние, работоспособность, стабильность семьи и самооценку пациента. У пациентов с шизофренией в 2,6 раза выше риск преждевременной смерти. Это может быть связано с нейролептиками, которые вызывают пролонгацию интервала QT, метаболическую дисфункцию, повышение АД и нарушения сердечного ритма. Дефицит магния играет определенную роль в этиологии всех этих кардиопатологических состояний, приводит к различным морфологическим и функциональным нарушениям сердца [22]. По нашим неопубликованным данным, у пациентов с шизофренией и другими ПНПР отмечаются чрезвычайно низкие уровни магния в плазме крови (≤0,56 ммоль/л) и в эритроцитах (менее 0,1 ммоль/л при норме 1,65–2,65 ммоль/л), что в соответствии с приведенными выше данными крупномасштабных исследований существенно повышает риск сердечно-сосудистой патологии.
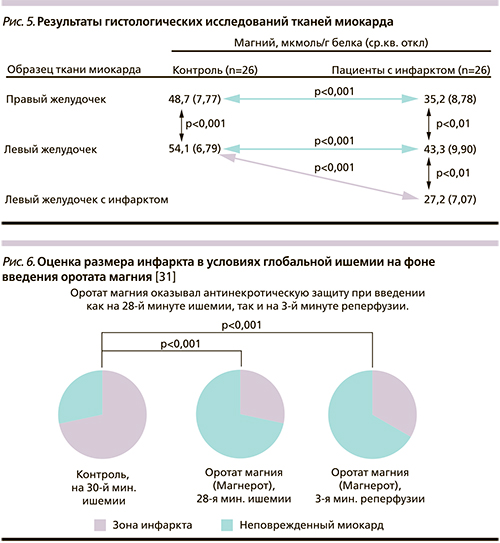
Важно отметить, что при ИМ отмечено достоверное снижение уровней магния в зоне ишемического очага. Сравнение уровней ионов в миокарде 26 человек, умерших от острой травмы, и 24 человек, умерших от острого ИМ, показало, что соотношения Mg/Ca и K/Na были существенно ниже в зоне инфаркта. Таким образом, истощение магния может быть причиной летальных приступов аритмии [3] (рис. 5).
Заметим, что снижение соотношения Mg/Ca при остром ишемическом повреждении связано не только с потерями магния кардиомиоцитами, но и с увеличением уровней кальция в погибших клетках. Бóльшая часть кальция локализована в митохондриях в виде т.н. плотных телец (содержащих ~30% кальция и ~25% фосфора) [23], что соответствует активации процессов апоптоза при ишемии (ионы Ca2+ играют существенную роль в организации процесса апоптоза).
Взаимосвязь дефицита магния, ИБС и митохондриальной недостаточности
Дефицит магния отрицательно сказывается на здоровье сердечно-сосудистой системы, в частности, стимулирует развитие нарушений структуры и функции митохондрий кардиомиоцитов. В работах [24, 25] были представлены результаты систематического анализа данных фундаментальных и клинических исследований по воздействию магния на митохондрии.
Дефицит магния нарушает функционирование митохондрий кардиомиоцитов [26] за счет следующих процессов:
- снижения энергетического метаболизма митохондрий и синтеза АТФ вследствие торможения цикла Кребса [27];
- снижения синтеза белка как в клетке, так и в митохондриях [28] и снижения активности таких митохондриальных белков, как фосфолипаза-А2, цитохром-С-оксидаза, δ-6-десатураза и др.;
- нарушения электролитного баланса и «набухания» митохондрий [29] (уровень магния в митохондриальном матриксе влияет на проницаемость митохондрий для ионов калия [30]);
- открытия митохондриальной поры – особого белкового комплекса в мембране митохондрий, который формируется при ишемии [31].
Магний улучшает состояние митохондрий миокарда после ишемии и реперфузии. Сердца крыс in vitro подвергались воздействию ишемии при низком потоке инфузионного раствора (0,2 мл/мин) в течение 60 минут, затем в течение 30 минут происходила реперфузия. В одном эксперименте концентрация Mg2+ поддерживалась не выше 1,2, а в другом – не менее 15 ммоль/л в течение всего эксперимента. Высокая концентрация Mg2+ оказывала значительное защитное действие на митохондриальный синтез АТФ и снижала перегрузку кальцием митохондрий миокарда [32].
 Положительный эффект оротата магния связан со значительным снижением патологического процесса, известного как «открытие митохондриальной поры» [31]. Избыточное открытие митохондриальной поры приводит к набуханию митохондрий и к их гибели [33]. При открытии митохондриальной поры резко увеличивается количество молекул цитохрома С, переносимых из митохондриального межмембранного пространства в цитозоль и необходимых для инициации программы апоптоза [34]. Оротат магния, поступающий в клетки к началу реперфузии после ишемии, способствует закрытию митохондриальной поры и значительно снижает размер инфаркта [31] (рис. 6).
Положительный эффект оротата магния связан со значительным снижением патологического процесса, известного как «открытие митохондриальной поры» [31]. Избыточное открытие митохондриальной поры приводит к набуханию митохондрий и к их гибели [33]. При открытии митохондриальной поры резко увеличивается количество молекул цитохрома С, переносимых из митохондриального межмембранного пространства в цитозоль и необходимых для инициации программы апоптоза [34]. Оротат магния, поступающий в клетки к началу реперфузии после ишемии, способствует закрытию митохондриальной поры и значительно снижает размер инфаркта [31] (рис. 6).
Коморбидность дефицита магния, ИБС и других патологий
Результаты крупномасштабного скрининга пациентов лечебных стационаров, поступивших в медицинские учреждения 7 регионов России (n=2000), указали на выраженную связь между сниженными уровнями магния в крови и грузом коморбидных состояний пациента. В исследованной когорте пациентов установлено преобладание коморбидных состояний: число диагнозов МКБ-10 на одного пациента составило 1,9±1,3 диагноза (95% ДИ – 1–6). Уровни магния были обратно пропорциональны числу диагнозов, т.е. более высокие уровни магния соответствовали более низкому числу коморбидных состояний у пациента. Значения уровней магния в плазме ниже 0,80 ммоль/л ассоциированы со статистически значимым повышением риска многочисленных патологий, в т.ч. судорог (R56.8), пароксизмальной тахикардии (I47.9), пролапса митрального клапана (I34.1), нестабильной стенокардии (I20.0), эссенциальной гипертонии (I10), избыточной массы тела (Е66.3), ожирения (Е66), инсулиннезависимого сахарного диабета (СД) с осложнениями (E11.7, E11.8) [35].
Анализ результатов этого клинико-эпидемиологического исследования подтвердил, что дефицит магния не просто «ассоциирован» с ИБС, а является центром кластера, в который входят ИБС и коморбидные ИБС-патологии. Например, умеренный дефицит магния, определяемый как Mg(ПК) в диапазоне 0,50–0,80 ммоль/л или как Mg(Эр)<1,10 ммоль/л был одновременно ассоциирован с диагнозами «Е66.3 Избыточный вес» (р=3,1·10-3), «I20.9 Стенокардия неуточненная» (р=2,6·10-6), «I10 Эссенциальная первичная гипертония» (р=4,8·10-3), «I67.2 Церебральный атеросклероз» (р=3,2·10-4). В кластер коморбидных ИБС-патологий, ассоциированных с дефицитом магния, также входили «I20.0 Нестабильная стенокардия» (р=5,9·10-9), «F43.0 Острая реакция на стресс» (р=4,6·10-4), «I47.9 Пароксизмальная тахикардия неуточненная» (р=10-35), «R56.8 Другие неуточненные судороги» (р=5,5·10-8), «E11.7 Инсулиннезависимый сахарный диабет: с множественными осложнениями» (р=1,5·10-5). Эти ассоциации еще раз подтверждают взаимосвязь дефицита магния с различными механизмами этиопатогенеза ИБС [35].
Анализ подгруппы пациентов 18–45 лет показал, что концентрации магния в плазме крови менее 0,8 ммоль/л соответствуют повышенному риску сердечно-сосудистой патологии, причем средние уровни магния в плазме крови существенно разнятся для различных заболеваний. Например, у пациентов с диагнозом «I47.9 Пароксизмальная тахикардия» уровни магния в плазме крови составили 0,53±0,13 ммоль/л (контрольная группа пациентов без данного диагноза – 0,81±0,22 ммоль/л; р=0,002).
В эритроцитах отмечено существенное снижение уровней магния – 0,49±0,14 ммоль/л (контроль – 1,67±0,65 ммоль/л; р=5 10-11). В подгруппе пациентов с диагнозом «I34.1 Пролапс митрального клапана» средние уровни магния в плазме крови составили 0,59±0,10 ммоль/л (контроль – 0,82±0,22 ммоль/л; р=10-10), в эритроцитах – 1,39±0,22 ммоль/л (контроль – 1,68±0,67 ммоль/л; р=0,0162) [36].
Анализ кривых «относительный риск»–«концентрация магния» для различных сердечно-сосудистых и других соматических патологий показал, что с падением уровней магния в плазме крови и в эритроцитах риск возрастал для всех исследуемых патологий. Достоверное возрастание риска заболеваний в подгруппе пациентов 18–45 лет отмечено при снижении уровней магния в ПК менее 0,80 ммоль/л (заметим, что нижняя граница принятой нормы гораздо ниже – 0,66 ммоль/л) и при снижении уровней магния в эритроцитах менее 1,70 ммоль/л (норма – 1,65–2,65 ммоль/л).
Результаты клинико-эпидемиологических исследований связи между суточным потреблением магния и риском сердечно-сосудистой патологии
Низкие уровни магния в плазме крови и в эритроцитах могут являться результатом как патологии, приводящей к избыточному выведению магния из организма, так и хронического дефицита магния в потребляемой пациентами пище. Клинико-эпидемиологические исследования подтвердили связь между низким потреблением магния с пищей и риском сердечно-сосудистой патологии.
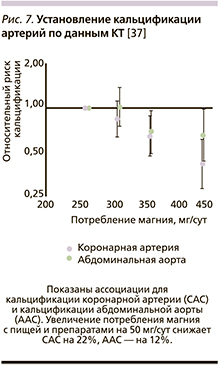
В исследовании Framingham Heart Study (n=2695; возраст 53±11 лет) было показано, что потребление магния обратно пропорционально степени кальцификации артерий. Потребление магния оценивалось по опроснику диеты, кальцификация артерий – по данным компьютерной томографии, коронарные артерии – по шкале САС (Coronary Artery Calcium) и абдоминальная аорта – по шкале AAC (Abdominal Aorta Calcification). После поправок на все установленные факторы риска повышение потребления магния на каждые 50 мг/сут ассоциировалось со снижением кальцификации коронарных артерий на 22% (шкала CAC, р<0,001), абдоминальной аорты – на 12% (шкала AAC, р=0,07). Снижение риска наличия кальцификатов атеросклеротических бляшек коронарных артерий составило 58% (р<0,001), абдоминальной аорты – 34% (р=0,01) при сравнении квартили с самым высоким потреблением магния по сравнению с самым низким. Более выраженные ассоциации между кальцификацией артерий и дефицитом магния были установлены у женщин [37] (рис. 7).
В исследовании Nurses’ Health Study (n=88 375) дефицит магния в диете был ассоциирован с повышенным риском внезапной сердечной смерти (ВСС, диагноз I46.1 по МКБ-10). За 26 лет наблюдений было зарегистрировано 505 случаев внезапной смерти от аритмии. Относительный риск ВСС был значительно ниже у женщин в квартили с самым высоким потреблением магния (>345 мг/сут), по сравнению с самым низким потреблением (<261 мг/сут) риск ВСС был снижен на 37% (ОР=0,63, 95% ДИ – 0,44=0,91) [18].
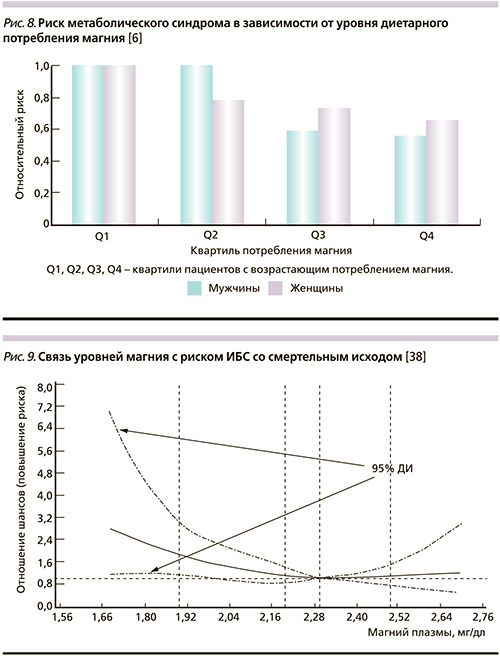
Недостаточное диетарное потребление магния в молодом возрасте ассоциировано с повышенной заболеваемостью метаболическим синдромом (МС), известным предиктором раннего старта кардиоваскулярной патологии. В крупномасштабном лонгитудинальном исследовании на молодых (18–30 лет) взаимосвязи потребления магния и МС (n=4637) за 15 лет наблюдения было установлено 608 случаев заболевания МС. По сравнению с квартилью пациентов с самым низким уровнем потребления магния (менее 108 мг/сут) у пациентов с самым высоким потреблением магния (более 225 мг/сут) риск снижался на 31% (ОР=0,69, 95% ДИ – 0,52–0,91; р<0,01) [6] (рис. 8).
В исследовании Nurses’ Health Study подтверждена связь между уровнями потребления магния, уровнями магния плазмы крови и риском развития ИБС у женщин. В исследование вошли 86 323 женщины, исходно не страдающие ИБС. За 30 лет наблюдений отмечено 3614 случаев ИБС, р=0,003. Сравнивая самое высокое потребление магния (квинтиль 5) с самым низким (квинтиль 1), установлено снижение риска на 39% (95% ДИ – 16–55%; р=0,003). Уровни магния в плазме выше 0,92 ммоль/л были ассоциированы с более низким риском ИБС (ОР=0,67, 95% ДИ – 0,44–1,04) [38]. Ассоциация не зависела от поправок на другие факторы риска (возраст, курение, месяц сбора крови и состояние натощак, ИМТ, физические упражнения, употребление алкоголя, семейный анамнез ИМ, скорость клубочковой фильтрации, менопауза, терапия, поливитамины, потребление ω-3 полиненасыщенных жирных кислот, липидный профиль, С-реактивный белок, гликозилированный гемоглобин) (рис. 9).
Проведенный в северной Индии анализ когорты из 3575 человек в возрасте 25–64 лет показал, что повышенное потребление магния (500 мг/сут) может быть эффективным средством профилактики сердечно-сосудистой патологии [39]. Были получены уникальные доказательные данные в подгруппе пациентов с ИБС (n=400, 25–63 года). Пациенты добровольно выбирали либо прием диеты, обогащенной магнием (группа «А», 206 пациентов), либо обычный рацион (группа «Б», 194) в течение 10 лет исследования. Диетарное потребление магния в группе «А» (1142±233 мг/сут) было гораздо выше, чем в группе «Б» (418±105 мг/сут). Средние сывороточные уровни магния среди участников группы «Б» были достоверно снижены по сравнению со средним уровнем магния участников группы А (р=0,01). Число осложнений в группе «А» (n=59, 29%) были достоверно ниже по сравнению с группой «Б» (n=117, 60%; р=0,001). Частота внезапной смерти была в полтора раза выше в группе «Б», чем в группе «А», а общая смертность в группе «А» (n=22, 11%) была достоверно меньше, чем в группе «Б» (n=34, 18%; р=0,01). Большее число осложнений и увеличение смертности у групповых субъектов «Б» согласуются с более высокой частотой гипокалиемии, гипомагниемии и факторов коронарного риска у пациентов группы «Б» [40].
Клинические исследования пероральных форм магния в кардиологии
Пероральные формы препаратов магния оказывают положительное воздействие на фармакодинамику ряда препаратов, широко использующихся в кардиологии. Например, содержание магния и кальция в скелетных мышцах пациентов с АГ является предиктором отклика на антигипертензивную терапию лизиноприлом или бендрофлуазидом. В группе из пациентов с АГ, получавших один из этих препаратов, было исследовано содержание магния в биоптатах скелетных мышц до начала терапии. Соотношение между концентрациями магния и кальция до лечения коррелировало с эффективностью терапии: более высокое значение соотношения Mg:Ca соответствовало более выраженной нормализации АД у пациентов (r=0,38; р<0,02) [41].
Мета-анализ 9 рандомизированных исследований подтвердил, что пероральный прием препаратов магния оптимизирует действие антигипертензивных препаратов. Совместный долговременный прием (6 месяцев и более) препаратов магния (не менее 230 мг/сут) приводил к достоверному снижению АД, причем при дозировке магния 460 мг/сут эффект был более выражен [42].
Магний способствует более эффективной фармакотерапии антиаритмическими препаратами. В частности, внутривенное введение MgSO4 повышает эффективность и безопасность терапии ибутилидом (антиаритмический препарат класса III). Ибутилид, как правило, назначают для кардиоверсии фибрилляции предсердий (ФП) и трепетания предсердий в синусовый ритм. Наиболее серьезным осложнением использования ибутилида является аритмия torsades de pointes. В исследовании 476 пациентов с ФП 229 получали ибутилид, 247 – ибутилид совместно с вливанием MgSO4 (5 г MgSO4 в течение часа с последующим введением ибутилида, затем еще 5 г MgSO4 в течение 2 часов). Результаты исследования показали, что желудочковые аритмии (устойчивые, неустойчивые и torsades de pointes) зарегистрированы достоверно реже при использовании магния (1,2%), без магния – 7,4% (р=0,002). При использовании MgSO4 аритмия torsades de pointes не встретилась ни у одного из пациентов, а без использования магния – у 8 пациентов (3,5%; р=0,009).
Кроме того, пероральные препараты магния и сами по себе обладают антигипертоническим и антиаритмическим действиями. Мета-анализ 22 рандомизированных исследований (n=1173) показал, что прием пероральных препаратов магния (средняя доза – 410 мг/сут, 95% ДИ – 120–973 мг/сут) ассоциирован с достоверным снижением систолического АД на 3–4 мм рт. ст. и диастолического АД – на 2–3 мм рт. ст., причем эффект усиливался при потреблении магния более 370 мг/сут [43].
Пероральный прием органических форм магния улучшает функцию сердечно-сосудистой системы у пожилых пациентов с СД 2 типа. В исследовании с участие 60 пожилых (старше 65 лет) пациентов с СД 30 принимали Mg-пироглутамат (368 мг/сут эл. магния), 30 вошли в контрольную группу. Прием препарата магния привел к значительному улучшению постишемической поток-опосредованной дилатации (от 3,3±3,6 до 8,4±3,9 %; р<0,05) [44].
Мета-анализ 17 рандомизированных контролируемых испытаний (n=2069) показал эффективность препаратов магния для перорального приема в профилактике послеоперационных аритмий. Прием препаратов магния достоверно снижал риск суправентрикулярной аритмии (ОР=0,77, 95% ДИ – 0,63–0,93; р=0,002) и желудочковой аритмии (ОР=0,52, 95% ДИ – 0,31–0,87; р<0,0001) [5].
Опыт применения препарата Магнерот в кардиологии
В кардиологии среди препаратов магния для перорального приема особый интерес представляет оротат магния (например, Магнерот).
Это связано с тем, что данная форма магния обладает следующими свойствами:
- является органической солью, а поэтому имеет высокую биоусвояемость в отсутствие побочных эффектов со стороны желудочно-кишечного тракта;
- оротовая кислота и сама по себе оказывает антиаритмическое, сосудорасширяющее и кардиопротективное воздействия, благоприятно влияя на клиническое течение ИМ и сердечной недостаточности [45];
- хемоинформационный анализ оротат-аниона указывает не только на кардиопротекторные, но и на противовоспалительные, нейропротекторные, ноотропные и другие эффекты.
Экспериментальные и клинические исследования позволили установить комплексное воздействие оротата магния на сердечно-сосудистую функцию. И магний, и оротовая кислота улучшают энергетический метаболизм миокарда, особенно после недавнего инфаркта. При этом также повышаются уровни «энергосодержащих» пуриновых и пиримидиновых фосфатов, печень стимулирует выход уридина в кровоток, что способствует восполнению истощенного при ишемии депо пиримидинов и пуринов миокарда. Оротат магния улучшает переносимость ИМ, уменьшает тяжесть хронической дисфункции миокарда, повышает переносимость физической нагрузки со стороны как пациентов с ИБС, так и спортсменов [46].
Магнерот успешно используется в лечении АГ. В исследовании группы 150 беременных с АГ и ДСТ отмечено достоверное снижение симптоматики ДСТ, АГ, более благоприятное течение беременности и успешное родоразрешение [47]. У детей с длительной АГ, осложненной гипертрофией миокарда левого желудочка, показано преимущество комбинированной терапии ингибиторами АПФ в сочетании с препаратом Магнерот. Отмечены повышение толерантности к физической нагрузке, нормализация регуляции АД, снижение пространственной дисперсии реполяризации [48].
Клинико-инструментальные исследования показали, что долговременный прием оротата магния приводит к улучшению состояния детей с такими формами ДСТ сердца, как пролапс митрального клапана и аномальная chordae tendineae [49]. Долговременный прием оротата магния (2 курса в год в течение 15 лет; один курс лечения – 3 таб/сут Магнерота в течение 3 месяцев) приводил к существенному улучшению состояния пациентов с пролапсом митрального клапана (n=31). Отмечено значительное сокращение среднего и максимального сердечного ритма, число эпизодов тахикардии, продолжительность интервалов QTc, пароксизмальных, суправентрикулярных и желудочковых экстрасистол. Отмечено также снижение повышенного систолического и диастолического АД, снижение риска симпатикотонии в 2 раза и риска дисбаланса симпатических и парасимпатических ветвей в 5 раз. В результате регулярного применения оротата магния также отмечено отчетливое улучшение качества жизни пациентов [50].
Исследование вариабельности сердечного ритма у 72 пациентов с ДСТ показало, что прием препарата Магнерот в течение 4 месяцев оказал достоверное корректирующее действие на вегетативное обеспечение сердечной деятельности у пациентов с ДСТ. Использование препаратов магния (Магнерот) в составе комплексной терапии МС способствует восстановлению чувствительности инсулиновых рецепторов, нормализации метаболизма и реологических показателей крови, обеспечивая профилактику атеросклероза и сердечно-сосудистых осложнений [52]. В группе пациентов санатория (n=720) с МС, СД, ИБС, АГ и различными сочетаниями этих заболеваний использовался стандартный и модифицированный комплексы лечебных процедур. Прохождение пациентами модифицированной лечебной программы с применением Магнерота было эффективнее стандартной терапии для всех групп пациентов [53].
Адъювантное лечение оротатом магния снижает смертность и интенсивность клинических симптомов у пациентов с тяжелой сердечной недостаточностью, получавших стандартную фармакотерапию [54]. Выявлено положительное действие оротата магния на липидный обмен у пациентов с хронической сердечной недостаточностью в сочетании с СД 2 типа [55].
Комплексная терапия, включающая препарат Магнерот и β-адреноблокатор (метапролол), успешно используется в лечении и профилактике суправентрикулярных тахиаритмий при оперативных вмешательствах на органах мочеполовой системы пациентов с сочетанной урологической и кардиологической патологией [56].
Заключение
Недостаточное потребление магния является одним из важнейших факторов развития МС, АГ, атеросклероза крупных артерий и аритмии уже в молодом возрасте. В среднем и пожилом возрасте недостаточность магния участвует в формировании ИБС, нестабильной стенокардии, ИМ, ФП.
В итоге гипомагнеземия ассоциирована с более высокой сердечно-сосудистой смертностью: 3,4 случая на 1000 человек при выраженной гипомагнеземии (Mg сыворотки ≤0,73 ммоль/л) и 1,5 случая на 1000 человек при уровнях Mg сыворотки более 0,73 ммоль/л. Крупномасштабное российское скрининговое исследование показало [35, 36, 57], что риск сердечно-сосудистой патологии достоверно повышается при снижении уровней магния в плазме крови менее 0,82 ммоль/л. Профилактика недостаточности магния осуществляется путем коррекции диеты (исключение насыщенных жиров и избытка углеводов, включение рыбы, зеленолистных салатов, овощей, морских водорослей, минеральной воды с высоким содержанием магния). Но как бы ни была оптимизирована диета кардиологического пациента, гарантией достаточного поступления магния в организм (не менее 300–500 мг/сут) служит обязательное использование препаратов магния на основе органических солей.
Примером такого препарата магния является Магнерот, имеющий безупречную многолетнюю историю использования в кардиологии. Отечественные исследователи получили уникальный опыт долговременного использования Магнерота. Комплексное воздействие оротата магния на сердечно-сосудистую функцию обусловливает успешность применения данного препарата в профилактике и лечении хронической АГ, пролапса митрального клапана и аномальной chordae tendineae, МС, сердечной недостаточности, ИМ и других форм ИБС.



