Введение
Дегенеративные заболевания позвоночника (ДЗП) являются одной из наиболее актуальных проблем клинической медицины. Наиболее яркое проявление этой патологии – формирование грыжи межпозвонкового диска (ГМД), сопровождающееся выраженным болевым синдромом, а в ряде случаев – стойкими неврологическими выпадениями. Следует также отметить, что проведенное оперативное вмешательство по удалению ГМД не останавливает дегенеративный процесс, который может приводить к возникновению повторных грыж диска. С другой стороны, нарушенная регуляция активности ферментов соединительной ткани приводит к развитию выраженного послеоперационного фиброза, что является причиной тяжелого, труднокупируемого болевого синдрома.
Достаточно длительно существовало мнение, что ДЗП являются результатом механической перегрузки [1]. По мере накопления экспериментальных и клинических данных стало очевидным, что обедненная васкуляризация и сниженное кровоснабжение ткани диска являются не менее важными факторами ДЗП [2–4]. Риск дегенеративных изменений позвоночника повышается с возрастом и обусловлен нарушениями трофики межпозвонковых дисков вследствие разнообразных факторов: избыточных механических нагрузок, снижения васкуляризации и кровоснабжения межпозвонковых дисков, возрастающей с годами интенстивности системного воспаления, недостатка эссенциальных макро- и микронутриентов (как правило, возрастающего с тализации химических элементов в тканях, генетических факторов.
Одним из перспективных направлений патогенетической терапии дисплазии соединительной ткани (ДСТ) является использование макро- и микронутриентов. В частности, магний оказывает выраженное воздействие на структуру соединительной ткани и обнаружение дефицита магния у пациентов с ДСТ указывает на необходимость нутрициологической коррекции дефицита с помощью препаратов органического магния [5]. Проведенный нами ранее систематический анализ молекулярных механизмов воздействия магния на структуру и функцию соединительной ткани [6] указал на многочисленные фундаментальные механизмы, посредством которых магний воздействует на биосинтетические процессы в соединительной ткани. Эти механизмы суммированы на рис. 1.
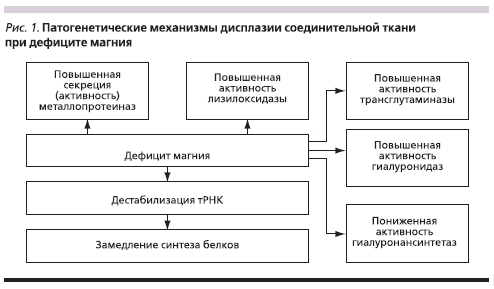
Несмотря на очевидную роль дефицита магния в нарушении метаболизма в соединительной ткани и патогенезе ДЗП, клинических исследований, изучавших ДЗП с позиций ДСТ, проведено не было. Целью нашего клинического исследования явились изучение фенотипических проявлений ДСТ при ДЗП и возможность их элементной коррекции с помощью магния оротата (Магнерот®).
Материал и методы
Было проведено проспективное исследование, включившее 60 человек: 1-ю группу составили 20 пациентов, которые после хирургического лечения по поводу ГМД пояснично-крестцового отдела позвоночника в послеоперационном периоде получали препарат Магнерот®, 2-ю группу – 20 пациентов, которые после хирургического лечения по поводу ГМД пояснично-крестцового отдела позвоночника получали стандартное реабилитационное лечение в послеоперационном периоде; 3-ю группу (сравнения) составили 20 пациентов с недифференцированной ДСТ.
Для пациентов с ГМД (группы 1 и 2) критериями включения в исследование являлись:
• стойкий выраженный корешковый болевой синдром, сохраняющийся в течение не менее 6 недель, несмотря на проводимую стандартную консервативную терапию;
• возраст от 40 до 60 лет;
• данные магнитно-резонансной томографии (МРТ), подтверждающие наличие ГМД пояснично-крестцового отдела позвоночника на одном уровне.
Критерии исключения:
• каудальный синдром;
• выраженный моторный дефицит;
• наличие операции на позвоночнике в анамнезе;
• фораминальные и экстрафораминальные грыжи диска;
• МРТ-признаки спинального стеноза;
• предшествующая патология позвоночника;
• тяжелая соматическая патология;
• возраст меньше 40 и старше 60 лет.
• Критерии включения в 3-й группе (сравнения):
• возраст от 40 до 60 лет;
• верифицированный диагноз синдрома ДСТ.
Критерии исключения:
• тяжелая соматическая патология;
• возраст меньше 40 и старше 60 лет. Пациентам 1-й и 2-й групп до операции проводили МРТ-исследование, функциональную рентгенографию пояснично-крестцового отдела позвоночника, тщательный неврологический осмотр, оценку болевого синдрома по визуальной аналоговой шкале (ВАШ) и опроснику Oswestry (OSWESTRY DISABILITY INDEX – ODI), исследование фенотипических признаков ДСТ, оценку гипермобильности суставов по Breighton, исследование клинических признаков дефицита магния. Всем пациентам выполнена стандартная микродискэктомия по Caspar. Проведен
полиэлементный анализ операционного материала – ткани межпозвонкового диска, а также образцов волос пациента с использованием масс-спектрометра с индукционно связанной плазмой (Perkin Elmer, США).
Через 3 дня после операции пациенты 1-й группы начали прием препарата Магнерот® в дозе 1000 мг (2 таблетки) 3 раза в сутки, который продолжался в течение 4 месяцев. Во время терапии препаратом Магнерот® проведен мониторинг побочных эффектов.
На 180-й день исследования у пациентов 1-й и 2-й групп проведено повторное исследование неврологического статуса, болевого синдрома по шкалам ВАШ и ODI, исследование клинических признаков дефицита магния и определение уровня магния в биосубстратах. В группе сравнения – однократное изучение фенотипических проявлений синдрома ДСТ, оценка гипермобильности суставов по Breighton [7], исследование клинических признаков дефицита магния, полиэлементный анализ образцов волос, содержание магния в плазме крови.
Диагноз ГМД установлен с помощью МРТ. Обследование проведено без контраста на 1,5 Т томографе (GESigmaOvation Excite 0,35) с выполнением стандартных последовательностей. Для оценки выраженности болевого синдрома использована 10-балльная шкала ВАШ, где 0 – отсутствие боли, 10 – максимальная ее выраженность. Для оценки уровня жизни использован опросник OSWESTRY, русская версия 2.1; максимальная сумма баллов – 50. Исследование фенотипических проявлений ДСТ проведено с учетом рекомендаций Нечаевой Г.И. и соавт. (2009) [8], а также Мартынова А.И. и соавт. (1996) [9]. Для постановки диагноза недифференцированной ДСТ считали достаточным наличие трех внешних фенотипических проявлений. Оценка гипермобильности суставов проведена по шкале Breighton; гипермобильность суставов диагностирована при наличии четырех признаков у лиц моложе 50 и двух критериев у лиц старше 50 лет. Оценка клинических признаков дефицита магния проведена с помощью соответствующего опросника (Громова О.А. и соавт., 2008).
Исследование элементного состава межпозвонкового диска и волос осуществлено сотрудниками кафедры клинической и лабораторной диагностики ГОУ ВПО РГМУ Росздрава методом масс-спектрометрии с индукционно-связанной плазмой.
Статистическая обработка собранных данных проведена с помощью пакета прикладных программ Statistica 6.0 и электронных таблиц Microsoft Excel. С учетом соответствия изучаемых признаков нормальному распределению использованы методы параметрической статистики.
Результаты и обсуждение
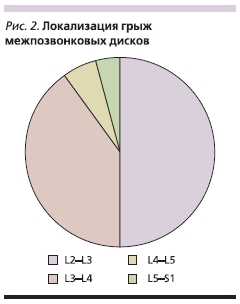
Средний возраст пациентов, включенных в исследование, в 1-й группе составил 52 ± 8 лет, во 2-й – 54 ± 6, в 3-й – 53 ± 7; различий между группами выявлено не было. Средняя длительность корешковых болей до операции составила 6,5 ± 3,0 недели в 1-й группе, 6,2 ± 2,4 недели – во 2-й. По данным МРТ у пациентов выявлены грыжи диска L5–S1 (n = 21),L4–L5 (n = 16), L3–L4 (n = 2) , L2–L3 (n = 1) позвонков (рис. 2).
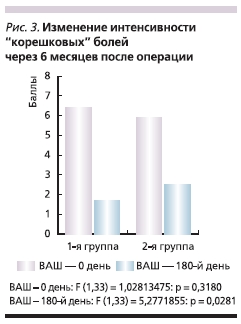
На начало исследования у пациентов 1-й группы выраженность радикулярных (“корешковых”) болей по ВАШ составила 6,30 ± 1,27 балла, оценка уровня жизни по ODI – 30,6 ± 3,2 балла. Во 2-й группе оценка по ВАШ составила 5,94 ± 1,1, по ODI – 30,25 ± 5,5 балла. Значимых различий между группами выявлено не было. При динамическом наблюдении в течение 6 месяцев после операции было отмечено значительное уменьшение интенсивности болевого синдрома и уровня жизни в целом у пациентов обеих групп. В 1-й группе выраженность болей в ноге по ВАШ через 6 месяцев после операции составила 1,6 ± 0,71, сумма баллов по ODI – 7,9 ± 2,8. При сравнении с исходными показателями отмечено значительное уменьшение каждого из изучаемых показателей (p < 0,00001).
У пациентов 2-й группы через 6 месяцев после операции также было отмечено значимое уменьшение интенсивности болей в ноге по ВАШ (2,4 ± 0,92; p < 0,0001), улучшение уровня жизни по ODI (10,3 ± 2,5, p < 0,0001). Следует отметить, что в 1-й группе (пациенты, принимавшие Магнерот®) наблюдалось более заметное снижение интенсивности корешковых болей, чем во 2-й группе (р < 0.03; рис. 3).
Проводимый мониторинг побочных эффектов препарата Магнерот® выявил его хорошую переносимость. У троих пациентов в начале приема препарата отмечено учащение стула, прекратившееся в течение недели без отмены Магнерота®. Иных побочных эффектов выявлено не было.
Следует отметить, что соблюдение режима приема препарата не требовало принятия дополнительных дисциплинарных мер. Пациенты, получавшие Магнерот®, отметили повышение работоспособности, снижение утомляемости и улучшение общего самочувствия. Это проявилось значительным по сравнению со 2-й группой улучшением качества жизни через 6 месяцев после операции (р = 0,0003). Поэтому даже по окончании 4-месячного курса лечения многие пациенты обращались к лечащему врачу с просьбой о продлении терапии препаратом Магнерот®.
Статистический анализ также показал, что на фоне приема органического магния в виде препарата Магнерот® в течение 4 месяцев выраженность остаточных болей в ногах была значимо ниже (p = 0,004), а уровень жизни выше (p = 0,014), чем при стандартном ведении послеоперационного периода.
Полученные в настоящем исследовании данные о благоприятном влиянии магния на течение послеоперационного периода не являются случайными. Известно, что в процессе формирования болевых синдромов, в первую очередь хронических, значительную роль играет именно нарушение локального гомеостаза магния. Существующий у пациентов выраженный болевой синдром является интенсивным стрессовым фактором. В то же время хорошо известно, что патологический стресс – это важнейший фактор, способствующий возникновению дефицита магния [10].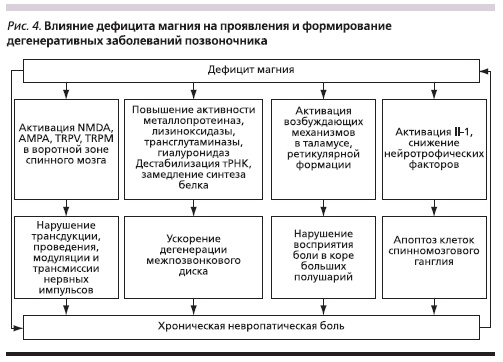
По нашему мнению, дефицит магния, возникающий у пациентов с ГМД, является абсолютно закономерным, более того – может вносить свой вклад в клиническую картину заболевания. Важным наблюдением является различная динамика клинических проявлений дефицита магния в послеоперационном периоде в разных группах. Так, на фоне приема органического магния в виде магния оротата у пациентов 1-й группы отмечен полный регресс клинических проявлений магниевого дефицита. В то же время у пациентов 2-й группы, напротив, появившиеся симптомы дефицита магния не регрессировали в послеоперационном периоде, несмотря на значительное уменьшение болей и улучшение общего эмоционального фона. Возможно, именно сохраняющийся дефицит магния является одним из важных факторов, способствующих возникновению и сохранению остаточных болей в послеоперационном периоде. Интенсивный болевой синдром запускает формирование порочного круга: боль–стрессдефицит магния–усиление и хронизация боли, что определяет эффективность и необходимость включения органических солей магния в лечение дегенеративной патологии позвоночника (рис. 4).
При повторном исследовании клинических проявлений магниевого дефицита через 6 месяцев после операции у пациентов, получавших препарат Магнерот®, было отмечено значительное уменьшение клинических проявлений дефицита (р = 0,008). Пациенты указывали на улучшение сна, стабилизацию артериального давления, регресс неприятных ощущений в области сердца, уменьшение аритмии, судорог в ногах, значительное улучшение эмоционального фона. Во 2-й группе значимого уменьшения клинических проявлений магниевого дефицита выявлено не было.
Нами проведен корреляционный анализ клинических проявлений магниевого дефицита, ДСТ, интенсивности болевого синдрома и оценки уровня жизни в начале исследования через 6 месяцев после операции. Оказалось, что у пациентов 1-й группы сохранялась положительная связь между клиническими признаками дефицита магния и интенсивностью остаточных болей в ноге по ВАШ через 6 месяцев после операции (r = 0,58; p = 0,05). Исследование уровня магния в плазме пациентов также показало заметную положительную динамику при приеме препарата Магнерот®. Обе группы характеризовались пониженными уровнями магния плазмы на момент начала исследования: 0,58 ± 0,10 ммоль/л в 1-й группе и 0,60 ± 0,11 – во 2-й. На 180-й день уровни магния практически не изменились у пациентов 2-й группы (0.59 ± 0,10 ммоль/л), но значительно увеличились у пациентов 1-й группы, получавших магния оротат (0,72 ± 0,1 ммоль/л, р < 0,04). Таким образом, прием препарата способствовал восполнению магниевого депо пациентов, что и объясняет описанную выше положительную динамику клинической симптоматики.
Важный раздел проведенного исследования включал изучение элементного профиля ткани межпозвонкового диска и образцов волос пациентов с ГМД, а также образцов волос пациентов с недифференцированной ДСТ. В настоящей работе нами было проведено первое систематическое исследование гистологии и элементного профиля межпозвонковых дисков.
Таблица 1. Элементы, содержащиеся в наибольших концентрациях в исследованных ГМД.
Изучение элементного профиля включило следующие этапы:
• качественную и количественную характеристику элементного профиля межпозвонкового диска;
• изучение корреляционных связей между элементным профилем межпозвонкового диска, волос пациентов 1-й и 2-й групп и их клинической характеристикой;
• изучение гистологических особенностей грыж и их взаимосвязи с микроэлементным составом.
Изучение содержания макро- и микроэлементов в грыжах позвоночных дисков пациентов 1-й и 2-й групп показало высокое содержание макроэлементов C, N, P, S и Mg. Привлекают внимание некоторые особенности элементного состава грыж (табл. 1). Так, уровень магния превышает уровень кальция более чем в 3 раза, а уровень алюминия приближается к уровню кальция.
Следует отметить чрезвычайно высокое содержание олова и сравнительно высокое содержание железа в исследованных образцах. Нами была установлена обратная корреляция между содержанием олова в ткани грыжи и интенсивностью боли по шкале ВАШ на 180-й день (r = -0,48, p < 0,001), а также клиническими проявлениями дефицита магния на 0 и 180-й дни (r = -0,47, p < 0,001; r = -0,47, p < 0,002 соответственно). Жизненная необходимость олова не является доказанной, при этом нельзя исключать, что именно межпозвонковый диск является депо данного элемента.
Поскольку все исследованные образцы межпозвонковых дисков (грыжи) представляют собой патологически измененную соединительную ткань, невозможно дать однозначную интерпретацию наблюдаемому содержанию микроэлементов. В целом их содержание в грыжах с различной гистологией (см. далее) гораздо более информативно.
При проведении корреляционного анализа связей между элементным профилем исследованных грыж и клинико-морфологическими характеристиками пациентов была установлена обратная корреляция между уровнями боли по шкале ВАШ и концентрацией лития в ткани грыжи (r = -0,53, p < 0,001), а, как известно, пониженные концентрации лития в плазме крови сочетаются с повышенной болевой чувствительностью [10].
Обнаружена корреляция между клиническими проявлениями дефицита магния и уровнем бора в ткани грыжи: чем ниже концентрация бора, тем более выражен дефицит магния (r = -0,6; p < 0,0001). Известно, что здоровье не только костной ткани, но и хрящевой, а также тканей связочного аппарата зависит от гармоничной пропорции концентраций макро-и микроэлементов – магния, кальция, бора, цинка и марганца. Подобная корреляция обнаружена и с алюминием (r = -0,66; p < 0,001), кремнием (r = -0,5; p < 0,001), молибденом (r = -0,63; p < 0,001). Следует также отметить, что уровни этих элементов в ткани грыжи зависят от уровня магния (r = 0,7–0,8; p < 0,0001).
Установлена корреляция между уровнем магния в грыжах и баллами по опроснику ODI: так, более высокий балл по ODI был связан с более низким уровнем магния (r = -0,44; p < 0,0001). Такие же корреляции были найдены для калия (r = -0,78; p < 0,0002). Следует отметить, что для пациентов 1-й и 2-й групп характерными были повышение (> 26 кг/м2) индекса массы тела (ИМТ) и отчетливая гиперстеническая конституция. Общеизвестно, что повышенный ИМТ тесно связан с инсулинорезистентностью и глюкозотолерантностью. Мы обнаружили, что уровни ванадия и хрома, контролирующих обмен глюкозы, имели между собой высокий коэффициент корреляции (r = 0,7; p < 0,0001). Нами установлено, что чем меньше ванадия и хрома в ткани грыжи, тем более выражены клинические проявления дефицита магния, также участвующего в регуляции углеводного обмена (V и Mg – r = -0,5; p < 0,00001, Cr и Mg – r = -0,5; p < 0,00001).
Из приведенных выше примеров очевидно, что микроэлементный состав ткани грыж в значительной степени коррелирует с клиническими параметрами. Очевидно, что взятие проб ткани межпозвонковых дисков возможно только при оперативном вмешательстве, поэтому представляет интерес изучение корреляций между содержанием микроэлементов в ткани диска и их содержанием в волосах пациентов. Неинвазивное исследование микроэлементного состава волос удобно тем, что волосы являются доступным твердым биосубстратом, пригодным для хранения.
Наиболее сильные корреляции между элементным составом ткани грыж и волос были обнаружены для элементов лития (r = 0,84; p < 0,00003) и бора (r = 0,79; p < 0,0006). Для остальных элементов, включая магний, корреляции были намного более слабыми, но статистически значимыми (абсолютные значения “r” составляли 0,2–0,5; p < 0,001). Установленные корреляции между составом волос и элементным составом ткани ГМД позволяют сделать прогнозы состава грыж на основе данных элементного состава волос пациента. С учетом рассмотренных выше корреляций с клиническим состоянием пациента эти прогнозы можно учитывать для разработки плана его ведения. Например, низкое содержание лития в волосах пациента указывает на то, что у него будет выражен болевой синдром, а низкие концентрации бора указывают на снижение уровня магния в ткани диска.
Один из наиболее важных результатов данного исследования получен при изучении элементного состава в тканях грыж с различной гистологией.
В исследованных образцах грыж пациентов 1-й и 2-й групп было найдено два условных гистологических типа соединительной ткани:
1-й тип – ткань рыхлая, хрупкая и крошащаяся (18 образцов);
2-й тип – ткань густая, вязкая, высокоэластичная (22 образца).
Следует отметить, что эти два типа ткани были равномерно распределены в 1-й и 2-й группах пациентов. Тем не менее 1-й тип ткани грыжи диска соответствовал более интенсивным болям по шкалам ВАШ и ODI (p = 0,09). Отсутствие различий между интенсивностью клинических проявлений дисплазии, соответствующих 1-му и 2-му типам ткани, указывает на то, что оба гистологических типа соответствуют дисплазии, т. е. анормальному метаболизму соединительной ткани.
Элементный анализ образцов двух гистологических типов указывает на фундаментальные различия в патофизиологии этих типов изменений ткани межпозвонкового диска. Так, ткани грыжи диска 1-го типа содержали значительно меньше как структурных элементов (азота, серы, углерода), так и эссенциальных микроэлементов. Например, содержание углерода, основного структурного элемента, было значительно ниже в ткани 1-го типа (p = 0,001), так же как и содержание серы (p = 0,005). Разница концентраций микроэлементов в тканях 1-го и 2-го типов еще более выражена (табл. 2).
Следует особо отметить различие в уровнях стронция – эта корреляция была одной из самых заметных (р = 0,006). В настоящее время проводится активное изучение влияния стронция на метаболизм хряща и костной ткани, также проводится апробация препаратов стронция для лечения остеопороза.
Таблица 2. Концентрация эссенциальных элементов в тканях 1-го и 2-го типов (мкг/г).
Данные, приведенные в табл. 2, однозначно указывают на преобладание всех рассмотренных эссенциальных элементов в образцах ткани 2-го типа. Существенно более низкое содержание макро- и микроэлементов в ткани 1-го типа может указывать на ее гипотрофию и усиленные процессы дегенерации. Как известно, в тканях со сниженным уровнем метаболизма происходит обеднение эссенциальными микроэлементами. В итоге происходит накопление токсичных элементов. Известно, что максимальное количество токсичных элементов может аккумулироваться в костной и хрящевой тканях, а также в дентине зубов [10]. Эти патофизиологические механизмы подтверждаются результатами исследования микроэлементного состава ГМД. Действительно, уровни токсичных и условно-токсичных элементов были гораздо выше в ткани 1-го типа (табл. 3).
Таблица 3. Концентрация токсичных и условно-токсичных элементов в тканях 1-го и 2-го типов (мкг/кг).
Особо следует отметить достаточно важное наблюдение, сделанное в ходе настоящего исследования: концентрация некоторых элементов в волосах зависит от гистологического типа грыжи. Так, “гипотрофические” грыжи 1-го типа характеризовались гораздо более низким содержанием лития, цинка, бора и магния (табл. 2). Одновременно у пациентов с грыжами 1-го типа также наблюдались более низкие уровни лития, калия, цинка, бора и магния в волосах (табл. 4). Эти корреляции позволяют прогнозировать состояние грыжи на основе анализа волос и подбирать наиболее приемлемый для данного пациента курс лечения.
Таблица 4. Корреляции между концентрациями микроэлементов в волосах и соответствующими типами тканей грыж.
Заключение
Дефицит магния является одним из факторов, способствующим накоплению токсичных элементов в тканях организма, в т. ч. в хряще межпозвонковых дисков. С другой стороны, магний вытесняет токсичные, провоспалительные элементы из организма, в частности из соединительной ткани, что лежит в основе терапии ДЗП органическими препаратами магния, применение которых способствует восстановлению соединительной ткани. В настоящем исследовании большинство пациентов с ГМД имели явные признаки ДСТ. Дефицит магния приводил к усилению и хронизации болевого синдрома, в то время как у пациентов, принимавших Магнерот®, наблюдалось снижение интенсивности корешковых болей и улучшение качества жизни через 6 месяцев после операции. В настоящем исследовании впервые была выявлена взаимосвязь между элементным составом ткани грыж и элементным составом волос. Установлено принципиальное различие в гистологии соединительной ткани грыж: 1-й гистологический тип – ткань рыхлая, хрупкая и крошащаяся; 2-й гистологический тип – ткань густая, вязкая, высокоэластичная. Полученные данные однозначно указывают на дефицит эссенциальных элементов в образцах ткани 1-го типа, что может соответствовать гипотрофии ткани. Обнаруженные в настоящем исследовании корреляции клинических и гистологических проявлений
спинальных грыж с микроэлементным статусом пациента могут быть использованы для прогнозирования состояния больного и разработки индивидуальной схемы ведения пациентов, включая назначение препаратов магния.


