Судорогами называют непроизвольные мышечные сокращения, существенно различающиеся по продолжительности, интенсивности, локализации, этиологии и патогенезу. В зависимости от механизма развития выделяют эпилептические и неэпилептические судороги. Последние могут быть связаны с патологией центральной и периферической нервной систем.
Хорошо известно, что развитию судорог способствуют нарушения минерального баланса, в частности гипомагнезиемия. Дефицит магния часто не учитывают при анализе патофизиологии судорог различной этиологии. Между тем участие магния в нервно-мышечной работе убедительно доказано методами доказательной медицины и эпидемиологическими исследованиями [1–3]. По базам данных научных публикаций отмечается рост исследовательского интереса к изучению взаимосвязи дефицита магния и возникновения судорог (рис. 1).
Среди данного массива публикаций имеются сотни экспериментальных и клинических исследований, указывающих на взаимосвязь между обеспеченностью организма магнием и купированием судорог.
Одно из первых внутривенных введений магния было произведено французским акушером М. Бертраном в 1906 г. для снятия судорог при эклампсии. Преэклампсия встречается среди 5–50 % женщин и приводит к самому тяжелому осложнению беременности – эклампсии. Общепризнанной терапией является внутривенное введение сульфата магния.
Приведем пример современного исследования доказательной медицины. Различные противосудорожные препараты используются для контроля судорог на фоне эклампсии. Кокрановский мета-анализ рандомизированных исследований, суммарно включивший данные 397 женщин, показал, что внутривенное введение сульфата магния было связано с более эффективной профилактикой судорог (отношение шансов – 0,06; 95 % достоверный интервал – 0,03–0,12), чем использование смеси антисудорожных препаратов аминазина, прометазина и петидина [4].
Имеющиеся данные фундаментальных исследований указывают на возможные молекулярные механизмы возникновения судорог при преэклампсии. В частности, сравнительное исследование экспрессии генов в 10 плацентах, полученных после физиологических родов, 10 – от пациенток, перенесших преэклампсию и 8 пациенток с преэклампсией, получавших сульфат магния, показало патогенетическую важность использования магния при эклампсии на молекулярном уровне.
Магния сульфат применялся в нагрузочной дозе 4 г за 30 минут с последующим введением 1 г/ч в течение 6 часов. Десяти женщинам группы сравнения вводили физиологический раствор. Установлено (р < 0,001), что у женщин с преэклампсией были повышены уровни экспрессии генов рецептора, подобных рецептору кальцитонина (CRLR – calcitonin receptor-like receptor), белка, модифицирующего активность рецепторов (RAMP-1 – Receptor Activity Modifying Protein-1) и индуцибельной синтетазы оксида азота (iNOS). Применение сульфата магния приводило к статистически более значимой (р < 0,05), более высокой экспрессии генов кальцитонин-связанного пептида (СGRP), гена CRLR и эндотелиальной синтетазы (eNOS). Эти изменения соответствуют расслаблению эндотелия сосудов, снижению спазма и судорожной готовности. Кальцитонин-связанный пептид, кодируемый геном СGRP, стимулирует вазодилатацию посредством активации CRLR с участием белка RAMP-1 [3].
Таким образом, пример связанных с преэклампсией судорог показывает срез имеющихся исследований – от фундаментальных работ, указывающих на молекулярные механизмы действия магния, до работ по доказательной медицине.
Судороги в практике врача и дефицит магния
Во врачебной практике наиболее известны болезненные судороги отдельных мышц (например, икроножных). Они связаны с возникновением в мышцах (чаще после перегрузок) участков локального спазма: ночные судороги икроножных мышц, писчий спазм, спазм наружной крыловидной мышцы при открывании рта, судороги различных групп мышц у спортсменов. Участки локального мышечного спазма прощупываются в виде уплотнений, надавливание на которые болезненно. Мышечные перегрузки – далеко не единственная причина судорог. Известны токсические судороги; судороги при дефиците пиридоксина; при гипогликемии; судороги, возникающие под действием психогенных факторов; при чрезмерной физической нагрузке и перенапряжении мышц; при столбняке, метаболических расстройствах и др.
Особенно легко судороги возникают у детей, что бывает обусловлено своевременно незавершенным структурно-функциональным созреванием мозга, внутриутробными поражениями центральной нервной системы и пороками развития.
Регулярно повторяющиеся судороги указывают на первичность дефицита магния и описываются как “спазмофилия”, “конституциональная тетания”, “нормокальциевая тетания”. Терапия кальцием этой группы пациентов может еще больше усиливать клинические проявления спазмофилии и судороги, в то время как методом патофизиологического лечения является назначение именно препаратов магния [5].
Следует отметить, что судорожные проявления являются неотъемлемым клиническим признаком дефицита магния.
Известны следующие симптомы дефицита магния в организме [1]:
• При дефиците магния возникает разнообразная клиническая симптоматика судорог. У пациента с дефицитом магния еще до появления непосредственно самих судорог повышается судорожная готовность. Это диагностируется при оценке коленного рефлекса (отмечается его оживление – избыточное и ускоренное разгибание нижней конечности в коленном суставе при ударе по сухожилию четырехглавой мышцы бедра ниже коленной чашечки.
• При выявлении симптома Хвостека – вызывается легким постукиванием пальца или молоточком по стволу лицевого нерва, чаще всего в области бифуркации лицевого нерва.
И повышение коленного рефлекса, и появление симптома Хвостека свидетельствуют об усилении тока и избыточном генерировании импульсов в рефлекторной дуге.
Предвестниками судорог, связанных с дефицитом магния, являются также специфические нервно-мышечные знаки:
• покалывания в области стоп и ладоней (парестезии), связанные с перевозбуждением чувствительных окончаний;
• гиперактивность (человек постоянно двигается, даже во сне;
• паллакиурия – частые позывы на мочеуспускание малыми порциями (требуется дифференциальный диагноз с циститом);
• спазм (“ком”) в области глотки.
Нервно-мышечные знаки указывают на нейровегетативные регуляторные расстройства, приводящие к затрудненной реполяризация клеток гладкой и скелетной мускулатуры [1, 6, 7].
Вариантом судорожного состояния является тремор – дрожание. Озноб и дрожание при охлаждении направлены на экстренную защиту организма от потери тепла. При переохлаждении уровень магния в крови и внутри миоцитов снижается, истощаются ресурс глюкозы и падает энергообмен. Следует отметить, что при выходе из запоя пациенты, страдающие алкоголизмом, часто испытывают состояние т. н. потрясающего озноба, гипотермии, дрожания; нередко абстиненция сопровождается сердечной экстрасистолией, судорогами икроножных мышц. Препараты магния используют и для решения энергетического дефицита, и для купирования судорог при алкоголизме.
Ниже рассмотрены биохимия мышечного сокращения и физиологическая роль магния, взаимосвязь дефицита магния для профилактики судорог и судорожных состояний. Подробно изложены особенности синергидной терапии, использование магния и одного из его органических фармакологических лигандов – оротовой кислоты [8].
Биохимия мышечного сокращения
Скелетная мышца состоит из миллионов мышечных волокон, связанных соединительнотканными волокнами. Мышечное сокращение представляет собой укорочение или изменение напряжения мышечных волокон, составляющих мышцу. Различают сокращения: изометрическое, при котором длина мышечных волокон остается неизменной, а напряжение их возрастает; изотоническое – с укорочением и утолщением мышцы, но без существенного изменения ее напряжения. Изометрическим и изотоническим сокращением мышц представлены регулярные циклы сокращения-расслабления, судороги возникают при нарушении цикличности этого процесса.
Структурной единицей мышечного волокна являются миофибриллы – особым образом организованные пучки белков, располагающиеся вдоль клетки. Сокращается боковая цепь мышечного волокна. В этом процессе участвуют два белка: миозин и актин.
Сокращение мышцы вызывается нервным импульсом, который через нервно-мышечный синапс при посредстве медиатора трансформируется в механический эффект. Нервный импульс в фазе потенциала действия вызывает высвобождение ионов Ca2+, которые взаимодействуют с белками мышечных клеток и вызывают сокращение миофибрилл. Ионы магния, наоборот, являются физиологическими антагонистами кальция и опосредуют расслабление миофибрилл.
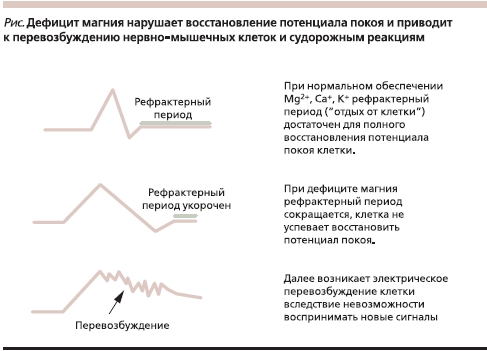
Помимо участия в функционировании миофибрилл магний играет непреходящую роль в передаче нервного импульса. Магний – физиологический регулятор возбудимости клетки, необходимый для деполяризации клеточной мембраны нервных и мышечных клеток. При недостатке магния клетка становится сверхвозбудимой (рис. 2). Наиболее очевидным молекулярным механизмом влияния магния на возбудимость нейронов является ингибирование активности NMDA-(N-метил-D-аспартат)-рецепторов (глутаматных рецепторов). Активация NMDA-рецепторов необходима для быстрой синаптической передачи сигнала и в головном мозге, которая происходит в результате изменения потока натрия (калия) через мембрану. Чрезмерная стимуляция NMDA-рецепторов может приводить к судорогам эпилептического типа, в то время как их блокирование магнием снижает возбудимость нервных путей.
Поскольку магний играет фундаментальную роль в физиологии передачи нервного импульса и сокращении миофибрилл, снижение его уровня способствует повышению нервно-мышечной возбудимости, вызывает тетанию и приводит к описанной выше клинической симптоматике дефицита магния.
Дефицит магния и особенности магнезиальной терапии
Различают первичный и вторичный дефициты магния. Первичный дефицит магния обусловлен врожденными нарушениями минерального обмена: почечной тубулопатией, снижением всасывания магния в кишечнике и др.
Вторичный дефицит магния возникает при недостаточном восполнении его потерь (с пищей, питьем). Механизм такого состояния заключается не только в недостаточном поступлении магния, но и в усилении потерь с мочой. Вторичный дефицит магния может возникать также при нарушении регуляции ионного метаболизма, при глутеновой энтеропатии, укорочении кишечника после его резекции и пр. Если причина вторичного дефицита магния известна, ситуацию удается нормализовать, воздействуя на первопричину дефицита.
При дефиците магния любой этиологии показана коррекция его содержания в организме. У здорового человека концентрация магния в сыворотке крови поддерживается в достаточно узком диапазоне (норма – 0,75–1,26 ммоль/л, у беременных – нижняя граница > 0,81 ммоль/л). Этот внеклеточный магний находится в непрерывном обмене с магниевыми запасами костей и мышечной ткани.
С точки зрения профилактики судорог и других проявлений для большинства пациентов важна профилактика именного вторичного дефицита магния. Уменьшение количества ежедневно принимаемого магния может компенсироваться возрастающей адсорбцией магния в кишечнике и уменьшением выделения его через почки. Это можно обеспечить употреблением определенных пищевых продуктов. В России текущая физиологическая суточная потребность в магнии у взрослых – около 400 мг/сут (максимально – до 800 мг/сут). Сбалансированный рацион должен содержать магний в количестве ≈ 400 мг/сут, из которого у здорового человека адсорбируется около 200 мг.
Потребность в магнии оценена в различных эпидемиологических исследованиях. Интересно разобрать последнее исследование, проведенное в Китае (2009) [3]. При оценке рациона питания 324 человек 55–70 лет было показано, что среднее содержание магния в эритроцитах значительно ниже у пациентов с повышенным давлением с верифицированным диагнозом артериальная гипертензия (АГ) – 2,0 ммоль/л по сравнению с нормотониками (2,2 ммоль/л, р < 0,005). Диетарное потребление магния было значительно ниже в группах пациентов с диагнозом АГ (316 мг/сут), сахарным диабетом (323 мг/сут) по сравнению с пациентами с нормальными показателями сахара крови и артериального давления (374 мг/сут, р < 0,05). При потреблении магния ниже нормы мышечные судороги развиваются в сроке от 1 до 6 недель.
Во многих случаях компенсировать недостаток магния только диетическими мероприятиями не удается и тогда возникает необходимость применения фармакологических препаратов, содержащих магний. К недостаткам магниевых препаратов I поколения относят не только относительно низкие всасываемость и усвоение, но и замедленное включение его в метаболизм. В последние 20 лет отмечается довольно стойкая тенденция к переходу на II и последующие поколения магнийсодержащих препаратов, в которых минерал содержится в виде органической соли или комплекса с аминокислотами (например, оротат магния).
Органические соли магния не только значительно лучше усваиваются организмом, но и реже дают побочные эффекты. В настоящее время продолжают применять препараты магния на основе многочисленных органических солей: оротат магния, аспарагинат, магния лактат, цитрат и др. Терапия препаратами магния эффективнее, если вводить их одновременно с т. н. магний-протекторами – соединениями, усиливающими абсорбцию магния и его транспорт в клетку. К магний-протекторам относятся оротовая кислота, витамины В6, D, В1, А, С и Е, рибоксин, карнитин, таурин и препараты кальция, т. к. все эти вещества повышают содержание магния в клетке.
При судорогах, обусловленных гипокальциемией, гипомагниемией, алкалозом, требуется внутривенное введение кальция и/или магния с последующей терапией пациентов этими препаратами [9]. У пациентов с эпилепсией комплексную терапию дополняют препаратами магния [10].
Препараты оротовой кислоты применяются при нарушениях белкового обмена (постинфарктный период, голодание, заболевания печени, спортивная медицина и т. д.). Оротовая кислота является производным пиримидинового основания урацила, участвует в биосинтезе пиримидиновых нуклеотидов, уридинмонофосфата (УМФ) и цитидинмонофосфата. Повышение концентрации оротата в результате приема солей оротовой кислоты значительно увеличивает концентрацию УМФ, уридиндифосфата и уридинтрифосфата [11].
Механизм действия оротовой кислоты (оротата) – увеличение синтеза УМФ и других уридинфосфатов. Уридинфосфаты – сигнальные молекулы, взаимодействующие с пуринергическими рецепторами, способствующие расслаблению гладкомышечной и поперечнополосатой мускулатуры. Оротовая кислота, как и тиамин, а также пиридоксин, способствует перемещению магния в клетку. Поэтому сочетание магния с оротовой кислотой усиливает эффект устранения судорог.
Рассматривая вопрос о лечении магнийдефицитных судорог, следует обратить внимание на препарат Магнерот (Woerwag Pharma GmbH & Co., Германия), основанный на оротате магния (C10H6MgN4O8∙2H2O, молекулярный вес – 370,52 г/моль). В 1 таблетке препарата содержится 500 мг оротата магния (т. е. 32,8 мг элементного магния). Оротат магния малорастворим в воде, не связывает соляную кислоту желудочного сока, не оказывает послабляющего действия в отличие от некоторых других солей магния [5].
Соли оротовой кислоты используются в качестве переносчика минералов, потому что оротовая кислота повышает клеточную биодоступность катионов, являясь своеобразным транспортером иона магния в клетку. Таким образом, обеспечивая высокую биодоступность магния, Магнерот обладает рядом дополнительных синергидных свойств, связанных с биологической ролью аниона оротовой кислоты. Этот препарат магния обладает анаболическими, гепатопротекторными, урикозурическими свойствами и может применяться длительными курсами.
У пациентов после операций на сердце восстановительный период реже осложняется перебоями в сердце и аритмией, протекает более благоприятно на фоне метаболической терапии, в т. ч. и оротатом магния [12]. Оротат магния может использоваться как средство вспомогательной терапии пациентов с серьезной сердечной недостаточностью, тахиаритмией и экстрасистолией [13]. К примеру, при столбнячных судорогах сульфат магния считается неэффективным [14].
Оротовый магний положительно влияет на энергетический метаболизм, структуру мышечной и соединительной тканей, сосудистый тонус, способствуя уменьшению содержания катехоламинов в плазме крови, существенно снижает гиперреактивность мышечной клетки, что обеспечивает ее противосудорожное действие. Совместное применение магния и оротата потенцирует их эффект при магнийдефицитных судорогах, возникающих от разных причин и имеющих разные механизмы развития.



