Введение
Некоторые фармакологические препараты (антибиотики, диуретики, сердечные гликозиды, противоопухолевые препараты, иммунодепрессанты [1]) нарушают почечный гомеостаз магния – Mg [2]. Бóльшая часть Mg (более 65%) фильтруется в почках и реабсорбируется в петле Генле, особенно в толстой восходящей ветви. Поэтому применение данных препаратов увеличивает выведение Mg с мочой, что приводит к формированию ятрогенного дефицита Mg в организме.
Наиболее часто гипомагнезиемия наблюдается при приеме диуретиков, особенно петлевых [3]. Однако выраженная гипомагниемия часто наблюдается не только среди пациентов, принимающих «петлевые» диуретики и осмотические вещества. Не менее ожидаемыми побочными эффектами при антибиотикотерапии являются дисбактериоз и аллергические реакции. Гипомагнезиемия и другие проявления недостаточности Mg, к сожалению, редко учитываются как серьезный побочный эффект, ассоциированный с применением антибиотиков [4].
Например, терапия амфотерицином (противогрибковый полиеновый макроциклический антибиотик) связана с повышенной экскрецией Mg с мочой вследствие нарушения канальцевой реабсорбции Mg. Применение амфотерицина пациентами с системными грибковыми инфекциями (n=10, 30–68 лет) приводит к формированию гипомагнезиемии уже на второй неделе терапии даже при сравнительно небольших курсовых дозах амфотерицина (≈210 мг). Прекращение терапии амфотерицином останавливало прогрессирование гипомагнезиемии [5].
В настоящей статье представлены результаты систематического анализа фармакологических взаимодействий Mg и антибиотиков. Последовательно рассматриваются воздействие ионов Mg на эффективность антибиотиков, самостоятельные антибактериальные эффекты Mg; разобраны антибиотики, вызывающие выраженные потери Mg (аминогликозиды, макролиды, полиеновые макроциклы, фторхинолоны).

Воздействие ионов Mg на эффективность антибиотиков
Комплексообразование Mg с антибиотиками снижает их антибактериальные свойства. Например, ЯМР (ядерный магнитный резонанс)-спектроскопия позволила локализовать Mg-связывающие сайты фторхинолонов как находящиеся между кетоновой и карбоксильной группами. Сродство Mg к молекуле фторхинолона коррелировало с ее антимикробными свойствами по отношению к кишечной палочке и золотистому стафилококку [6].
Показано влияние ионов Mg и кальция (Са) на восприимчивость Pseudomonas к антибиотикам. В частности, ионы Mg увеличивают минимальные ингибирующие концентрации (МИК) тетрациклина, гентамицина, полимиксина и карбенициллина для 13 видов Pseudomonas [7]. Сочетание Са и Mg привело к увеличению МИК гентамицина.
В клиническом исследовании показано, что антацид, содержащий гидроксиды Mg и алюминия, существенно влияет на всасывание и элиминацию пефлоксацина у здоровых добровольцев (n=10). В рандомизированном перекрестном исследовании каждый участник получал 400 мг пефлоксацина per os с добавлением или без добавления антацида. Совместное применение данного антибиотика с антацидом вызывало снижение уровней пефлоксацина в плазме и моче. Площадь под кривой концентрация–время значительно снизилась (р<0,001), что указывает на нарушенное всасывание пефлоксацина из желудочно-кишечного тракта. Относительная биологическая доступность пефлоксацина при комбинации с антацидом составила 44% от биодоступности без антацидов. T1/2 было значительно короче после совместного приема пефлоксацина с антацидом. Таким образом, чтобы обеспечить достаточную терапевтическую эффективность хинолонов, их следует принимать по крайней мере за 2 часа до приема Mg-содержащих антацидов (гидроксиды Mg и алюминия) [8]. Все эти результаты указывают на необходимость раздельного приема препаратов Mg и антибиотиков.

Антибактериальные эффекты Mg
Как и цинк, Mg является природным иммуномодулятором. Уровни Mg воздействуют на врожденный и приобретенный иммунные ответы через регуляцию процессов воспаления, апоптоза, изменение числа и функций популяций иммунных клеток [9]. Дефицит Mg приводит к дозозависимому увеличению секреции арахидоновой кислоты, активации фосфолипазы А2, циклоксигеназы, что сопровождается увеличением синтеза провоспалительного 6-кето-простагландина F1a [10], повышением уровня провоспалительного интерлейкина-1a [11]. Проведенные крупные эпидемиологические исследования, суммарно включившие 10 тыс. пациентов, убедительно показали, что низкое потребление Mg способствует повышению синтеза провоспалительного С-реактивного белка [12].
Помимо иммуномодуляции и регулировки процессов воспаления ионы Mg характеризуются самостоятельной антибактериальной активностью и разрушают мембранные оболочки золотистого стафилококка (рис. 1). При этом ионы Mg не оказывают антибактериального воздействия на кишечную и сенную палочки [13].
Антибктериальные свойства имплантов на основе высокоочищенного Mg (99,9%) хорошо известны в ортопедии. Например, антибактериальные свойства Mg были показаны в модели имплантат-ассоциированного метициллинрезистентного штамма Staphylococcus aureus (который относится к т.н. внутрибольничным инфекциям) [14]. Антибактериальная эффективность металлических дисков из Mg и титана (контроль) анализировалась после культивирования S. aureus в течение 6, 12 и 24 часов. Через 24 часа на поверхности Mg-дисков отмечены самые низкие уровни колонизации стафилококков, что достоверно указывает на более высокую бактерицидную активность по сравнению с титаном (р=0,01; рис. 2).
Антибиотики, вызывающие потери Mg
Антибиотики могут проявлять нефро-, ото-, гепато-, нейро- и кардиотоксичные свойства. Во многом эти побочные эффекты обусловлены именно потерями пациентом Mg. Гипомагниемия может развиваться даже при однократном введении антибиотиков, особенно внутривенно. Например, гипомагниемия и нефротоксичность развиваются при применении амфотерицина, противогрибкового антибиотика [15]. Фторхинолоны, вызывая глубокий магниевый дефицит, существенно повышают риск развития тяжелой формы желудочковой тахиаритмии – аритмии «пируэт» (torsades de pointes) [16]. Макролиды (в частности, эритромицин) усугубляют гипокалиемию, гипомагниемию, брадикардию и вызывают удлинение интервала QT на электрокардиограмме [17]. В эксперименте пенициллин вызывал эпилептогенную активность спинного мозга, которая компенсировалась введением ионов Mg [18].
Из побочных эффектов антибиотикотерапии, специфически ассоциированных именно с потерями Mg, следует выделить синдром удлиненного QT, который существенно повышает риск желудочковой тахикардии, фибрилляции желудочков и как следствие – тромоэмболии. Удлинение QT стимулируется не только антидепрессантами (особенно трициклическими), нейролептиками (галоперидол и фенотиазины) и антиаритмиками классов IA и III, но и антибиотиками групп макролидов и фторхинолонов [19].
Ятрогенная гипомагниемия по большей части происходит вследствие потери Mg с мочой за счет усиления почечного клиренса Mg. Поэтому применение любых Mg-выводящих лекарств, в т.ч. антибиотиков, в идеале требует регулярной проверки концентраций Mg в плазме крови и в эритроцитах [20]. Практически при применении любых Mg-выводящих препаратов следует использовать препараты Mg на основе органических солей. Это позволит избежать развития истощения магниевого депо организма, следовательно, повысить безопасность антибиотикотерапии. К антибиотикам, вызывающим наиболее сильные потери Mg, относятся аминогликозиды и фторхинолоны.

Гентамицин и другие аминогликозиды
Наиболее тяжелые побочные эффекты применения аминогликозидов 1-го и 2-го поколений, нейро-, ото- и нефротоксичность непосредственно ассоциированы с гипомагнезиемией. Гипомагнезиемия является частым осложнением терапии аминогликозидами: повсеместно используемые терапевтические дозы аминогликозидов вызывают гипомагниемию более чем у 30% пациентов. Пациенты, не получающие дотаций Mg на фоне применения аминогликозидов, характеризуются высоким риском гипомагниеземии [21].
В эксперименте эффекты разных аминогликозидов (гентамицин, неомицин и тобрамицин) на экскрецию Са и Mg с мочой были сопоставимыми. В то же время нефротоксичное действие было наибольшим у неомицина и наименьшим у тобрамицина [22]. Терапия гентамицином ассоциирована с симптомами дефицита Mg, гипомагниемией, гипокальциемией и гипокалиемией. Установлена достоверная корреляция между более высокой суммарной курсовой дозой гентамицина и более низкой концентрацией Mg в сыворотке крови (р<0,05). Более высокая курсовая доза гентамицина также соответствовала и повышенной экскреции Mg с мочой (r=0,89, р<0,01) [23].
Нефротоксичность гентамицина значительно усиливалась на фоне экспериментальной Mg-дефицитной диеты; у животных с дефицитом Mg отмечены морфологические повреждения ткани почек, высокая смертность [24]. И наоборот, достаточная обеспеченность Mg в диете оказывает защитное действие на развитие острой почечной недостаточности после внутримышечного введения гентамицина (20 мг/кг). Гистологические исследования показали, что наименее тяжелая патология ткани почек была очевидной у крыс, получавших диету с нормальным и высоким содержанием Mg [25].
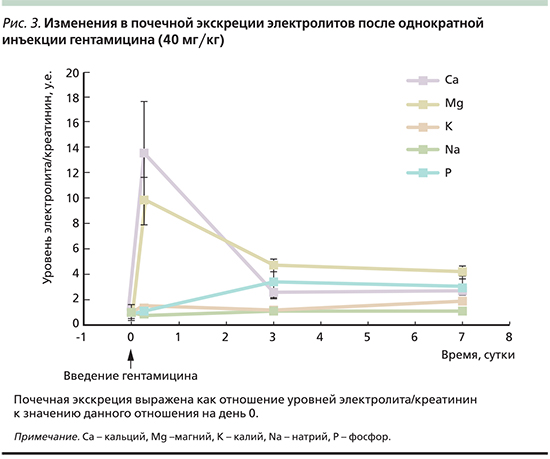
Гипомагнезиемия, ассоциированная с гентамицином, включает развитие гиперальдостеронизма и тубулярной токсичности, что делает необходимым постоянный контроль концентраций Mg, Са и калия в сыворотке крови [26]. Гентамицин стимулирует экскрецию Са и Mg с мочой достаточно быстро (часы). Например, в эксперименте гентамицин (40 мг/кг) вводился в течение 7 суток. В течение 6 часов после введения гентамицин стимулировал значительную гиперкальциурию (14-кратное увеличение по сравнению с контролем) и гипермагнезурию (10-кратное увеличение, рис. 3). Даже однократное введение гентамицина (в дозе 40 мг/кг) индуцировало значительную магнезурию [27].
Клиническая практика многократно подтвердила то, что аминогликозиды отрицательно влияют на почечный гомеостаз Mg. Например, в исследовании пациентов с кистозным фиброзом (n=24, возраст – 9–19 лет) участники были госпитализированы из-за обострения бронхита и пневмонии, вызванных синегнойной палочкой. Пациенты получали аминогликозид амикацин и цефалоспорин цефтазидим в течение 14 суток. Не было отмечено достоверных изменений уровней креатинина, мочевины, натрия, калия и Са в плазме крови. Однако данная комбинированная антибиотикотерапия значительно снизила концентрацию Mg в плазме крови: от 0,77 (95% доверительный интервал [ДИ] – 0,74–0,81) до 0,73 ммоль/л (95% ДИ – 0,71–0,75). Параллельно отмечено увеличение фракционного клиренса Mg с мочой: от 0,057 (95% ДИ – 0,049–0,072) до 0,072 (95% ДИ – 0,063–0,111) и общей экскреции Mg с мочой: от 31 (95% ДИ – 26–38) до 39 мкмоль/л (95% ДИ – 31–49). Таким образом, терапия аминогликозидами стимулирует развитие гипомагниемии даже в отсутствие значительного возрастания уровней креатинина или мочевины, т.е. без выраженных нарушений функции почек [28].

Гентамицин в стандартных клинических дозировках стимулирует немедленное выведение Са и Mg с мочой уже в течение первых 2–3 часов после введения. Перед началом исследования здоровые добровольцы получали диету с содержанием 400 мг/сут Са и 2300 мг/сут натрия в течение 1 недели. Затем гентамицин в дозе 5 мг/кг вводился внутривенно в течение 30 минут. Фракционная экскреция Са с мочой выросла от 1,8±0,5 до 6,8±1,4% (р<0,01), а фракционная экскреция Mg – от 3,4±0,8 до 11,8±6,4% (р=0,03). Гентамицин не вызывал изменений в почечной экскреции натрия, калия или фосфат-аниона [29] (рис. 4).
Фундаментальные исследования позволили установить молекулярные механизмы, связывающие прием аминогликозидов с потерями Mg. Резкое увеличение экскреции Ca2+ и Mg2+ сопровождалось достоверным повышением экспрессии генов, кодирующих белки транспорта Ca2+ и Mg2+ в дистальных извитых канальцах – TRPV5 (175±3%), TRPV6 (170±4%), TRPM6 (156±4%) и кальбиндин-D28k (174±3%; во всех случаях р<0,05 по сравнению с контролем). Повышение экспрессии этих генов наблюдалось в течение всех 7 дней внутривенного введения гентамицина [27]. Результаты иммунофлуоресцентного анализа подтвердили, что уровни соответствующих белков-транспортеров также были повышены на протяжении всего 7-дневного курса лечения гентамицином. Установлено достоверное повышение уровней кальбиндина-D28k (202±5% от контроля; p<0,05), TRPV5 (194±4% от контроля) и белка-транспортера Mg TRPM6 (178±4% от контроля; р<0,05; рис. 5).
Гипомагнезиемия представляет собой повсеместное осложнение лечения тяжелых ожогов. Это связано, в частности, с тем, что терапия аминогликозидами вызывает резкое увеличение почечной экскреции Mg, что и способствует формированию гипомагнезиемии. Низкие уровни Mg затрудняют заживление ран, а дотации Mg стимулируют процесс заживления ран и ожогов [30]. На фоне низкой обеспеченности Mg снижается синтез кол-лагена и других компонентов соединительной ткани [31].
Важно отметить, что восполнение уровней Mg способствует и сохране-нию уровней калия вследствие модулирования ионом Mg калиевых каналов [32]. Например, лечение ожогов аминогликозидом тобрамицином приводило к гипомагнезиемии и гипокалиемии, причем гипокалиемия не устранялась при использовании только препаратов калия. В то же время гипокалиемию удалось значительно скомпенсировать именно за счет компенсации гипомагнезиемии посредством использования препаратов Mg [33].

Фторхинолоны
Фторхинолоны (ципрофлоксацин, левофлоксацин, моксифлоксацин, гемифлоксацин и др.) очень широко используются для лечения различных видов бактериальных инфекций. Известно, что применение фторхинолонов стимулирует развитие судорог [34], удлинение QT, особенно у пациентов с гипомагниемией [35]. Одним из тяжелых последствий антибиотикотерапии фторхинолонами является разрушение структуры соединительной ткани. В частности, курсовая антибиотикотерапия с использованием хинолонов стимулирует развитие патологии ахилловых сухожилий (тендинит и даже разрывы), особенно у пациентов с низкой обеспеченностью Mg [35].
Фторхинолоны снижают биосинтез компонентов соединительной ткани. В эксперименте собаки получали ципрофлоксацин (30 или 200 мг/кг) или плацебо перорально в течение 5 дней. Иммуногистохимические анализы на коллаген I, эластин, фибронектин и интегрин показали значительное снижение этих белков, являющихся основными компонентами соединительной ткани. Например, содержание коллагена-I в сухожилиях в произвольных денситометрических единицах (д.е.) дозозависимо снижалось от 3190±217 (контроль) до 1890±468 д.е. (30 мг/кг ципрофлоксацина) и 1695±135 д.е. (200 мг/кг ципрофлоксацина). У собак с дефицитом Mg содержание коллагена-I составило всего 2053±491 д.е. [36].
Относительное содержание других белков в сухожилиях собак, получавших ципрофлоксацин (30 мг/кг), также снижалось: эластина на 73%, фибронектина на 88%, β1-интегрина на 96%. Известно, что Mg принимает активное участие в синтезе белков и гиалоуроновой основы соединительной ткани [31]. Поэтому приводимые выше данные подтверждают гипотезу, согласно которой токсическое воздействие фторхинолонов на соединительнотканные структуры могут в значительной мере быть обусловлены Mg-антагонистическим действием этих антибактериальных агентов [36].
В экспериментах на культуре хондроцитов удаление ионов Mg2+ из питательной среды и добавление антибиотиков фторхинолонового ряда резко снижают адгезию хондроцитов к коллагену II, нарушают образование актиновых волокон и уменьшают деление клеток. Эти изменения в структуре внеклеточного матрикса частично объясняют поражения, наблюдаемые в суставном хряще после введения фторхинолонов [37].
Деструктивные эффекты фторхинолонов и дефицита Mg на соединительную ткань особенно выражены, если экспериментальная терапия фторхинолоном (длительность курса – 28 дней) проводится у животных в раннем возрасте (5 недель после рождения). В конце эксперимента установлены тяжелая гипомагнезиемия (0,33±0,12 ммоль/л, контроль – 0,97±0,08 ммоль/л). Повреждения хряща (рубцы и эрозия суставной поверхности, кластеры хондроцитов в пределах бесклеточных областей хрящевого матрикса и сохраняющиеся «расселины») были обнаружены в коленных суставах 70% взрослых крыс (в возрасте 9 месяцев) после терапии фторхинолонами в возрасте 5 недель [38].
Применение фторхинолонов на фоне дефицита Mg в эксперименте приводит к некрозу клеток развивающихся конечностей и к осаждению неструктурированных отложений в межклеточном пространстве. Спарфлоксацин, темафлоксацин, ципрофлоксацин в дозах 60 и 100 мг/л тормозили развитие конечностей, особенно в Mg-дефицитной среде (<10 мкмоль/л). Флероксацин, ломефлоксацин и офлоксацин несколько замедляли развитие конечностей. При этом величина негативного воздействия того или иного фторхинолонового препарата на формирование конечностей коррелировала с биохимически измеренным сродством этого препарата к иону Mg [39]. Иначе говоря, чем больше хелатация фторхинолоном Mg, тем больше выражены повреждения соединительной ткани.
В эксперименте даже однократного перорального введения офлоксацина (300 мг/кг, 600 или 1200 мг/кг) крысам в возрасте 5 недель было достаточно, чтобы вызвать грубые структурные дефекты хряща. Изменения, наблюдаемые на ультраструктурном уровне, указали на поразительное сходство деструктивных эффектов дефицита Mg с деструктивными эффектами однократного приема офлоксацина (рис. 6). Фторхинолоновая артропатия, вероятно, обусловлена формированием нерастворимых хелатов Mg и, таким образом, дефицитом Mg, функционально доступного для синтеза суставного хряща [40].
Электронно-микроскопическое исследование показало, что типичные ультраструктурные повреждения хряща при фторхинолоновой артропатии включали:
- пучкообразные агрегаты на поверхности и в цитоплазме хондроцитов;
- отделение клеточной мембраны от матрикса и некротизирующих хондроцитов;
- разрушение внеклеточного мат-рикса;
- набухание митохондрий.
Возникновение некроза в клетках среднего слоя хряща является одним из важных процессов, объясняющих наблюдаемые нарушения структуры матрикса. Некроз сопровождался отчетливым уплотнением клеток и последующей их фрагментацией. Эти результаты подтверждают то, что и применение фторхинолонов, и низкая обеспеченность организма Mg характеризуются весьма сходными патологическими изменениями ткани хряща (рис. 7) [40].
Дефицит Mg в хряще, возникающий при приеме фторхинолонов, ухудшает взаимодействие хондроцитов с внеклеточным матриксом, опосредованное, в частности, магний-зависимыми β1-интегринами. После однократного перорального приема офлоксацина экспрессия интегринов была достоверно снижена в непосредственной близости от мест поражений хряща. При Mg-дефицитной диете ультраструктурные повреждения (образование расщелин, нарушения структуры коллагеновых волокон, осаждение фибронектина в хрящевом матриксе, снижение содержания гликозаминогликанов и др.) были весьма похожими на негативное воздействие фторхинолона на структуру хряща [41].
Заключение
Терапия антибиотиками существенно влияет на электролитный баланс организма, в т.ч. на уровни Mg в крови и в других биосубстратах. Низкая обеспеченность Mg снижает антибактериальную активность тетрациклина, гентамицина, полимиксина и карбенициллина, провоцирует развитие тяжелых побочных эффектов противогрибковых антибиотиков, аминогликозидов, фторхинолонов, цефалоспоринов, макролидов. Гипомагнезиемия и гипермагнезурия развиваются в первые часы и дни после начала антибиотикотерапии. У пациентов развиваются нарушения сердечного ритма (в т.ч. удлинение интервала QT и желудочковые аритмии); нарушается синтез соединительной ткани, формируются деструктивные изменения сухожилий и хряща. Прием аминогликозидов на фоне дефицита Mg резко повышает присущую этой группе антибиотиков нефротоксичность, а прием фторхинолонов на фоне дефицита Mg повышает риск тендинита и разрыва сухожилий. Поэтому сопровождение антибиотикотерапии приемом препаратов органического Mg принципиально важно для повышения безопасности терапии антибиотиками.
Для сопровождения антибиотикотерапии перспективно использование оротата магния, обеспечивающего организм ионами Mg и оротат-анионом. Оротат-анион не только способствует эффективному транспорту иона Mg внутрь клеток, но и характеризуется рядом положительных фармакологических эффектов [42]. Оротовая кислота участвует в переработке глюкозы, поддержании резервов аденозинтрифосфата (АТФ), росте и развитии клеток и тканей, например мышечной и соединительной, и др. [43].
Важно отметить, что оротат-анион является нутриентом для поддержки микробиоты [44]. Например, геномы молочнокислых бактерий Lactobacillus содержат гены, кодирующие специальные белки для транспорта и биотрансформаций оротовой кислоты [45]. При проведении антибиотикотерапии сохранение и поддержка микробиоты являются важнейшей задачей.



