Лечение больных диссеминированным раком молочной железы (РМЖ) представляет одну из наиболее сложных проблем клинической онкологии. Это связано с биологической и кинетической неоднородностью заболевания, умеренной чувствительностью опухоли к химио- и гормонотерапии. Концепция неизлечимости диссеминированного РМЖ в настоящее время определяет выбор тактики лечения этого заболевания, основной целью которого является максимальное продление жизни больной и облегчение симптомов болезни [2, 3, 6, 7].
Лекарственное лечение диссеминированного РМЖ должно соответствовать ряду принципов, сформулированных при детальном рассмотрении лечения больных с этой патологией. Лечение диссеминированного РМЖ должно быть своевременным, рациональным, последовательным, адекватным, этапным, комплексным [1, 4, 5, 8]. В изученной нами литературе практически отсутствуют систематизированные сведения об эффективности химиотерапии у больных РМЖ с метастазами в легкие, выявленными до года с момента установления основного диагноза. Таким образом, целью исследования явилось изучение эффективности режимов химиотерапии у больных РМЖ с метастазами в легкие, выявленными до года с момента установления основного диагноза.
Материал и методы
Проведена сравнительная оценка эффективности схем химиотерапии у больных РМЖ с метастазами в легкие, находившихся на лечении в клинике факультетской хирургии и онкологии Саратовского ГМУ им. В.И. Разумовского, НУЗ “Дорожная клиническая больница на ст. Саратов II” ОАО РЖД, за период с 2004 по 2009 г.
В группы наблюдения были включены 160 больных РМЖ с метастазами в легкие, выявленными до года с момента установления основного диагноза. Все больные были распределены в три группы в зависимости от применяемых схем лечения. В каждой из групп исследования в основные подгруппы были включены пациентки, которые получали химиотерапию, включавшую доцетаксел в различных комбинациях. Подгруппы сравнения составили больные, получавшие химиотерапию с антрациклинами. В табл. 1 приведены данные о распределении пациенток в группы наблюдения в зависимости от применяемых схем химиотерапии.
Таблица 1. Характеристика групп пациенток в зависимости от применяемых схем химиотерапии.
Оценку терапевтического ответа всех поддающихся измерению и анализу опухолей в начале, середине, конце курса химиотерапии осуществлял независимый врач-рентгенолог. Ответ на лечение оценивали с помощью критериев оценки ответа на лечение солидных опухолей RECIST (Response Evaluation Criteria in Solid Tumors). Частичный объективный ответ определяли как снижение суммы наибольших диаметров всех маркерных очагов поражения на 30 %, подтвержденное через 21 день. Полный объективный ответ определяли как исчезновение всех маркерных очагов поражения. Оценку эффективности лечения в каждой группе проводили, анализируя одно- и трехгодичную выживаемость.
Результаты и обсуждение
Средний возраст больных I группы наблюдения составил 56 ± 2 года, большая часть (62–63 %) из них находились в пременопаузальном периоде. Примерно у 2/3 больных были опухоли с отрицательными рецепторами стероидных гормонов: у 66 % пациенток, получавших химиотерапию по схеме АС, и у 67 % больных, получавших химиотерапию по схеме АС + АD. Поражение легких в 54–56 % случаев было множественным, и включение в исследование преимущественно пациенток с множественным характером поражения легких было не случайным, т. к. именно распространенный характер диссеминации в легких является прямым показанием к применению химиотерапии как единственному варианту лечения [1, 8, 9]. Ограниченные поражения легких встречались в 44–46 % случаев, среди них солитарные метастазы в легких отмечены в 34–35 % наблюдений. В данной ситуации возможность применения схем АС и АС + АD рассматривали при клиническом эффекте оперативного лечения легочного метастаза (уменьшении образования на 25–50 %).
При сравнении двух схем лечения следует обращать внимание на число пораженных лимфоузлов, т. к. от этого зависит оценка риска смерти. Поражение 1–3 лимфоузлов отмечено в 48 % случаев у пациенток, получавших схему АС + АD, и в 49 % – у пациенток, получавших химиотерапию по схеме АС; поражение 4–9 лимфоузлов отмечено в 40 и 38 % случаев соответственно.
При проведении исследования выявлено, что комбинация АС + АD обладает преимуществами в достижении объективных ответов и времени до прогрессирования (p < 0,05). Данные представлены в табл. 2.

Комбинация доксорубицина с доцетакселом при проведении первой линии химиотерапии у больных РМЖ с метастазами в легкие позволила повысить эффективность лечения и увеличить продолжительность жизни на два месяца. Статистическая обработка результатов исследования показала, что объективный ответ при применении схемы АD после химиотерапии по схеме АС носил стойкий характер, после 3 лет наблюдений вероятность влияния доцетаксела на выживаемость оставалась значительной (p < 0,05) и составила 76 %, тогда как при проведении химиотерапии по схеме АС – 52,3 %.
Все больные, получавшие системную химиотерапию, были оценены на предмет переносимости лечения. Данные по переносимости больными химиотерапии постоянно контролировались, при сравнении профилей безопасности были получены следующие данные. Гематологическая токсичность отмечена с одинаковой частотой и степенью тяжести в обеих подгруппах. Нейтропения III–IV степеней отмечена у 53 % больных, получавших химиотерапию по схеме АС, и в 52 % – у больных, получавших химиотерапию по схеме АС + АD. Лихорадка, не связанная с инфекцией, отмечена в 1 % наблюдений в обеих исследуемых подгруппах.
Проведение трех курсов химиотерапии по схеме АD после химиотерапии по схеме АС не вызывало дополнительной выраженной негематологической токсичности. Реакция гиперчувствительности (в основном III степени) наблюдалась в 2 % наблюдений у больных, получавших химиотерапию по схеме АС + АD, тогда как у больных, получавших химиотерапию по схеме АС, данная реакция отмечена в 1 % случаев. Кроме того, у больных, получавших химиотерапию по схеме АС + АD, чаще возникали миалгия/ артралгия, нейросенсорная токсичность, невралгия, гриппоподобные симптомы и гипергликемия (p < 0,05). Другие проявления негематологической токсичности возникали со схожей частотой в обеих подгруппах.
При анализе выживаемости в I группе больных были выделены прогностические критерии заболевания. Они включали число пораженных лимфатических узлов, состояние рецепторов эстрогена и прогестерона в опухоли, а также менструальный статус пациенток. В группе больных с гормоноположительным статусом риск смерти снизился на 32 %, у больных с гормоноотрицательным статусом – на 38 % (p = 0,02 и 0,005 соответственно). Положительное влияние на выживаемость при применении схемы АС + АD наблюдалось у больных в пре- и постменопаузе. Частота гематологической и негематологической токсичности у больных до 65 лет и старше в обеих подгруппах отмечена с равной интенсивностью и была более выраженной. У пациенток с поражением от 1 до 3 лимфатических узлов в АС + АD отмечено снижение риска смерти на 24 %; у больных с поражением от 4 до 9 лимфатических узлов – на 34 %.
Во II группе исследования средний возраст больных составил 52 ± 2 года, 58 % пациенток находились в пременопаузальном периоде. В 53 % случаев опухоли имели отрицательный рецепторный статус. Множественный характер поражения легких отмечен у 61–62 % больных, ограниченный характер поражения легких имел место в 38–39 % случаев. Больные в обеих подгруппах II группы были статистически достоверно сопоставимыми по основным параметрам (p < 0,05).
Клиническую эффективность двух сравниваемых схем лечения составляют полная (ПР) и частичная (ЧР) ремиссии. С учетом статистически недостоверной разницы в сравниваемых подгруппах между показателями ПР и ЧР (p < 0,05) показатель эффективности отражает объективный ответ (%), а также время до прогрессирования и продолжительности жизни (табл. 3).
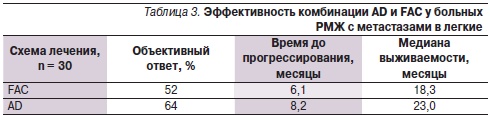
Таким образом, эффективность схемы АD на 12 % превышает таковую схемы FАС. Кроме того, разница времени до прогрессирования составила 2 месяца, продолжительность жизни у пациенток, получавших схему АD, была выше на 5 месяцев. Нейтропения III–IV степеней тяжести, артралгия/миалгия III–IV степеней и периферическая невропатия III–IV степеней значительно чаще наблюдались в группе, получавшей химиотерапию по схеме АD, в то время как тошнота и рвота III–IV степеней наиболее часто отмечались в группе FАС. Медиана фракции выброса левого желудочка менее 50 % наблюдалась у одной пациентки, получавшей химиотерапию по схеме FАС. Ни у одной из больных двух сравниваемых групп на фоне лечения не отмечено застойной сердечной недостаточности. Трехлетняя общая выживаемость (конечная точка исследования) в группе больных, получавших химиотерапию по схеме АD, составила 78 %, тогда как в группе больных, получавших химиотерапию по схеме FАС, – 64 %.
В III группе исследования средний показатель возраста составил 53 ± 2 года, в пременопаузальном периоде находились 58 % пациенток. Распределение по характеру поражения легких были следующими: множественный характер поражения отмечен у 62–63 % больных, ограниченный характер поражения – у 37–38 %. Подгруппу больных, получавших доцетаксел в монорежиме, составили пациентки, резистентные к антрациклинам, у которых включение в комбинацию доксорубицина в первой линии химиотерапии метастатического РМЖ привело к прогрессированию заболевания (увеличению образований в легких в размерах). Эффективность лечения в двух сравниваемых подгруппах была оценена по объективному ответу; данные представлены в табл. 4.
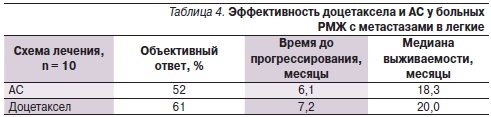
Таким образом, увеличение объективного ответа и продолжительности жизни в подгруппе пациенток, получавших доцетаксел в монорежиме, характеризует большую эффективность проводимого лечения (p < 0,05).
Выводы
На основании проведенных исследований можно сделать следующие выводы:
- Химиотерапевтический режим АС + АD обладает высокой эффективностью у больных РМЖ с метастазами в легкие, что проявляется в увеличении среднего времени до прогрессирования заболевания (АС + АD – 7,7; АС – 5,9 месяца, p < 0,05) и общей выживаемости больных (АС + АD – 22,2; АС – 18,1 месяца, p < 0,05). Применение режима химиотерапии АС + АD было связано с более высокой частотой развития нейтропении IV степени, что, однако, не приводило к повышению частоты случаев тяжелых инфекций или фебрильной нейтропении. Комбинация с доцетакселом не приводит к увеличению кардиотоксичности.
- Схема АD обладает преимуществами в лечении больных РМЖ с метастазами в легкие по сравнению со схемой FАС, что подтверждается показателями объективного ответа, временем до прогрессирования и выживаемостью больных. Ограничением к использованию схемы AD может служить частое развитие гематологической токсичности, однако использование комплекса сильных ферментов в составе поддерживающей терапии устраняет эти побочные эффекты доцетаксела.
- Высокая эффективность доцетаксела в монорежиме у больных, резистентных к антрациклинам, позволяет использовать данный режим во второй линии химиотерапии у больных РМЖ с метастазами в легкие.
Информация об авторах:
Андреяшкина Ирина Ивановна – кандидат медицинских наук, врач-радиолог
НУЗ “Дорожная клиническая больница” ОАО РЖД.
Тел. 8 (8452) 78-45-86, e-mail: andreyashkina79@mail.ru;
Плохов Владимир Николаевич – доктор медицинских наук, профессор кафедры онкологии
с курсом онкологии Волгоградского государственного медицинского университа,
директор НУЗ “Отделенческая клиническая больница на станции Волгоград-1” ОАО РЖД.
E-mail: plohov64@mail.ru