Введение
Несмотря на то, что в последние десятилетия достигнут значительный прогресс в химиотерапии (ХТ) и хирургическом лечении метастатического колоректального рака (мКРР), и алгоритмы лечения больных изменились, в т.ч. благодаря использованию мультидисциплинарного подхода, достижения I линии противоопухолевой терапии остаются неудовлетворительными, а отдаленные результаты – недостаточными. Пятилетняя общая выживаемость (ОВ) пациентов с мКРР находится на прежнем уровне (0–10%). Среди причин недостаточной эффективности лекарственного лечения мКРР можно предположить особенности кинетики опухолевого роста; врожденную и приобретенную лекарственную резистентность клеток; свойства физиологического микроокружения опухолевых клеток; репопуляцию новообразования; стволовые опухолевые клетки. Однако данные факторы не всегда учитываются при проведении лекарственного лечения. Очевидно, что для увеличения показателей выживаемости больных необходим пересмотр общепринятой стратегии лечения мКРР.
В настоящее время не вызывает сомнения тот факт, что использование клинико-морфологических характеристик (гистологическое строение опухоли, степень ее дифференцировки [G], глубина инвазии опухоли в кишечную стенку, инвазия лимфатических и кровеносных сосудов, статус лимфатических узлов, лимфоидная инфильтрация в опухоли, уровень опухоль-ассоциированных антигенов и др.) недостаточно для предсказания прогноза заболевания и эффекта проводимой терапии у больных мКРР [1–6]. Агрессивность опухолевого процесса не всегда определяется этими критериями и может значительно различаться у пациентов со сходными клиническими и морфологическими признаками заболевания. Предполагается, что эти различия обусловлены молекулярно-биологическими особенностями опухоли и служат дополнительными факторами, прогнозирующими выживаемость больных колоректальным раком [7–14].
Цель исследования: оценить прогностическое значение уровня экспрессии е-кадхерина в ткани первичной опухоли толстой кишки у больных мКРР, получивших в I линии лекарственного лечения новый режим ХТ на основе тройной комбинации: иринотекан (Iri)+оксалиплатин (Oxa)+длительная инфузия 5-фторурацила (5-FU).
Методы
В исследование включали пациентов с мКРР, получивших в I линии лекарственного лечения в отделении химиотерапии и комбинированного лечения злокачественных опухолей НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России новый разработанный нами режим ХТ на основе тройной комбинации: Iri+Oxa+длительная инфузия 5-FU [15–19]. Проведена оценка непосредственных и отдаленных результатов лечения.
До начала лечения всем больным проводилась морфологическая (гистологическая) верификация диагноза аденокарциномы толстой кишки.
С целью получения материала для гистологического и последующего иммуногистохимического (ИГХ) исследований выполнялась биопсия опухоли толстой кишки. Опухолевый материал подвергался рутинной гистологической обработке: фиксировался в 10%-ном растворе формалина, после промывки в воде и обезвоживания заливался в парафин.
В случае выполнения данной процедуры в другом лечебном учреждении обязательным было предоставление в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» зафиксированных в формалине и залитых парафином (по общепринятой методике) образцов опухолевой ткани из первичной опухоли (биопсийный и/или операционный материал [радикальные или паллиативные операции]). Все предоставленные готовые гистологические препараты пересмотрены в отделе патологической анатомии опухолей человека ФГБУ «НМИЦ онкологии им. Н.Н. Блохина».
ИГХ-методом в ткани первичной опухоли толстой кишки (биопсийный или операционный материал), полученной до начала I линии лекарственной терапии, проводили оценку уровня экспрессии молекулярно-биологического маркера (МБМ) е-кадхерина – трансмембранного белка из семейства молекул межклеточной адгезии.
Для ИГХ-исследования использованы зафиксированные в формалине и залитые парафином образцы опухолевой ткани, предназначенные для стандартного морфологического исследования. ИГХ-анализ проведен на серийных срезах с парафиновых блоков, содержащих ткань первичной опухоли толстой кишки, полученной до начала I линии лекарственной терапии, в лаборатории биомаркеров и механизмов опухолевого ангиогенеза НИИ экспериментальной диагностики и терапии опухолей ФГБУ «НМИЦ онкологии им. Н.Н.Блохина» (д.м.н. Степанова Е.В., к.б.н. Хоченков Д.А.). Данные об образцах опухолевой ткани, поступивших в лабораторию, заносили в отчетный журнал.
В работе использованы первичные антитела фирмы «Dako», разведение – 1:100, буфер для «демаскировки» антигенов – 10 мМ цитратный буфер (рН 6,0), клон – NCH38.
Парафиновые срезы депарафинировали и регидратировали по стандартной методике. Для «демаскировки» антигенов проводили прогревание срезов на водяной бане в предварительно нагретом до 95–99°С цитратном буфере в течение 30 минут. Затем стекла охлаждали при комнатной температуре в течение 15–20 минут и переносили в фосфатный буфер на 5 минут. Для блокирования эндогенной пероксидазы срезы инкубировали 20 минут в темноте с 3%-ной перекисью водорода, приготовленной на дистиллированной воде, а затем промывали 5 минут в фосфатном буфере. Для блокирования неспецифического связывания антител срезы инкубировали 15 минут с 1%-ным раствором бычьего сывороточного альбумина. Инкубацию с первичными антителами проводили при +4°С в течение 16 часов. После первичных антител стекла промывали 2 раза по 5 минут в фосфатном буфере. Инкубацию со вторыми антителами, меченными пероксидазой и стрептавидином с использованием LSAB-набора (Dako), проводили при комнатной температуре в течение 20 минут и затем срезы промывали 2 раза по 5 минут.
Для визуализации ИГХ-реакции использовали DAB-набор (Dako). Реакцию проводили в темноте в течение 5–10 минут. Срезы докрашивали гематоксилином Майера и заключали в синтетическую основу. Оценку результатов окрашивания проводили с применением светового микроскопа «Nikon» (Германия) под увеличением ×10, ×20, ×40. Определяли тип специфического окрашивания, который зависел от локализации продукта реакции в клетке (цитоплазматический, мембранный, ядерный, смешанный). Количество положительных клеток оценивали в зонах, содержащих их максимальное количество. В качестве отрицательного контроля использовали окрашивание срезов опухоли проявочными антителами без нанесения первичных антител.
 В качестве положительного контроля рассматривалось окрашивание образцов с известной экспрессией.
В качестве положительного контроля рассматривалось окрашивание образцов с известной экспрессией.
Результаты анализа экспрессии е-кадхерина оценивали как количественно, так и качественно. Качественная оценка основана на интенсивности окрашивания цитоплазмы: 0 – окрашивание отсутствует, 1 – слабое окрашивание, 2 – окрашивание средней интенсивности, 3 – сильное окрашивание. Количественно оценивали процент окрашенных клеток от 0 до 100. Экспрессию маркера оценивали как сумму баллов интенсивности окрашивания и баллов количества окрашенных клеток в каждом случае.
Для дальнейшего сравнительного ИГХ исследования выделяли 2 основных уровня иммунореактивности: низкий уровень или редуцированная экспрессия е-кадхерина в опухоли и высокий уровень или гиперэкспрессия е-кадхерина. Использованные в работе критерии оценки уровня экспрессии е-кадхерина и разделения опухолей на положительные и отрицательные по экспрессии данного маркера были взяты из литературных источников [20].
Полученные в нашем исследовании данные по экспрессии е-кадхерина были сопоставлены с непосредственными и отдаленными результатами лечения (частота объективного ответа [ЧОО], время до прогрессирования [ВДП], ОВ).
Критерием оценки отдаленных результатов лечения являлась ОВ, которая определялась временным интервалом от даты начала лекарственного лечения по поводу метастатической болезни до даты смерти (по любой причине) пациента или даты последнего контакта с ним (в случае выбывших из-под наблюдения пациентов) [21].
ВДП рассчитывалось от даты начала лекарственного лечения по поводу метастатической болезни до даты регистрации прогрессирования заболевания (ПЗ), смерти больного от любой причины или последней его явки.
ЧОО опухоли на лекарственное лечение определялась как процент больных, удовлетворяющих соответствующим критериям (полная регрессия [ПР]+частичная регрессия [ЧР]) ответа при солидных опухолях (RECIST, редакция 1.1; Response Evaluation Criteria In Solid Tumors) [22], от общего числа пациентов.
Длительность наблюдения за пациентами исчислялась от даты начала лекарственного лечения по поводу диссеминированной болезни до даты последней явки или смерти.
Сбор и первичная обработка материала осуществлялись с использованием базы данных Microsoft® Office Excel 2013. При составлении базы данных оценивались стандартные составляющие историй болезни, включавшие паспортную часть, данные анамнеза жизни и заболевания, результаты физикального осмотра и объективных лабораторных и инструментальных методов обследования. Для статистической обработки все данные о пациентах и результаты лечения перед внесением в базу были стандартизованы с помощью специально разработанного кодификатора. Рассчитывали среднее значение показателей, стандартную ошибку среднего, а также их медианы.
Статистический анализ и графическое оформление полученных результатов проводили на персональном компьютере с помощью известных статистических методов при использовании пакета статистических программ «SPSS» (v13.0. и v21.0. for Windows). Производился расчет медианы времени до соответствующего события с двусторонними 95% доверительными интервалами (95% ДИ). Сравнение больных, характеристик опухолей, распространенности заболевания и статистическая достоверность различий (p) значений признаков в группах оценивались с помощью теста «хи-квадрат» (χ2), для малых выборок рассчитывался непараметрический точный критерий Фишера. Различия между показателями считались статистически достоверными при р<0,05 (95% точности). Корреляционный анализ проведен с помощью коэффициента корреляции Пирсона и коэффициента ранговой корреляции Спирмена. Расчет выживаемости больных проводили методом Каплана–Мейера. Взаимосвязь экспрессии е-кадхерина с выживаемостью больных мКРР также оценивали методом Каплана–Мейера. Проведено построение кривых выживаемости по Каплану–Мейеру. Достоверность различий в выживаемости между группами оценивали с помощью Лог-ранк теста («Log-rank test»). Различия между группами считались достоверными при р<0,05. Для оценки независимости признаков и расчета сравнительного риска (HR) использовалась модель пропорционального регрессионного анализа Кокса (Proportional hazard [Cox] regression model).
Таким образом, для достижения поставленной цели исследование выполнялось на достаточном объеме материала, были использованы современные методические и методологические подходы, выбраны корректные методы статистического анализа результатов исследования.
Результаты
В настоящее проспективное исследование включено 20 больных мКРР, получивших в отделении химиотерапии и комбинированного лечения злокачественных опухолей НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н.Блохина» в качестве I линии лекарственного лечения новый разработанный нами высокоэффективный режим ХТ на основе тройной комбинации: Iri 100 мг/м2 поверхности тела, внутривенно капельно, 90-минутная инфузия, дни 1 и 15+Oxa 65 мг/м2 поверхности тела, внутривенно капельно, 2-часовая инфузия, дни 1 и 15 (после инфузии Iri)+5-FU 200 мг/м2/сут, длительная непрерывная 14-дневная внутривенная инфузия с использованием помпы (№ 2) со скоростью 2 мл/ч. Интервал – 2 недели. Начало очередного курса с 29-го дня.
У 18 из 20 включенных в исследование больных мКРР ИГХ-методом проведен анализ экспрессии е-кадхерина в ткани первичной опухоли толстой кишки, ассоциации данного маркера с прогнозом течения заболевания. Проведен анализ влияния экспрессии е-кадхерина в опухоли на ВДП и ОВ больных мКРР. Одна больная была исключена из ИГХ-исследования в связи с наличием в анамнезе неоадъювантной лучевой терапии на первичный очаг в плане комбинированного лечения опухоли толстой кишки, другая пациентка – из-за небольшого размера опухолевого образца (биопсийный материал; недостаточно материала для ИГХ-исследования). Детальная клинико-морфологическая характеристика включенных в исследование больных мКРР, в опухолевой ткани которых до начала I линии лекарственной терапии изучена экспрессия е-кадхерина, представлена в табл. 1.
Эффективность режима ХТ на основе тройной комбинации в I линии лекарственной терапии при метастазах КРР
Из 20 больных мКРР, получивших в I линии лекарственного лечения ХТ на основе тройной комбинации: Iri+Oxa+длительная инфузия 5FU, ПР зарегистрирована у 2 (10%) пациентов (живы >3 лет), а ЧР – у 15 (75%). Таким образом, ЧОО опухоли на лечение (ПР+ЧР) составила 85% (n=17). Длительная стабилизация болезни (СБ ≥6 месяцев) достигнута у 2 (10%) больных, причем у одного из этих пациентов отмечено уменьшение размеров контрольных очагов на 25,2% по RECIST-критериям. Контроль над болезнью (ПР+ЧР+СБ ≥6 месяцев) осуществлен в 95% случаев (n=19). Неэффективным лечение оказалось только у 1 больного (на фоне достигнутой стабилизации ПЗ произошло в течение 6 месяцев от начала лечения). При этом надо отметить, что при значительных размерах множественных метастазов в печени и легких ни у одного из 20 пациентов не было зарегистрировано рефрактерности к проводимой терапии (раннего ПЗ, зарегистрированного при первом контрольном обследовании в течение 2 месяцев от начала I линии лечения).

Разработанный новый режим I линии ХТ позволил достичь высоких показателей выживаемости. При медиане длительности наблюдения за 20 больными от начала I линии лекарственной терапии – 17,3±2,54 месяца (95% ДИ – 12,31–22,29) и среднем сроке наблюдения – 25,85±2,89 месяца (95% ДИ – 20,18–31,51; от 8 до 35,8 месяца) ПЗ после I линии лечения отмечено у 14 (70%) больных (на момент проведения статистического анализа). Медиана ВДП достигла 10,8±2,13 месяца (95% ДИ – 6,62–14,98; от 3 до 34,3 месяца). Медиана ОВ не достигнута, т.к. на момент проведения анализа 13 (65%) из 20 больных живы, 3 (23,1%) из которых не имеют признаков болезни. Умерли от ПЗ 7 (35%) больных.
Показатель 1-летней ОВ составил 88,9%. Однолетний срок был выбран, поскольку медиана длительности наблюдения от начала I линии лекарственной терапии составила 17,3±2,54 месяца (95% ДИ – 12,31–22,29), и использование бόльших значений было бы некорректно. Двое (10%) больных, наблюдавшихся <1 года (8–11,2 месяца) с момента начала I линии ХТ на основе тройной комбинации, были исключены из анализа данных 1-летней ОВ.
Взаимосвязь непосредственных и отдаленных результатов лекарственного лечения с экспрессией е-кадхерина в ткани первичной опухоли толстой кишки у больных мКРР
Исследование экспрессии е-кадхерина проведено ИГХ-методом в ткани первичной опухоли толстой кишки (биопсийный или операционный материал), полученной до начала I линии лекарственной терапии.
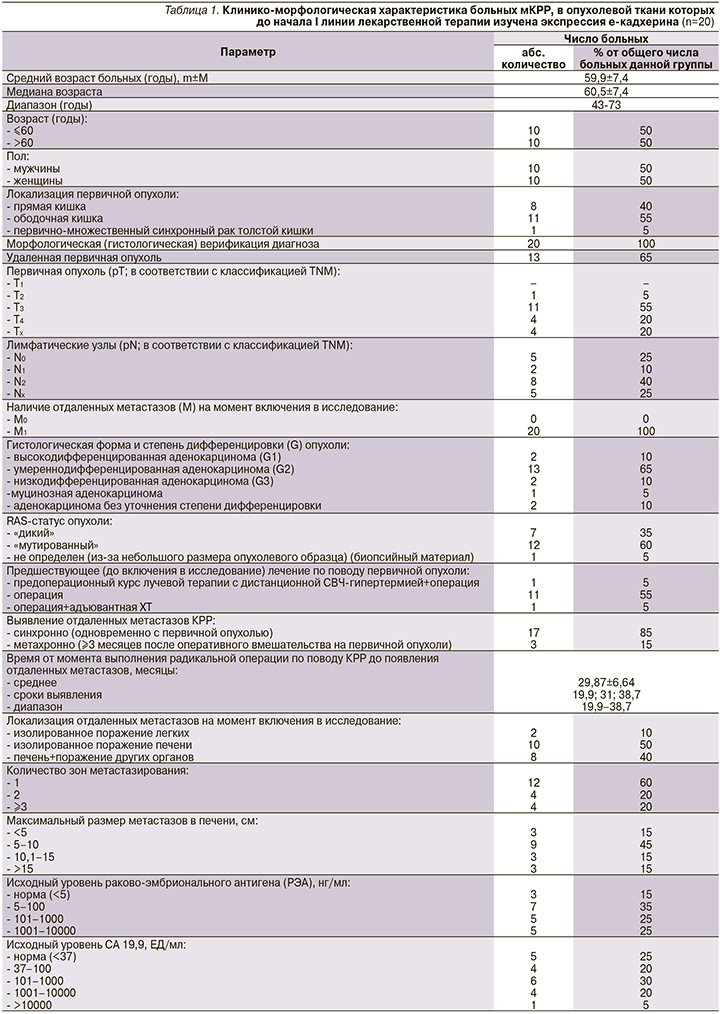
В первичной опухоли большинства (94,1%) больных мКРР, получивших в I линии лекарственного лечения режим ХТ на основе тройной комбинации, наблюдалась высокая экспрессия е-кадхерина (рис. 1).
Полученные в нашем исследовании данные по экспрессии е-кадхерина были сопоставлены с непосредственными и отдаленными результатами лечения (ЧОО, ВДП, ОВ).
Оценить влияние экспрессии маркера у 18 больных мКРР на непосредственную клиническую эффективность I линии ХТ на основе тройной комбинации не представлялось возможным, т.к. подгруппы оказались неравнозначны по числу пациентов (объективный эффект наблюдался у 15 пациентов, СБ – у 3).
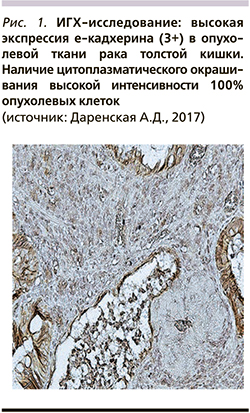
При анализе влияния экспрессии е-кадхерина в опухоли на ВДП у больных мКРР на фоне I линии ХТ с использованием тройной комбинации обнаружено, что высокая экспрессия маркера является благоприятным фактором, предсказывающим увеличение ВДП: медиана ВДП после I линии ХТ на основе тройной комбинации у больных с гиперэкспрессией е-кадхерина в опухоли была достоверно выше, чем у пациентов с низкой/отсутствием его экспрессии: 12,1±3,23 месяца (95% ДИ – 5,77–18,43; ПЗ – у 11 из 16 больных) против 7,8 месяца (р=0,009; рис. 2а).
Проведен анализ влияния экспрессии е-кадхерина в опухоли на ОВ больных мКРР на фоне I линии ХТ с использованием тройной комбинации. Отмечено статистически достоверное увеличение ОВ в группе пациентов с гиперэкспрессией е-кадхерина (при медиане наблюдения 17,3 месяца медиана ОВ не достигнута: 12 (75%) из 16 больных живы; среднее значение – 27,85±3,23 месяца [95% ДИ – 21,51–34,19]) по сравнению с группой больных с низкой/отсутствием экспрессии е-кадхерина в опухоли (медиана ОВ – 9,0 месяцев; p=0,000; рис. 2б).
Детально взаимосвязь экспрессии е-кадхерина в опухоли с ВДП и ОВ 18 больных мКРР, получивших в качестве I линии лекарственной терапии режим ХТ на основе тройной комбинации, представлена в табл. 2 и 3.
Обсуждение
В последнее время достигнут значительный прогресс в понимании молекулярных нарушений при злокачественных опухолях, но до сих пор наши знания не находят достаточного применения в клинической практике. Имеются многочисленные, часто противоречивые сообщения о прогностическом и предиктивном значении МБМ при различных злокачественных новообразованиях, в т.ч. при КРР. Несмотря на многообразие идентифицированных молекулярных нарушений в опухолевой ткани, ни одно из них в настоящее время не рассматривается в клинической практике в качестве надежного предиктора эффективности ХТ I линии у больных мКРР. Отсутствие четкой связи между результатами терапии и потенциальными МБМ может объясняться различными причинами. Одна из причин недостаточной прогностической значимости маркера может быть связана с особенностями биологии опухоли. Каждая опухоль индивидуальна по изменениям, происходящим во время трансформации. В клетках каждой опухоли могут обнаруживаться как благоприятные, так и неблагоприятные прогностические факторы, которые при взаимодействии определяют прогноз заболевания.
Более того, спектр молекулярных нарушений настолько широк, что может существенно варьировать даже в пределах одного и того же опухолевого образования, обусловливая внутриопухолевую гетерогенность (ВГ). Представляя собой результат клонального разнообразия в пределах одного новообразования, ВГ может проявляться в неоднородности генетического статуса, экспрессии белков, морфологии и других характеристик опухоли. ВГ также является одним из механизмов клональной эволюции и адаптации опухоли к меняющимся условиям микроокружения, поддерживающих ее злокачественный потенциал. Соотношение разных популяций опухолевых клеток в пределах одной опухоли и преобладание одного из клонов на определенном этапе опухолевого развития во многом обусловливают индивидуальное разнообразие опухолей, делая каждую из них уникальной с точки зрения ее биологического поведения, прогноза и чувствительности к терапии в пределах одной нозологической формы.
В проведенном нами исследовании подробно изучены и детально проанализированы особенности экспрессии е-кадхерина при мКРР. Изучение экспрессии данного маркера в ткани первичной опухоли толстой кишки позволило уточнить некоторые механизмы, обеспечивающие опухолевое прогрессирование, инвазию и метастазирование опухолевых клеток.
Изучено прогностическое значение экспрессии е-кадхерина в ткани первичной опухоли у больных мКРР: проанализировано ее влияние на ВДП и ОВ. Установлено, что у больных мКРР, получивших в I линии лекарственного лечения Iri+Oxa+длительную инфузию 5FU, высокая экспрессия маркера в ткани первичной опухоли статистически достоверно коррелировала с увеличением ВДП (p=0,009), а также являлась фактором благоприятного прогноза ОВ (p=0,000). Следует подчеркнуть, что впервые в мире получены сведения о корреляции экспрессии е-кадхерина в ткани первичной опухоли толстой кишки и эффективности режима I линии ХТ на основе тройной комбинации: Iri+Oxa+длительная инфузия 5-FU у больных мКРР и, как следствие, – продемонстрирована возможность использования данного МБМ для оценки течения опухолевого процесса и прогноза ВБП и ОВ данной группы больных.
На основании полученных в работе результатов сформированы группы благоприятного и неблагоприятного прогноза течения опухолевого процесса. Разделение пациентов с диссеминированным КРР по прогнозу заболевания позволяет выбирать оптимальную лечебную тактику. Принадлежность больного (по результатам оценки экспрессии е-кадхерина) к группе неблагоприятного прогноза диктует необходимость более тщательной программы диагностических мероприятий, проведения расширенного объема контрольных обследований, использования дополнительных методов лечения (т.е. применения мультидисциплинарного подхода) и, возможно, выбора более агрессивной тактики лечения.
Таким образом, в ходе нашего исследования подробно изучены молекулярнобиологические особенности первичной опухоли толстой кишки у больных мКРР, получивших в I линии лекарственного лечения режим ХТ на основе тройной комбинации. Полученная в ходе этого исследования молекулярнобиологическая характеристика злокачественных опухолей толстой кишки дополняет фундаментальные и клинические представления об этом заболевании. Новые характеристики, полученные при изучении е-кадхерина, имеют фундаментальное значение и определяют создание новых терапевтических подходов к лечению злокачественных опухолей на рациональной основе.
Заключение
Успешные клинические исследования МБМ для прогнозирования эффективности лечения позволяют надеяться на их скорое появление в рутинной клинической практике, что не только увеличит эффективность лечения и продолжительность жизни, но и улучшит качество жизни больных КРР.
Проведенное нами исследование позволило на основании полученных данных выделить маркер (е-кадхерин), который уже сегодня может быть использован в реальной клинической практике для индивидуального прогнозирования течения заболевания у больных мКРР. Для больных мКРР, получивших в I линии лекарственного лечения режим ХТ на основе тройной комбинации: Iri+Oxa+длительная инфузия 5-FU, высокая экспрессия е-кадхерина в ткани первичной опухоли является фактором благоприятного прогноза ВБП (p=0,009) и ОВ (p=0,000). Таким образом, нами был разработан подход для индивидуализации ХТ пациентов с диссеминированным КРР.
Дальнейшее изучение и подтверждение выявленных в нашем исследовании закономерностей будут полезны для прогнозирования и улучшения результатов лечения опухолей данной локализации. Взаимодействие различных маркеров и их суммарная значимость для прогноза течения заболевания остаются плохо исследованными. Нужны дополнительные комплексные исследования экспрессии МБМ для более точного определения их клинической значимости. Исследование комплекса маркеров поможет точнее определить метастатический потенциал опухоли и оценить ее агрессивность. Дальнейшие исследования в этой области помогут разрешить оставшиеся вопросы и оптимизировать лечебные подходы в отношении разных групп пациентов.


