Введение
Неалкогольная жировая болезнь печени (НАЖБ) представлена спектром заболеваний от простого стеатогепатоза, сопровождающегося инфильтрацией триацилглицеридами (ТАГ) более 5% гепатоцитов, до неалкогольного стеатогепатита (НАСГ) в отсутствие избыточного потребления алкоголя (<30 г/день для мужчин и <20 г/день – для женщин) [1]. Распространенность НАЖБ в общей популяции составляет 25,24%. НАЖБ в 51% случаев ассоциирована с ожирением, в 22,5% с сахарным диабетом 2 типа (СД2), в 69% с гиперлипидемией, в 39% с артериальной гипертензией и в 42,5% с метаболическим синдромом (MС) [2]. Некоторые авторы рассматривают НАЖБ как печеночную манифестацию МС [3]. Как указывалось выше, НАЖБ способна прогрессировать до НАСГ, сопровождающегося не только жировой инфильтрацией гепатоцитов, но и их баллонной дегенерацией, а также лобулярным и портальным воспалением. Последствиями НАСГ являются развитие фиброза, цирроза печени и гепатоцеллюлярной карциномы [1]. Было показано, что фиброз печени ассоциирован с увеличением всех случаев смертности и смертности, связанной с заболеваниями печени, а также с риском кардиоваскулярных заболеваний [4, 5]. Установить точную распространенность НАСГ в общей популяции затруднительно, т.к. для его диагностики требуется проведение инвазивной биопсии с гистологической верификацией, поэтому в литературе наиболее часто встречается термин «НАЖБ», так как установление НАЖБ не требует инвазивных вмешательств, в отличие от стеатогепатоза и НАСГ. Однако, по некоторым данным, НАСГ присутствует у 3–6% населения США [6]. Хорошо известно, что наличие некоторых заболеваний многократно увеличивает риск развития НАСГ и НАЖБ. Так, согласно мета-анализу, НАЖБ среди больных СД2 встречается в 55,5% случаев, НАСГ – в 37,3%. Распространенность прогрессивного фиброза среди пациентов с СД2 и НАЖБ составляет 17% [7]. Наличие СД2 и в меньшей степени ожирения, атерогенной дислипидемии и гипертензии независимо ассоциировано с циррозом, его осложнениями, прогрессивным фиброзом и НАСГ при НАЖБ [8]. Более того, исследованиями установлено, что НАЖБ и фиброз являются независимыми предикторами кардиоваскулярных заболеваний при СД2 [9, 10]. Некоторые авторы указывают на необходимость скрининга НАЖБ при СД2 [11]. Интересно заметить, что не только СД2 служит фактором риска развития НАЖБ, но и наличие НАЖБ способствует возникновению СД2. Так, согласно мета-анализу, НАЖБ увеличивает его риск в 2,2 раза [12].
Ожирение и НАЖБ
Важнейшая роль в развитии НАЖБ, как и СД2, принадлежит ожирению и избыточной массе тела. Так, согласно мета-анализу, среди больных НАЖБ лица с нормальным ИМТ, определенным как <23 кг/м2 для азиатской популяции и <25 кг/м2 для неазиатской, встречается в 16,7% [13]. Более того, больные НАЖБ с нормальным ИМТ имеют избыточную абдоминальную жировую ткань, а также более частые компоненты МС по сравнению с лицами, имеющими нормальный ИМТ без НАЖБ [14]. Многими исследованиями было установлено, что к предикторам развития НАЖБ относятся повышенный ИМТ, ТАГ сыворотки, различные индексы, указывающие на развитие жировой ткани [15, 16]. Причем среди индексов, указывающих на распределение жировой ткани, наилучшим предиктором оказался индекс жировой ткани туловища, демонстрирующий количество жировой ткани в области шеи, грудной клетки, брюшной полости и малого таза [16]. В лонгитудинальном исследовании A. Suzuki et al. было установлено, что набор веса и гипертриглицеридемия предшествуют развитию НАЖБ, тогда как гипертензия и нарушения метаболизма глюкозы возникают позже [17].
Инсулинорезистентность и НАЖБ
Ведущая роль в развитии НАЖБ принадлежит инсулинорезистентности (ИР). Как известно, общая ИР складывается из ИР мышечной, жировой тканей (периферическая ИР) и печени (центральная ИР). Данные с использованием эугликемического-гиперинсулинемического клэмпа показали более высокую ИР жировой и мышечной тканей, а также ИР печени у больных НАЖБ по сравнению с соответствующим по массе контролем [18–22]. В возникновении НАЖБ большую роль играет периферическая ИР. Так, высокая ИР ассоциирована с развитием НАЖБ после трансплантации печени [23]. Наибольший вклад в развитие НАЖБ принадлежит ИР жировой ткани как следствие ожирения. Результатом ИР этой ткани является подавление инсулином гормончувствительной липазы, что приводит к усилению липолиза и высвобождению свободных жирных кислот (СЖК) в кровоток [24]. Концентрация сывороточных СЖК позитивно коррелирует с маркерами воспаления и гепатоцеллюлярного повреждения, является предиктором запущенного фиброза печени [25]. При увеличении ИР жировой ткани у пациентов с НАЖБ происходит нарастание печеночной ИР и прогрессирование фиброза печени [26]. В исследовании Lomоnaco et al. у пациентов с СД2 отмечалось последовательное усиление ИР жировой ткани при переходе из группы без НАЖД в группу стеатогепатоза, а затем с НАСГ. Была обнаружена ассоциация между ИР жировой ткани и стеатозом, активностью стеатогепатита [27]. Поэтому неудивительно, почему степень ИР является предиктором гистологических изменений печени при НАЖБ [28].
Развитие ИР в печени при НАЖБ обусловлено накоплением липидов в гепатоцитах [29]. В процессе анализа состава ТАГ гепатоцитов при НАЖБ было установлено, что 59% жирных кислот образуются при липолизе жировой ткани, 26,1% в результате de novo липогенеза печени, а оставшиеся 14,9% поступают из пищевых источников [30]. По мере развития НАСГ вклад в прогрессирование печеночной ИР вносят провоспалительные цитокины, такие как TNF-α, IL-1ß, -6. Так, известно, что экспрессия провоспалительных цитокинов достоверно выше в гепатоцитах при НАСГ по сравнению с стеатогепатозом, что хорошо согласуется с высокими концентрациями данных цитокинов в сыворотке [31, 32]. Следствием ИР печени является активация глюконеогенеза и липогенеза de novo [29, 33]. В то время как основной причиной интенсификации глюконеогенеза при НАЖБ является не ИР печени, а избыточное количество субстрата для глюконеогенеза, представленного аминокислотами и СЖК, избыточно выделяющимися из-за ИР мышечной и жировой тканей, основным факторам усиленного липогенеза de novo служит именно печеночная ИР [34]. Было установлено, что скорость липогенеза de novo при НАЖБ увеличена в 3 раза по сравнению со здоровым контролем [35]. Сам процесс липогенеза de novo в гепатоцитах зависит от двух факторов транскрипции – sterol regulatory element-binding protein 1с (SREBP-1c) и carbohydrate-responsive element-binding protein (ChERBP), позитивно регулирующих липогенез. Активатором для SREBP-1c служит инсулин, а для ChERBP – непосредственно повышение глюкозы и фруктозы крови [36, 37]. При этом у больных НАЖБ отмечается повышение экспрессии SREBP-1c гепатоцитами [38]. В исследовании Smith et al. скорость липогенеза de novo прямо коррелировала с концентрациями инсулина и глюкозы за 24 часа и обратно с общей инсулиночувствительностью и инсулиночувствительностью печени [39]. У пациентов с НАЖБ было отмечено стимулирующее влияние инсулина на синтез ТАГ печенью, причем стимулирующее действие инсулина на липогенез усиливалось по мере развития цирроза [40]. В исследовании K.W. Ter Horst et al. была обнаружена увеличенная экспрессия ChERBP, поэтому авторы сделали вывод, согласно которому избыток субстрата для липогенеза также важен [41]. Таким образом, по-видимому, у больных НАЖБ наблюдается синхронная активация SREBP-1c и ChERBP.
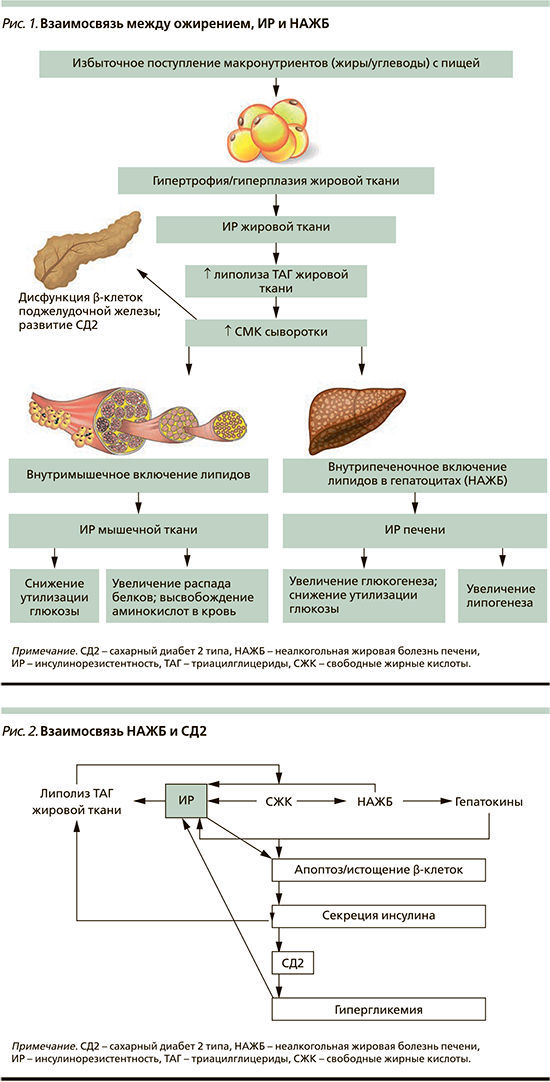
Возможная патогенетическая взаимосвязь между ожирением, ИР и НАЖБ представлена на рис.1.
НАЖБ и СД2
Данные с использованием эугликемического-гиперинсулинемического клэмпа показали, что общая ИР у больных НАЖБ сопоставима с таковой, наблюдаемой при СД2 [42]. Нарушение толерантности к глюкозе и манифестация СД2 при НАЖБ обусловлены снижением секреции инсулина [43]. При этом утрата функции β-клеток поджелудочной железы может быть обусловлена сывороточными СЖК. Известно, что СЖК способны вызывать апоптоз β-клеток вследствие их липотоксичности [44]. В исследовании Li et al. обнаружили дозозависимую ассоциацию между СЖК и развитием диабета при НАЖБ [45]. Другим возможным механизмом утраты функции β-клеток может быть их раннее истощение вследствие преодоления высокой ИР при НАЖБ [46]. Также утрата функций β-клеток с развитием СД2 способна осложнить течение НАЖБ. Например, снижение секреции инсулина способствует большему высвобождению СЖК [24]. Более того, глюкотоксичность, ассоциированная с гипергликемией, способна провоцировать ИР [47]. Так, в исследовании C. Ortiz-Lopez et al. у участников с НАЖБ происходило нарастание ИР жировой ткани перехода из группы с нормальной толерантностью к глюкозе в группу с СД2. ИР жировой ткани коррелировала со степенью стеатоза, а также с ИР мышечной ткани и печени [48]. По мере развития НАСГ возможно дальнейшее нарушение метаболизма глюкозы, что подтверждается исследованием K. Qufeshi et al., где ИР печени достоверно выше в группе НАСГ, по сравнению СГ и контролем [49]. Кроме этого нарастающий интерес вызывают гепатокины, синтезируемые печенью. Мета-анализом было выявлено, что уровни ферунина-А и -В повышены при НАЖБ, а сами по себе данные гепатокины способны вызывать ИР, что также может осложнить течение диабета [50, 51]. Следовательно, имеющиеся данные свидетельствуют о взаимосвязанном, взаимоосложняющем течении этих двух заболеваний.
Возможная взаимосвязь между НАЖБ и СД2 показана на рис. 2.
Заключение
Таким образом, проанализированная информация подчеркивает следующую последовательность развития процессов: ожирение–НАЖБ–СД2, где ведущим механизмом развития НАЖБ и СД2 являются ИР и повышенное высвобождение СЖК. Течение НАЖБ и СД2 носит взаимоотягчающий характер с формированием порочного круга, что, безусловно, негативно сказывается на эффективности терапии этих двух заболеваний. Однако проанализированная последовательность развития заболеваний не универсальна для каждого случая. Так, непонятно почему во многих ситуациях при НАЖБ не развивается СД2 и почему при СД2 не всегда наблюдается НАЖБ, более того, есть иные инсулинорезистентные состояния/заболевания, при которых не повышается вероятность развития НАЖБ, что лишний раз подчеркивает необходимость дальнейших более глубоких исследований патогенеза и причинно-следственной взаимосвязи между ИР, НАЖБ и СД2.
Вклад авторов. Волкова Н.И. – идея, проверка критически важного содержания, утверждение рукописи для публикации; Паненко С.О. – обзор, сбор и обработка материалов, написание текста, подготовка статьи к публикации; Голубева А.О. – написание текста, оформление рисунков, подготовка статьи к публикации.
Финансирование. Работа выполнена за счет личных средств авторского коллектива.



