Введение
Согласно классификации нарушений сна 3-го пересмотра (International Classification of Sleep Disorders-Third Edition, ICSD-3), ночные кошмары (НК) относят к группе парасомний, связанных с быстрым сном [1]. НК характеризуются наличием повторяющихся неприятных сновидений, которые представляют собой проявление интенсивной психической деятельности в фазу быстрого сна [2].
Критерии постановки диагноза НК [1, 2]:
А. Повторяющиеся эпизоды продолжительных, очень неприятных и хорошо запоминающихся сновидений, обычно связанных с угрозой жизни, здоровья или физической целостности человека.
В. При пробуждении из неприятного сновидения пациент быстро приходит в состояние нормального сна.
С. Содержание сновидений или расстройства сна, вызывающиеся пробуждением из такого сновидения, вызывают клинически значимое нарушение социальной, профессиональной или других важных областей жизни человека, что подтверждается наличием одного из следующих проявлений:
- Расстройство настроения (сохранение ночных впечатлений, тревога, дисфория).
- Боязнь спать (тревога при укладывании, боязнь сна или кошмаров).
- Нарушение когнитивных функций (повторяющиеся образы из сновидения, нарушения концентрации или памяти).
- Негативное воздействие на жизнь окружающих (ночное беспокойство).
- Проблемы поведения (сопротивление укладыванию, боязнь темноты).
- Дневная сонливость.
- Чувство усталости или нехватки энергии.
- Нарушение производственной или учебной деятельности.
- Нарушение межличностного/социального взаимодействия.
НК могут быть как идиопатическими, так и вызванными посттравматическим стрессовым расстройством (ПТСР), психическими заболеваниями, тревожными и депрессивными расстройствами, а также возникать на фоне приема или отмены ряда препаратов (лекарственно-индуцированные НК – ЛИНК) [3, 4].
Распространенность
НК чаще встречаются в детском возрасте (60–75% популяции) [2], однако их распространенность в общей популяции достигает 4% [1]. До 85% лиц с НК имеют один НК в течение года, 8–29% – ежемесячные, 2–6% – еженедельные НК [5]. В кросс-секционном популяционном исследовании FINRISK Study [6] (13 922 участника [6515 мужчин и 7407 женщин] в возрасте 25–74 лет) НК чаще встречались у женщин, чем у мужчин (4,8 и 2,9% соответственно; р<0,001), однако распространенность НК увеличивалась с возрастом у мужчин (р<0,001), но не у женщин. Распространенность ЛИНК неизвестна.
Факторы риска
К факторам риска развития НК во взрослом возрасте относятся женский пол, инсомния, тревожные расстройства и депрессия, частые головные боли, вечерний хронотип у женщин («совы»), сниженный ответ кортизола на пробуждение у женщин [6–8]. Также в небольшом исследовании [9] (15 пациентов с НК [13 женщин, 2 мужчин, средний возраст – 31,5±6,2 года] и 15 здоровых добровольцев [13 женщин, 2 мужчин, средний возраст – 29,6±3,5 лет]) у пациентов с НК были ниже уровни триглицеридов (122,8±71,7 и 162,4±8,8 мг/дл соответственно; р=0,007), общего холестерина (162,5±10,8 и 194,3±28,8 мг/дл соответственно; р=0,017) и липопротеинов низкой плотности (88,8±15,2 и 121,4±25,1 мг/дл соответственно, р=0,006). Специфические факторы риска развития лекарственно-индуцированных НК неизвестны.
Патогенез
Лекарственные средства (ЛС), влияющие на адренергическую, дофаминергическую и холинергическую передачи, имеют также важную роль в формировании НК, поскольку данные нейротрансмиттеры могут участвовать в модуляции фаз сна [10].
Ацетилхолин является нейромодулятором, влияющим на быстрый сон [11, 12]. Холинергические агонисты обладают способностью увеличивать продолжительность быстрого сна, тогда как антагонисты – ее уменьшать [13]. Достаточно большое количество ЛС обладает антихолинергической активностью, в т.ч. и ингибиторы ацетилхолинэстеразы, которые широко применяются в терапии болезни Альцгеймера [14, 15].
На фоне приема антигипертензивных препаратов, влияющих на рецепторы к норадреналину (β-адреноблокаторы и α1-адреноагонисты), НК встречались в 34% случаев [10]. Механизм возникновения НК при приеме β-адреноблокаторов (БАБ) не изучен. Считается, что липофильные БАБ (метопролол и пропранолол) могут проникать через гематоэнцефалический барьер и блокировать β2- и/или 5-гидрокситриптаминовые (5-НТ) рецепторы в ЦНС [16], однако гидрофильные БАБ (атенолол) также могут вызывать НК [16]. БАБ также обладают способностью снижать ночную секрецию мелатонина [17] и сокращать долю REM-сна [18].
Дофамин. Стимуляция дофаминовых рецепторов часто приводит к возникновению НК. Использование препаратов, применяемых в лечении болезни Паркинсона, может приводить к различным нарушениям сна, в т.ч. и к НК [10, 19].
Серотонин также вовлечен в цикл сон–бодрствование: его активность максимальна в период бодрствования и минимальна во время сна.
В частности, во время NREM-сна концентрация серотонина снижается и достигает своего минимума в период REM-сна [11]. Например, селективные ингибиторы обратного захвата серотонина (СИОЗС) могут вызывать НК [10], хотя некоторые из них (например, флувоксамин) используют для лечения НК [20].
Гамма-аминомасляная кислота (ГАМК). Помимо антидепрессантов ингибирующим влиянием на быстрый сон обладают следующие ЛС [10]: барбитураты, бензодиазепины, небензодиазепиновые снотворные средства и симпатомиметики. Ряд авторов полагают, что механизм возникновения НК на фоне их применения связан с влиянием на рецепторы ГАМК [10].
Лекарственные средства, способные вызывать ЛИНК
Существует достаточно большое количество ЛС из разных групп, прием которых ассоциирован с развитием НК (см. таблицу).
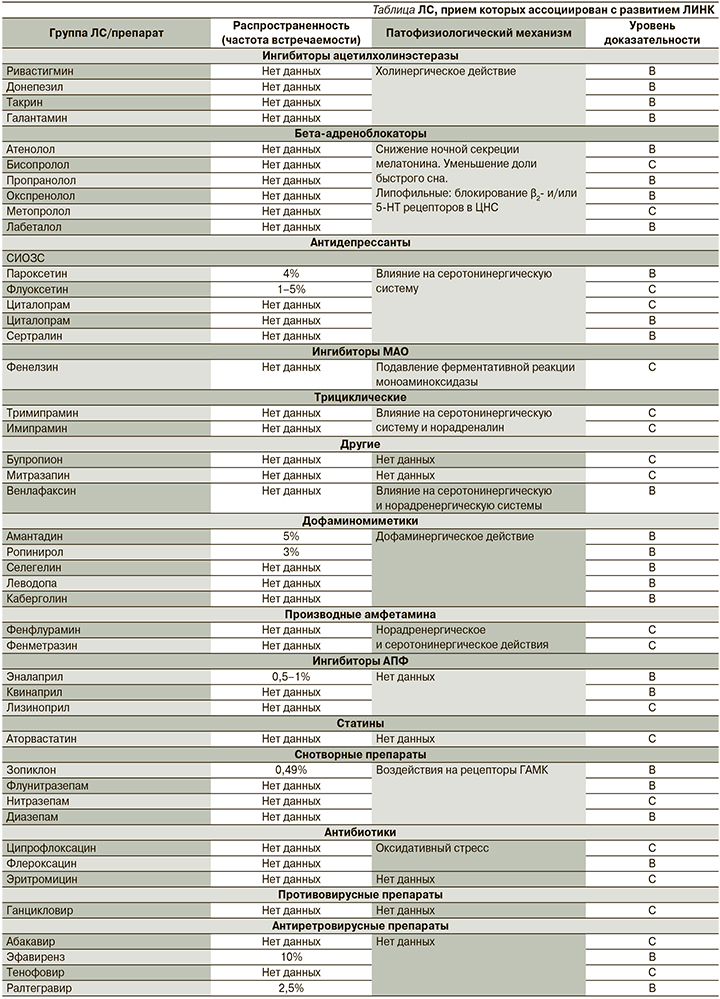
Ингибиторы ацетилхолинэстеразы
В ряде публикаций прием донепезила [21], ривастигмина, такрина [10] и галантамина [22, 23] был ассоциирован с НК. НК на фоне приема галантамина описаны, в частности, в работе S.M. Stahl et al. [23], которые проанализировали побочные эффекты галантамина по результатам трех рандомизированных двойных слепых клинических исследований. В исследование были включены 698 пациентов с болезнью Альцгеймера, разделенных на три группы: больных, получавших 16 мг галантамина (n=279), получавших 24 мг галантамина (n=705), и 714 больных, получавших плацебо. Было установлено, что в подгруппе пациентов, получавших галантамин в дозировке 24 мг/сут, НК встречались статистически значимо чаще, чем в группе плацебо (р=0,02).
Бета-адреноблокаторы
В популяционном исследовании C. Bengtsson et al. [24] (1302 женщины, возраст – 38–60 лет, 4,6% получали терапию БАБ, 4,3% диуретиками, 12,7% БАБ и другими антигипертензивными препаратами) у 13% женщин, получавших БАБ, были отмечены НК. Однако авторы не выявили статистически значимых различий по сравнению с женщинами, не получавшими антигипертензивную терапию. В обзоре J.F. Pagel et al. [10] выявлена связь между НК и приемом атенолола, бетаксолола, бисопролола, лабетолола, окспренолола и пропранолола.
Cove-Smith J.R. et al. [25] провели рандомизированное двойное слепое перекрестное исследование для сравнения побочных эффектов метопролола и атенолола (n=17, средний возраст – 51,4 года, 11 женщин). Липофильный БАБ, который получали пациенты (14 человек принимали пропранолол, 2 – пиндолол, 1 – окспренолол), был заменен на плацебо на 3 недели, после чего пациентам назначался либо метопролол 100 мг/cут, либо атенолол 100 мг/cут также на 3 недели. Во время приема плацебо у всех пациентов статистически значимо уменьшилось количество НК (p<0,01). Статистически значимых различий по частоте НК при сравнении атенолола и метопролола с плацебо, а также двух препаратов между собой выявлено не было.
Также в одном исследовании частота НК была выше у пациентов, получавших пропранолол (n=135), по сравнению с больными, получавшими лабеталол (n=805; 2,3 и 0,3% соответственно) [26]. Похожие результаты были получены при сравнении частоты побочных эффектов со стороны ЦНС (инсомния, НК, депрессия) при приеме пропранолола (23%) и бетаксолола (10%) [27]. В другой работе [28] НК статистически значимо (p<0,001) чаще встречались при приеме метопрололола и пропранолола по сравнению с атенололом. В единичной публикации описаны НК на фоне применения бисопролола [29].
Имеются данные о возникновении НК у пациентов, получавших метопролол [30, 31]. G. Boriani et al. [30] описали клинический случай пациента 55 лет, получавшего нифедипин 60 мг/сут, аспирин 325 мг/сут и симвастатин 10 мг/сут. Через 3 месяца после добавления к терапии метопролола 100 мг 2 раза в день у пациента начались НК. При уменьшении дозировки метопролола до 50 мг/сут состояние пациента не изменилось, а при замене метопролола на атенолол в дозировке 100 мг/сут НК полностью регрессировали. A.I.A. Ahmed et al. [31] описали возникновение НК у пожилого пациента, получавшего низкую дозу метопролола (25 мг/сут), аспирин 80 мг/сут, оксазепам 5 мг/сут и вальпроевую кислоту 500 мг 2 раза в день. После замены метопролола на амлодипин 10 мг/сут НК регрессировали в течение 1 недели. При повторном визите через 3 месяца НК у пациента также отмечено не было. Авторы считают, что у больного мог быть медленный метаболизм метопролола, однако генетическое тестирование не проводилось.
Ингибиторы ангиотензин-превращающего фермента
Прием нескольких ингибиторов АПФ ассоциировался с возникновением НК: каптоприла [32], эналаприла и квиниприла [10]. Согласно данным Центра фармаконадзора Нидерландов Lareb [33], НК на фоне приема эналаприла развились у 5 пациентов (отношение шансов [ОШ]=0,62; 95% доверительный интервал [ДИ] – 0,26–1,5), каптоприла – у 3 (ОШ – 0,15; 95% ДИ – 0,37–3,6) и периндоприла – у 1 пациента, однако полученные данные статистически не значимы. Кроме того, описан единичный клинический случай возникновения НК на фоне приема 10 мг лизиноприла у женщины 63 лет с ожирением [34]. Механизм возникновения НК на фоне приема ингибиторов АПФ не изучен, однако в одном экспериментальном исследовании интравентрикулярное введение ангиотензина II уменьшило длительность REM-сна [35].
Блокаторы рецепторов ангиотензина
Опубликован клинический случай возникновения НК на фоне прима валсартана [36].
Статины
P.J. Gregoor [37] описал НК у пациентки 72 лет, возникшие через 5 дней после добавления 10 мг аторвастатина к ее постоянной терапии (75 мг левотироксина, 5 мг амлодипина, 100 мг атенолола и 50 мг лозартана). S. Cham et al. [38] опубликовали серию из 12 случаев изменения настроения и поведения пациентов, получавших статины. У одного молодого больного, которому был назначен аторвастатин для лечения семейной гиперлипидемии в дозировке 20 мг, через 2 недели после начала приема препарата развились НК (содержание сна включало ножи и оружие, один из НК был настолько пугающим, что пациент после пробуждения выпрыгнул через окно), когнитивные нарушения (проблемы с концентрацией и вниманием в школе, вплоть до серьезных трудностей с чтением через месяц приема препарата), снохождение и тревожное расстройство, однако у пациента в семейном анамнезе имелись психические заболевания.
После двухлетней терапии аторвастатином пациент самостоятельно прекратил прием препарата и все симптомы регрессировали. Через 6 недель пациент снова начал принимать аторвастатин, после чего возобновились НК и когнитивные нарушения. Через 2 недели после повторной попытки приема аторвастатина пациент совершил самоубийство.
Антидепрессанты
СИОЗС. В единичных работах описаны НК у пациентов на фоне приема флуоксетина [39], пароксетина [40], сертралина [41] и циталопрама [42].
Ингибиторы МАО. Описано несколько клинических случаев НК на фоне отмены фенелзина [43–45]. С другой стороны, опубликованы серия случаев [46] и проспективное исследование [47], в которых фенелзин успешно использовался в лечении НК при ПТСР.
Трициклические антидепрессанты. На фоне приема ТЦА (таких, как тримипрамин и имипрамин) пациенты могут не запоминать свои сны, т.е. снижается частота воспроизведения снов [48, 49]. При этом тримипрамин может, наоборот, вызывать более приятные сны [48]. Возможно, возникновение НК на фоне приема ТЦА связано с режимом дозирования ЛС. Так, в двух исследованиях сравнивалось влияние однократного приема препаратов перед сном и многократного в течение суток (суточная доза была разделена на 3 приема в течение дня) [50, 51]. При приеме ТЦА на ночь 78,6% [50] и 47% [51] всех снов являлись НК, в то время как при многократном приеме в течение суток частота НК составляла лишь 11,5% [50] или они вовсе не возникали [51]. Отмена ТЦА также может приводить к НК [52–55]. При этом НК развиваются не только при передозировке имипрамина [52], но и у пациентов, получавших имипрамин в дозировке 150–300 мг/сут [53, 55]. С другой стороны, в публикации серии из 10 случаев НК у пациентов с ПТСР ТЦА существенно уменьшали частоту НК [56].
Другие антидепрессанты. Случаи НК также описаны на фоне приема норадренергического и селективного серотонинергического антидепрессанта митразапина [57–60]. Двухлетний мониторинг Австралийского комитета по оценке побочных реакций (ADRAC) показал, что НК на фоне приема митразапина были отмечены лишь у 14 лиц из практически 500 тыс. пациентов [61].
В единичной публикации описан клинический случай развития НК при приеме атипичного антидепрессанта бупропиона [62]. В исследовании по изучению применения венлафаксина с длительным высвобождением (XR) для профилактики мигрени и головной боли напряжения НК были отмечены у 1,8% пациентов с мигренью, но не у лиц с болью напряжения [63]. В исследовании S.P. Lam et al. [64] изменение схемы лечения 15 пациентов с депрессией с СИОЗС или ингибиторов обратного захвата серотонина и норадреналина на бупропион или полная отмена препаратов уменьшали частоту НК.
Дофаминомиметики
По данным J.F. Pagel et al. [10], НК связаны с приемом каберголина и некоторых противопаркинсонических препаратов (амантадина, леводопы, ропинирола, селегелина). Возникновение НК может также быть ассоциировано с дозировкой и способом введения противопаркинсонических препаратов. Так, S. Kumar et al. [65] в своей работе установили, что у пациентов с болезнью Паркинсона и НК (n=48) по сравнению с пациентами без НК (n=101) была выше средняя суточная дозировка леводопы (524,39±274,46 против 406,99±269,06 мг; р=0,025) и селегелина (10,00±0 против 9,32±1,74 мг; р=0,013), а при дуоденальной инфузии геля леводопы–карбидопы частота НК статистически значимо уменьшилась (p=0,0075) [66].
Производные амфетамина
В литературе опубликованы клинические случаи возникновения НК при приеме фенфлурамина [67–69] и фенметразина [70]. В одной из работ частота возникновения НК была статистически значимо линейно ассоциирована с дозировкой фенфлурамина [69].
Cнотворные препараты
Имеются данные о способности зопиклона и флунитразепама изменять содержание снов и вызывать НК [10]. Так, в постмаркетинговом исследовании НК на фоне приема зопиклона развились у 101 (0,49%) пациента, что являлось одним из самых частых побочных эффектов [71]. Флунитразепам увеличивал количество неприятных снов и по сравнению с группой плацебо вызывал более неприятные сны с агрессивным содержанием [72, 73]. Диазепам вызывал НК у детей [74] и взрослых [75, 76]. Также опубликован клинический случай НК при применении нитразепама [77].
С другой стороны, нитразепам уменьшал частоту НК в двойном слепом перекрестном исследовании [78].
Антибактериальные препараты
Фторхинолоны. НК являются довольно редким побочным эффектом ципрофлоксацина и флероксацина. В исследовании безопасности и эффективности ципрофлоксацина (9473 пациента) они развились лишь у одного [79]. В другой работе [80] среди 85 пациентов, получавших флероксацин, НК или галлюцинации отмечены у 7 участников. Опубликован клинический случай пациентки 24 лет, получавшей 500 мг ципрофлоксацина в связи с гастроэнтеритом. Через 2 дня после начала приема препарата у больной возникли НК, она стала раздражительной и тревожной в течение дня. НК полностью регрессировали после окончания курса лечения ципрофлоксацином (5 дней) [81]. Также имеются данные о возникновении НК на фоне приема ципрофлоксацина у 2 детей (4 и 5 лет) [82]. Точный механизм возникновения НК при приеме фторхинолонов не известен, однако в одной экспериментальной работе ципрофлоксацин вызывал оксидативный стресс в гиппокампе [83], который также играет важную роль в патофизиологии НК [8].
Макролиды. В доступной литературе опубликовано три клинических случая НК на фоне приема эритромицина [84–86]. N.R. Williams [84] описал НК у пациентки 23 лет, получавшей 250 мг эритромицина 4 раза в день для лечения сепсиса: НК развился через 48 часов после начала лечения. R.J. Black et al. [85] описали НК, который развился на следующий день после начала лечения пациентки 21 года, принимавшей эритромицин в дозировке 250 мг/сут для лечения акне. В течение следующего месяца больная продолжила терапию эритромицином, на фоне которой отмечала минимум 2 НК каждую неделю. В недавно опубликованном клиническом случае M.E. Møller et al. [86] также описана молодая пациентка 19 лет с синдромом Элерса–Данло и замедленным опорожнением желудка, которой был назначен прием 250 мг эритромицина 4 раза в день. НК развились в течение первой недели приема препарата, их частота составила 3–7 раз в неделю. Во всех трех клинических случаях НК на фоне приема эритромицина развились у молодых женщин без психических заболеваний в анамнезе и полностью регрессировали после отмены препарата [84–86]. Однако, принимая во внимание тот факт, что между данными публикациями прошло около 30 лет, НК можно отнести к крайне редким возможным побочным эффектам эритромицина.
Противовирусные препараты
Опубликован 1 клинический случай [87] развития НК и галлюцинаций на 15-й день терапии ганцикловиром внутривенно в дозе 5 мг/кг (300 мг) раз в 12 часов у женщины 45 лет со СПИДом и цитомегаловирусным ретинитом. У пациентки не было ВИЧ-энцефалопатии, инфекционных заболеваний ЦНС и психических заболеваний в анамнезе. Ганцикловир был отменен, и больной был назначен галоперидол в дозе 2 мг, после чего НК регрессировали. В связи с ухудшением симптомов цитомигаловирусного ретинита пациентке была назначена поддерживающая доза ганцикловира (300 мг/сут), на фоне которой НК и галлюцинации не повторялись. Авторы считают, что НК у больной возникли в связи с тем, что ее клиренс креатинина по формуле Кокрофта–Голта варьировался в пределах 0,62–0,80 мл/с, соответственно дозировка ганцикловира не должна была превышать 2,5 мг/кг/сут, в то время как пациентка получала 10 мг/кг/сут.
Антиретровирусные препараты
НК на фоне приема абакавира описаны в двух клинических эпизодах [88, 89]. В обоих случаях симптомы развились в течение первого месяца терапии. На фоне приема эфавиренза частым (>10%) побочным эффектом стали яркие сны [90], а также описан клинический случай возникновения НК [91]. Кроме того, описана серия случаев (9 пациентов) возникновения НК в течение менее 48 часов после добавления к терапии эфавирензом тенофовира [92]. Авторы не смогли объяснить причину НК у данных больных. В мета-анализе эффективности и безопасности ралтегравира у 2,5% пациентов, получавших препарат в дозе 400 мг 2 раза в день, развились «ненормальные» сны и НК [93].
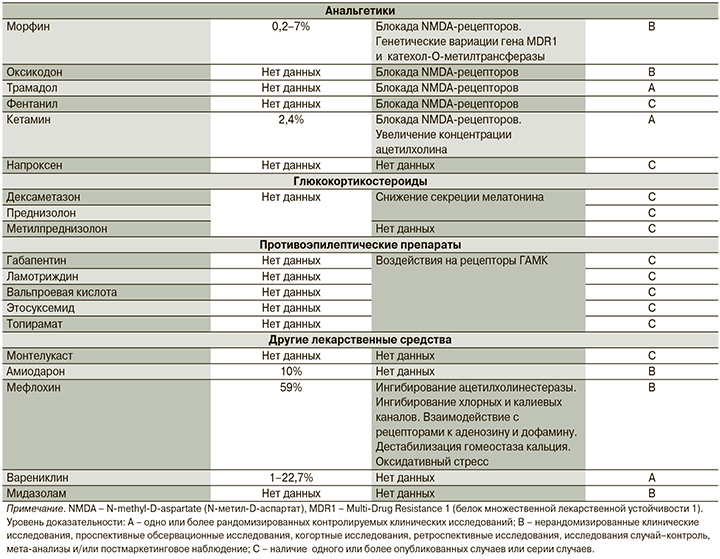
Анальгетики
Частота НК у пациентов, получающих морфин, колеблется в пределах 0,2–7% [94–96]. В перекрестном двойном слепом исследовании E. Kalso et al. [97] (n=10) было выявлено статистически значимо (р <0,05) больше НК при пероральном приеме морфина по сравнению с подкожным введением.
В другом проспективном исследовании [94] (2696 послеоперационных пациентов) не было выявлено статистически значимых различий в частоте НК при внутривенном и эпидуральном введении препарата. В серии клинических случаев НК развивались также при интратекальном введении морфина [98]. В проспективном исследовании P. Glare et al. [95] не было выявлено статистически значимых различий в частоте НК в группах пациентов, получавших разные дозировки морфина, однако больные получали множество сопутствовавших препаратов, которые могли влиять на возникновение НК. С помощью метода логистической регрессии J.R. Ross et al. [99] показали, что появление НК стало одним из предикторов изменения терапии с морфина на оксикодон (ОШ=3,58; 95% ДИ – 1,04–12,25; р=0,04), однако в другой работе подобной связи выявлено не было [100]. Кроме того, оксикодон тоже может вызывать НК [101, 102], хотя и реже, чем морфин [102]. В проспективном рандомизированном двойном слепом исследовании НК развились только в группе пациентов, получавших трамадол, а не морфин [103].
По результатам систематического обзора рандомизированных клинических исследований N. Elia et al. [104], частота НК на фоне приема кетамина составляет 2,4% (ОШ =2,64; 95% ДИ – 0,76–9,62; число больных в экспериментальной группе по сравнению с контрольной, необходимое для выявления дополнительного неблагоприятного исхода [Number Needed to Harm] – 62). В систематическом обзоре K. Laskowski et al. НК встречались чаще при использовании кетамина по сравнению с плацебо [105]. В открытом исследовании дозировки кетамина до 117 мкг/кг/мин или 7 мг/кг/ч в 90% случаев приводили к тревожным нарушениям, дисфории и НК [106]. В исследовании на здоровых добровольцах [107] частота НК, возникших дома (а не в стационаре), была выше у лиц, получавших субанестетические дозы кетамина, по сравнению с группой плацебо (p=0,008).
Также описан клинический случай НК при использовании трансдермального пластыря с фентанилом [101].
Механизм развития НК при применении опиодных анальгетиков не до конца ясен. Он может быть связан с блокадой рецепторов к N-метил-D-аспартату (NMDA) [108], генетическими вариациями гена MDR1 (multidrug resistance-1 gene) и катехол-О-метилтрансферазы при применении морфина [99], увеличением концентрации ацетилхолина при применении кетамина [109].
В отношении неопиодных анальгетиков в доступной литературе имеется публикация одного клинического случая развития НК у пациента, получавшего напроксен [110].
Противоэпилептические препараты
Согласно базе данных ВОЗ, габапентин, ламотриджин, вальпроевая кислота, этосуксимид и топирамат могут вызывать НК [111]. C другой стороны, в серии клинических случаев [112] габапентин уменьшал частоту НК у пациентов с ПТСР. Топирамат показал свою эффективность в отношении терапии НК при ПТСР в трех публикациях серий кинических случаев [113–115] и одном небольшом рандомизированном плацебо-контролируемом исследовании [116].
Глюкокортикостероиды
Согласно базе данных нежелательных побочных реакций ВОЗ VigiBase [111], НК встречаются при использовании дексаметазона, преднизолона и метилпреднизолона. R. Turner et al. [117] описали несколько случаев НК у пациентов с онкологическими заболеваниями, получавших дексаметазон в дозе 8–12 мг/сут. D. Clifton et al. [118] описали два клинических наблюдения НК у пациентов без тревожных и депрессивных расстройств, получавших высокие дозы дексаметазона или преднизолона. В одной работе на фоне применения интраназальных кортикостероидов у 9 (в т.ч. 2 детей) человек из 429 участников исследования развились «ненормальные сны», у 14 (в т. ч. 4 детей) – НК. Анализ по влиянию конкретных препаратов на НК не проводился [119]. Дексаметазон и преднизолон снижают секрецию мелатонина, что может потенциально приводить к развитию НК [120].
Другие лекарственные препараты
Монтелукаст. По результатам анализа Шведской базы данных побочных эффектов (Swedish Adverse Drug Reaction database, SWEDIS) [121], на фоне приема монтелукаста у 48 детей развились «психиатрические» побочные эффекты ( инсомния, кошмары, галлюцинации, ажитация и др.), из них у 15 (53% младше 5 лет) развились НК. G. Cereza et al. [122] опубликовали серию из 24 случаев (большинство пациентов были детьми в возрасте 2–7 лет) НК на фоне приема монтелукаста.
Амиодарон. Имеется ряд публикаций, в которых описаны НК на фоне приема амиодарона [123, 124]. Например, в работе D.E. Ward et al. [123] НК и «очень яркие» сновидения встречались у 10% пациентов, получавших терапию амиодароном.
Мефлохин. НК – очень частый побочный эффект противомалярийного препарата мефлохина [125, 126]. В одном из исследований [125] у 43 (59%) из 73 пациентов, получавших мефлохин, развились НК, которые сохранялись в среднем около месяца. Очень яркие сны и НК на фоне приема мефлохина описываются пациентами как «четкие, как в кино» и «живо вспоминающиеся даже несколько дней спустя» [127], что может являться продромальной стадией развития психоза [126]. Патогенетический механизм развития НК при применении мефлохина не до конца изучен, однако существуют данные, согласно которым нейротоксический эффект препарата может быть связан с ингибированием ацетилхолинестеразы [126], хлорных [128] и калиевых [129] каналов, взаимодействием с рецепторами к аденозину и дофамину [130], дестабилизацией гомеостаза кальция [128, 129], а также с оксидативным стрессом и последующей дегенерацией нейронов [131].
Варениклин. НК достаточно часто возникали на фоне применения варениклина в рандомизированных и когортных исследованиях [132–138]. Частота НК у пациентов, получающих варениклин, колеблется в очень широких пределах – от 1 до 22,7% (134, 136–138]. В своем мета-анализе K.H. Thomas et al. [139] показали, что применение варениклина увеличивало риск развития «ненормальных» снов (ОШ =2,38; 95% ДИ – 2,05–2,77). Лишь в одном рандомизированном двойном слепом исследовании M.J. Eisenberg et al. [140] не выявили статистически значимых различий по частоте НК у пациентов с острым коронарным синдромом, получавших варениклин, по сравнению с плацебо. В исследовании N. Fouz-Rosónet al. [134] не было отмечено статистически значимых отличий по частоте НК между группами пациентов, получавших 0,5 и 1 мг варениклина. H.E. Tulloch et al. [135] обнаружили, что частота нарушений сна (НК, инсомнии и др.) на фоне приема варениклина выше по сравнению с применением заместительной терапии никотином (р<0,001), однако субанализ по отдельным нозологиям не проводился. T.B. Baker et al. [141] показали что риск ярких снов при применении пластыря с никотином ниже по сравнению с применением варениклина. Однако Н. Tomioka et al. [142], проанализировавшие базу данных специального регистра из более чем 400 курильщиков, принимавших участие в 3-месячной программе по отказу от курения, не обнаружили статистически значимой разницы в частоте НК между пациентами, получавшими варениклин и пластырь с никотином. Наконец, в систематическом обзоре и мета-анализе P.-H. Chang et al. [143] показано, что «ненормальные» сны чаще встречались у пациентов, получавших варениклин в комбинации с никотиновым пластырем, по сравнению с пациентами, получавшими варениклин и пластырь с плацебо (ОШ = 1,20; 95% ДИ – 0,78–1,84).
Мидазолам. В двух исследованиях описано развитие НК у детей при премедикации мидазоламом [144, 145].
Диагностика ЛИНК
Стандартизированные шкалы разработаны в основном для пациентов с ПТСР, например, используются шкала для клинической диагностики ПТСР (Clinician Administered PTSD Scale, CAPS) и ее модификации [20]. Также применяют симптоматический опросник (Symptom Checklist-90, SCL-90) [20]. Специфических шкал для диагностики ЛИНК не существует, соответственно, необходим тщательный сбор анамнеза пациента и анализ всех принимаемых им ЛС.
Тактика ведения пациентов с ЛИНК
Не существует четких рекомендаций по лечению ЛИНК. При наличии НК необходимы тщательный сбор анамнеза и принимаемых им ЛС, а также оценка эмоционального состояния пациента. Риск НК на фоне применения системных глюкокортикостероидов может быть потенциально снижен временем назначения препаратов (в утренние часы) и/или дополнительным назначением препаратов с седативным эффектом на ночь [146]. Если отмена или замена препарата, вызывающего НК, невозможна, существует ряд психотерапевтических методик, которые могут использоваться для лечения НК [20].
Прогноз
В случае выявления и отмены ЛС, вызвавшего НК, прогноз благоприятен. Во всех вышеописанных исследованиях НК полностью регрессировали после отмены такого препарата.
Заключение
Таким образом, ЛИНК являются малоизвестным практикующим врачам побочным эффектом ряда ЛС. Список лекарственных препаратов, прием которых ассоциирован с возникновением НК, достаточно широк, а механизмы их развития сложны, многообразны и в большинстве случаев недостаточно изучены. Поэтому повышение информированности врачей разных специальностей о данной нежелательной побочной реакции, своевременные мероприятия по коррекции выявленных нарушений сна, включающие в т.ч. возможную отмену вызвавших НК препаратов, а также профилактика развития данной побочной реакции имеют очень важное значение.


