Основной принцип назначения лекарственных препаратов (ЛП) заключается в необходимости достижения максимального положительного эффекта и минимизации отрицательных последствий лекарственной терапии [1]. Для достижения поставленных целей врач любой специальности должен выбрать конкретный ЛП из имеющихся аналогов; подобрать схему лечения, учитывая возрастные, половые и другие особенности пациента, которые могут отразиться на действенности проводимой терапии или ее побочных эффектах; учесть возможность взаимодействия с другими ЛП, средствами народной медицины, а также компонентами пищи, которые принимает пациент; предупредить пациента о возможности развития нежелательных побочных эффектов лекарственной терапии; объяснить необходимость выбора данной, а не альтернативной терапии, возможность или невозможность замены ЛП на аналогичный [1]. Среди перечисленных задач вопросы безопасности лечения занимают особое место в случае проведения длительных, порой пожизненных курсов фармакотерапии. Известно, что развитие побочных эффектов не только снижает приверженность пациентов терапии, но и приводит к появлению новых медицинских и социальных проблем [2]. Разработка и изучение новых ЛП всегда включают оценку как эффективности, так и безопасности терапии, включая характер и степень выраженности побочных эффектов. При этом ежегодно в мире исключается из списка разрешенных для клинического применения ЛП около 100–200 препаратов, чаще – по причине высокой токсичности [3, 4].
Одним из первых противоэпилептических препаратов (ПЭП) является фенобарбитал, его противосудорожные свойства были обнаружены в 1910 г. [5]. С конца 1960-х гг. и в течение последующих десятилетий в клиническую практику были внедрены карбамазепин, фенитоин, примидон, бензодиазепины, этосуксимид, сультиам, препараты вальпроевой кислоты, относящиеся к ПЭП I поколения. Стимулом к разработке новых ПЭП послужил тот факт, что более чем у 30% пациентов при применении ПЭП I поколения наблюдалась резистентность к проводимому лечению или же развивались серьезные побочные эффекты [6]. В результате в конце 1990-х гг. в клинической практике появились ПЭП II поколения: фелбамат, габапентин, ламотриджин, топирамат, тиагабин, окскарбазепин, леветирацетам, зонизамид, клобазам, вигабатрин [7]. Создание ПЭП II поколения было нацелено на расширение спектра действия ЛП, повышение эффективности, безопасности, переносимости терапии и улучшение фармакокинетического профиля [8]. Однако в последующие годы изучение безопасности применения ПЭП II поколения в клинической практике показало различные результаты. Например, хорошая переносимость леветирацетама без значимых побочных эффектов, требующих снижения дозы или отмены терапии [9, 10], не подтверждается в ряде исследований. Показано, что на фоне приема леветирацетама нарушения поведения встречаются с частотой от 10 до 51%, отмечается появление или усиление возбудимости, раздражительности, колебания настроения и агрессивность [11]. В XXI в. накопление неоднозначных данных о безопасности ПЭП II поколения послужило толчком к появлению и расширению арсенала ПЭП III поколения, включая лакосамид, руфинамид, эсликарбазепин и др.
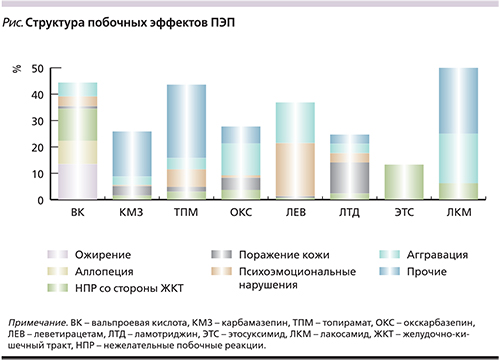
Особое место среди побочных эффектов на фоне приема ПЭП занимает аггравация эпилептических припадков – парадоксальный фармакодинамический эффект ПЭП, в результате которого увеличивается либо частота эпилептических припадков, либо число новых припадков [12, 13]. Сложность изучения такой аггравации заключается в отсутствии плацебо-контролируемых исследований вероятности спонтанного учащения имеющихся припадков и развития припадков нового типа у пациентов с естественным течением эпилепсии. При этом аггравация припадков на фоне приема ПЭП является сигналом о необходимости коррекции терапии: если установлен ПЭП, вызвавший аггравацию, необходимо снизить его дозу, но во многих случаях требуется замена ПЭП [14]. Улучшение состояния пациента после отмены или снижения дозы ПЭП является подтверждением выявления аггравации.
Аггравация эпилептических припадков может возникнуть при приеме любого ПЭП. К сожалению, до конца не ясны механизмы, лежащие в основе эффективности ПЭП новых поколений, как и механизмы, вовлеченные в процесс аггравации припадков на фоне их использования [15]. Выявление и описание случаев аггравации, а также сравнительная характеристика частоты регистрации аггравации припадков на фоне приема ПЭП различных поколений должны помочь практикующим врачам в проведении эффективной и безопасной фармакотерапии эпилепсии.
Цель работы: изучение частоты аггравации эпилептических припадков на фоне приема ПЭП различных поколений.
Материал и методы
Настоящее исследование одобрено Этическим комитетом КрасГМУ им. проф. В.Ф. Войно-Ясенецкого. Исследование выполнено в рамках комплексных исследований по теме 210–16. «Эпидемиологические, генетические, нейрофизиологические аспекты заболеваний центральной, периферической, вегетативной нервной системы и превентивная медицина» (руководитель – д.м.н., проф. Н.А. Шнайдер), номер госрегистра-ции – 0120.0807480.
Проанализирована случайная выборка 926 амбулаторных карт пациентов, страдающих эпилепсией и наблюдающихся в Неврологическом центре эпилептологии, нейрогенетики и исследования мозга Университетской клиники КрасГМУ им. проф. В.Ф. Войно-Ясенецкого (далее НЦ УК), из них дети составили 269 (29%) человек, взрослые – 660 (71%). Случаи ухудшения состояния пациентов, связанные с заменой ПЭП на препарат другого торгового наименования и включенные в регистр НЦ УК [16], в настоящем исследовании не учитывались.
Статистическая обработка полученных результатов проведена с помощью пакетов статистических программ Statistica v.6.1 (Stat Soft, USA). Для сравнения и оценки выявленных различий использовался непараметрический χ2-критерий. Различия расценивались как статистически достоверные при уровне значимости p≤0,05.
Результаты и обсуждение
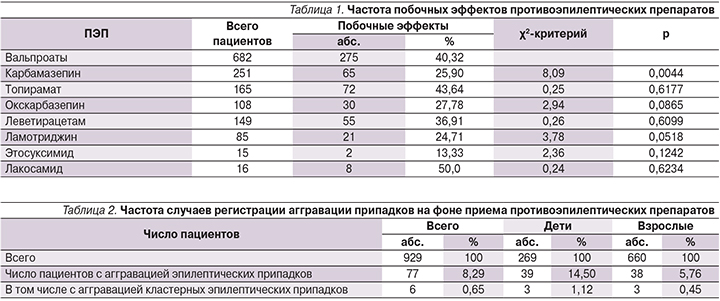
Проведенный анализ базы данных НЦ УК показал, что частота развития побочных эффектов на фоне приема ПЭП в целом не зависит от возраста и пола пациентов: у детей побочные эффекты зарегистрированы в 29% случаев, у взрослых – в 23,5% (р=0,16). Доля мужчин и женщин с зарегистрированными побочными эффектами составила 23,84 и 23,27% соответственно (p>0,05). Доля девочек с побочными эффектами превысила таковую мальчиков (34,92 и 24,44% соответственно), но межгрупповые различия не достигли статистической значимости (р=0,14) [17].
Частота развития побочных эффектов в проанализированной нами случайной выборке (926 человек) варьировалась от 24,5 до 50,0% в зависимости от ПЭП (табл. 1).
В структуре побочных эффектов на фоне приема вальпроатов преобладали ожирение, алопеция и побочные эффекты со стороны желудочно-кишечного тракта. В структуре побочных эффектов на фоне приема топирамата, леветирацетама, ламотриджина преобладали когнитивные расстройства и психоэмоциональные нарушения (см. рисунок).
Аггравация эпилептических припадков была зарегистрирована у 77 пациентов, что составило 8,3% от общего числа проанализированных случаев. При этом у детей аггравация встречалась статистически значимо чаще, чем у взрослых: 14,5 против 5,76% соответственно (χ2=15,75; р=0,0001) (табл. 2), что является тревожным с клинической точки зрения явлением. С одной стороны, учащение припадков у детей может приводить к речевому и психомоторному регрессу. С другой стороны, учащение припадков является частой причиной необоснованного назначения дополнительного ПЭП или наращивания дозы ранее принимаемых ПЭП.
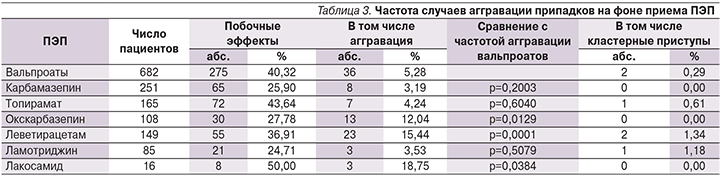
На фоне приема ПЭП I поколения частота аггравации была невысокой и статистически значимо не отличалась среди пациентов, принимавших вальпроаты (5,28%), по сравнению с пациентами, принимавшими препараты карбамазепина (3,19%; р>0,05).
В связи с небольшим числом пациентов (15 человек), получавших этосуксимид, наблюдение будет продолжено.
Частота аггравации на фоне приема топирамата и ламотриджина (4,24 и 3,53% соответственно) была наименьшей в группе ПЭП II поколения. Наибольшая частота аггравации выявлена на фоне приема ПЭП II поколения – леветирацетама и окскарбазепина (15,44 и 12,04% соответственно), что статистически значимо выше таковой на фоне приема вальпроатов (5,28%; р>0,05, табл. 3).
Оценка частоты случаев аггравации на фоне приема ПЭП III поколения – лакосамида (18,75%) проведена на небольшом числе (16 человек) пациентов, что требует накопления наблюдений и последующего исследования.
У 1 (0,1%) пациентки аггравация эпилептических припадков зарегистрирована на фоне последовательного приема трех ПЭП (карбамазепин, вальпроат, леветирацетам). У 13 (1,4%) пациентов, из них – 8 (61,5%) детей, аггравация отмечена в анамнезе на фоне приема двух ПЭП. Интересно отметить, что у 10 из 23 пациентов, имевших аггравацию на фоне приема леветирацетама, в анамнезе отмечена аггравация эпилептических припадков, ассоциированная и с другими ПЭП.
Особое внимание среди зарегистрированных случаев аггравации занимают случаи развития эпилептических кластеров (серийных эпилептических припадков). Наибольшая частота аггравации кластеров зарегистрирована на фоне приема леветирацетама (1,34%), ламотриджина (1,18%) и топирамата (0,61%) (табл. 3).
Полученные результаты не противоречат данным, полученным другими авторами. Среди ПЭП I и II поколений вальпроаты позиционируются как ПЭП с наименьшим риском аггравации эпилептических припадков [18], что согласуется с проведенным нами исследованием. Ряд авторов относят карбамазепин к ПЭП с наиболее высоким риском аггравации [19, 20], что противоречит полученным нами результатам и требует дополнительных исследований. Среди ПЭП II поколения высокая частота аггравации на фоне приема леветирацетама (15,3%) среди детей, страдающих эпилепсией, показана А.А. Холиным и соавт. [21]. Сопоставимые с нашими данными аггравации, ассоциированной с приемом топирамата и ламотриджина (менее 5%), показаны в отечественном исследовании реальной клинической практики [20].
Выводы
Анализ безопасности и частоты развития побочных эффектов не выявил достоверного преимущества ПЭП II поколения по сравнению с ПЭП I поколения. Существенные отличия наблюдаются в структуре выявленных побочных эффектов. По сравнению с ПЭП I поколения для ПЭП II и III поколений наиболее характерны побочные эффекты со стороны психоэмоциональной сферы (агрессивность, депрессия, гипервозбудимость). Аггравация эпилептических припадков возможна на фоне приема ПЭП как I, так и последующих II и III поколений, однако частота случаев аггравации на фоне приема леветирацетама и окскарбазепина статистически значимо выше, чем при приеме вальпроатов.


