Введение
В настоящее время лечение рака молочной железы (РМЖ) носит комбинированный характер и зачастую включает проведение системной химиотерапии (ХТ), которая все чаще назначается в неоадъювантном режиме (НАХТ) [1]. Это продиктовано, во-первых, стремлением к уменьшению объема первичной опухоли, что создает более благоприятные условия для выполнения органосохраняющих операций [1, 2], во-вторых, определением чувствительности первичной опухоли к проводимой ХТ in vivo, что позволяет адекватно планировать лечение в адъювантном режиме, и в-третьих, достижение полного морфологического регресса способствует улучшению отдаленных результатов лечения [3–5]. С другой стороны, появляется все больше работ, свидетельствующих, что ХТ и таргетная терапия могут стимулировать у некоторых больных образование новых мутаций, приводящих к формированию резистентности и прогрессирования опухоли [6]. К. Oshima et al. (2016) показали, что при рецидиве острого лимфобластного лейкоза после ХТ возникает ряд новых мутаций, в частности, в 44% (24/55) случаях наблюдались мутации в генах NRAS, KRAS и PTPN11. Авторы считают, что ХТ играет ведущую роль в возникновении этих мутаций и стимулирует за счет этого рецидивирование и развитие резистентности [7]. J.M. Findlay et al. (2016) исследовали 30 образцов аденокарциномы пищевода до лечения и после двух курсов предоперационной ХТ по схеме оксалиплатин-фторурацил. У не отвечающих на ХТ больных в опухоли после лечения возникли мутации ТР53 (их не было в начальных образцах), и это коррелировало с плохим исходом (≈20% больных). Резистентные опухоли также имели в ряде генов драйверные мутации de novo и амплификации нескольких локусов ДНК [8].
НАХТ в некоторых случаях стимулировала метастазирование РМЖ [9].
В отношении отдельных больных показано, что ХТ может активировать этапы процесса метастазирования, стимулируя эпителиально-мезенхимальный переход в опухолевых клетках [10], инвазию, интравазацию, воспаление [11], выброс циркулирующих опухолевых клеток в кровь [12]. Кроме того, повышенную агрессивность и метастазирование опухоли под действием ХТ связывают со стимуляцией опухолевых стволовых клеток [13], активность которых определяется повышенной экспрессией генов стволовости (ГС), таких как OCT3, SOX2, KLF4, c-MYC, NOTCH, NANOG, LIN28, ZEB1, SNAIL, VIM, TWIST [14-19]. По-видимому, настало время. Следует полагать, что необходим пересмотр показаний к назначению НАХТ и формированию новых подходов, которые учитывали бы вероятность формирования резистентных и прогрессирующих клонов опухолевых клеток. Назначение лечения должно быть персонализированным, и необходимо прогнозировать возможную стимуляцию метастазирования у больного. С этих позиций необходимы новые опухолевые маркеры, ассоциирующиеся с высоким риском прогрессирования заболевания на фоне проводимого лечения, что имеет наибольшую значимость для пациентов, получающих ХТ в предоперационном периоде. Такие маркеры помогут стратифицировать больных РМЖ и персонализировать выбор адекватного лечения.
Учитывая данные по опухолевым стволовым клеткам, активность которых связывают с ростом опухоли и метастазированием [20], мы аннотировали регионы локализации ГС (SOX2, ZIC1, TERT, LIFR, BMP6, OCT3, SOX4, NOTCH4, FZD9, FZD1, WNT2, SMO, SNAI2, MYC, MOB3B, ALDH1A1, TGFBR1, KLF4, NOTCH1, KLF6, VIM, BMI1, ITGB1, ZEB1, NODAL, NANOG, SOX1, ZIC2, KLF5, SMAD9, FLT3, SOX8, LAT, SMAD4, SMAD2, LMNB2, INSR, KLF1, KLF2) и оказалось, что они собраны в регионах 3q(26,33; 34), 5p(15,33; 13,1), 6p(24,3; 22,3; 21,33; 21,32), 7q(11,23; 21,13; 31,2; 32,1), 8q(11,21; 24), 9p(21,2), 9q(34,3; 21,13; 31,2, 22,33), 10p(15,2; 13; 12,2; 11,22), 10q22,1, 12р(13,31) 13q(34; 32,3; 22,1; 13,3; 12,2), 16p(11,2; 13,3), 18q(21,1; 21,2) и 19p(13,3; 13,2; 13,12). Хорошо известно, что повышенная экспрессия генов может быть обусловлена амплификацией его локусов, которые широко распространены в солидных опухолях.
Целью настоящего исследования стала оценка непосредственной эффективности НАХТ и безметастатической выживаемости (БМВ) у больных РМЖ в зависимости от наличия в первичной опухоли молочной железы амплификаций регионов локализации ГС.
Методы
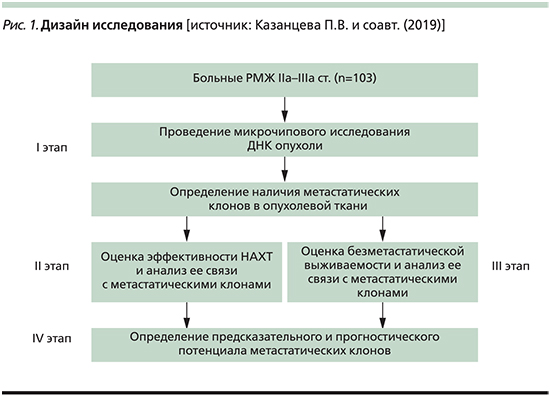
В исследование были включены 103 пациентки с первично операбельным РМЖ. На этапе диагностики всем больным проведено полное клинико-инструментальное обследование, объем которого соответствовал алгоритмам рекомендованным и утвержденным Министерством здравоохранения и социального развития РФ.
Все пациентки получили 4–8 курсов НАХТ по схемам FAC, АС, CAX, таксотер в монорежиме, DT, СР и АТ с последующим хирургическим лечением (в объеме радикальной мастэктомии, органосохранной операции или подкожной мастэктомии с одномоментной пластикой). В послеоперационном периоде больным назначались таргетная терапия, адъювантная ХТ, лучевая терапия, гормональное лечение по показаниям. Всем больным до начала лечения выполнена биопсия опухоли под ультразвуковым контролем с обязательным гистологическим исследованием биоптата, при морфологическом исследовании определялись рецепторы эстрогена и прогестерона, экспрессия HER2, Ki-67, молекулярный подтип РМЖ. Проведено микрочиповое исследование первичной опухоли до лечения. Эффект НАХТ оценивался по шкале ВОЗ на основании данных клинического осмотра, УЗИ, маммографии. Пятилетняя БМВ рассчитывалась методом Каплан–Майер с расчетом регрессирования Кокса.
Критерии включения:
- Гистологически подтвержденный диагноз: РМЖ T2-3N0-2M0.
- Проведение первым этапом лечения НАХТ.
Критерии исключения:
- Наличие отдаленных метастазов.
- Отсутствие клинико-морфологических показаний к НАХТ.
- Выраженная сопутствующая патология.
- Возраст больных старше 70 лет.
Дизайн исследования представлен на рис. 1. В ткани опухоли до лечения определены амплификации хромосомных регионов локализации ГС: 3q,5p, 6p, 7q, 8q, 9p, 9q, 10p,10q21.1, 12p, 13q, 16p, 18q, 19p. Проведена оценка эффективности НАХТ у больных, включенных в исследование, и ее связи с наличием в опухоли амплификаций локусов ГС. В результате определена предиктивная значимость амплификаций ГС. После этого была рассчитана БМВ больных, включенных в исследование в зависимости от наличия в ткани опухоли 0–1 или ≥2 амплификаций хромосомных регионов локализации ГС и установлена прогностическая ценность изучаемых маркеров. Морфологическое исследование биопсийного материала, фиксированного в 10–12%-ном нейтральном формалине, осуществлялась по стандартной методике. Диагноз РМЖ устанавливался согласно Гистологической классификации опухолей молочной железы (ВОЗ, 2012). Степень злокачественности определена по модифицированной схеме P. Scarff, H. Bloom и W. Richardson. Оценку патоморфоза проводили по системе RCB. Иммуногистохимическое исследование выполнено по стандартной методике. Использовали антитела фирмы Dako к рецепторам эстрогена (клон 1D5, RTU, мышиные), прогестерона (клон PgR 636, RTU, мышиные), к онкопротеину c-erbB-2 (Her2/neu статус; рабочее разведение 1:500, кроличьи) и к Ki-67 (клон MIB-1, RTU, мышиные) фирмы Novocastra (Великобритания).
Для выделения ДНК использовали набор QIAamp DNA mini Kit (Qiagen, Германия) в соответствии с инструкцией.
Микроматричный анализ проводили на ДНК-чипах высокой плотности фирмы Affymetrix (США) CytoScanTM HD Array на системе Affymetrix GeneChip® Scanner 3000 7G (Affymetrix, США). Для обработки результатов микрочипирования использовали программу «Chromosome Analysis Suite 3.0» (Affymetrix, США). Данная микроматрица позволяет в полногеномном формате по методу SNP-array определять CNA всех хромосом размером более 3 kb с чувствительностью 5–10% мутантной ДНК на фоне нормальной ДНК стромы опухоли.
Эффективность НАХТ оценивали по шкале ВОЗ на основании данных клинического осмотра, УЗИ молочных желез и маммографии, проведенных до лечения и через 3 недели после последнего курса НАХТ. Полный морфологический регресс подтверждался гистологически.
Статистическая обработка данных выполнена с использованием пакета программ SPSS Statistics 17.0 (США).
Исследование одобрено локальным этическим комитетом Томского НИИ онкологии.
Основные результаты исследования
Из 103 больных, включенных в исследование, ≥2 амплификаций ГС было обнаружено в опухолевой ткани 59 (57,3%) больных, 0–1 амплификация имела место у 44 (42,7%) пациенток.
Проведен анализ непосредственной эффективности НАХТ. В общей группе прогрессирование наблюдалось в 7,7% (n=8), стабилизация в 24,3% (n=25), частичный регресс в 60,2% (n=62), полный регресс в 7,7% (n=8) случаев.
При оценке связи эффективности НАХТ с наличием в ткани первичной опухоли амплификаций ГС установлено, что у больных с 0–1 амплификацией частичный и полный регресс наблюдались в 65,9% (n=29) случаев, а стабилизация и прогрессирование в 34,1% (n=15). Среди пациенток, в нативной опухоли которых было идентифицировано ≥2 амплификаций ГС, эти показатели были равны соответственно 69,5% (n=41) и 30,5% (n=18) р=0,831. Таким образом, наличие ≥2 амплификаций ГС в опухоли не имеет предиктивной значимости.
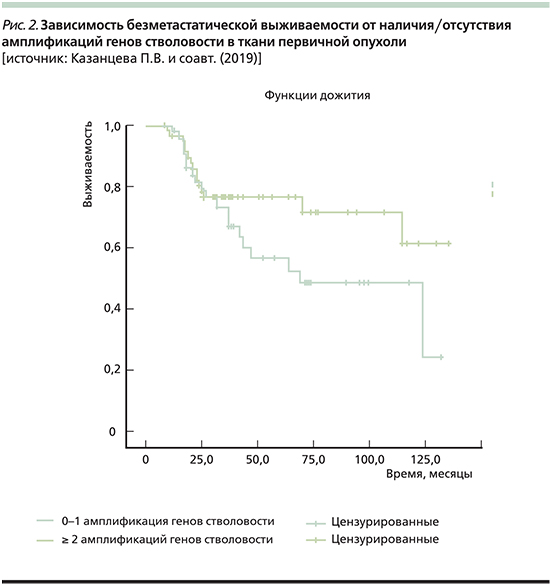
Как и планировалось, нами была изучена БМВ больных. При 0–1 амплификации ГС в первичной опухоли медиана выживаемости составила 68 месяцев, а среди пациенток с наличием ≥2 амплификаций хромосомных регионов локализации ГС она достигнута не была. Однако при сравнительной оценке выживаемости в этих двух группах оказалось, что статистически значимых различий нет (Log Rank [Mantel-Cox] p=0,129; рис. 2).
Помимо общей оценки отдаленных результатов лечения нами была проанализирована связь БМВ с непосредственной эффективностью НАХТ отдельно среди пациенток с 0–1 и ≥2 амплификаций ГС в ткани первичной опухоли.
БМВ с 0–1 амплификацией ГС не различалась статистически значимо у пациенток с частичным или полным регрессом в ответ на НАХТ и больных со стабилизацией или прогрессированием опухоли (Log Rank [Mantel-Cox] p=0,843; рис. 3).
У пациенток с наличием ≥2 амплификаций ГС в опухоли достижение полного или частичного регресса ассоциировалось с высокой БМВ по сравнению с больными со стабилизацией или прогрессированием (Log Rank [Mantel-Cox] p=0,025; рис. 4).

Обсуждение
Полученные результаты позволяют сделать вывод, согласно которому амплификации хромосомных регионов локализации ГС в первичной опухоли не обладают предсказательной значимостью. Было показано, что БМВ пациенток, в опухолевой ткани которых были идентифицированы амплификации ≥2 хромосомных регионов локализации ГС (3q,5p, 6p, 7q, 8q, 9p, 9q, 10p,10q21.1, 13q, 16p, 18Chr, 19p), не отличалась значимо от БМВ в группе больных, в первичной опухоли которых отсутствовала или была только 1 амплификация.
Установлено, что у пациентов с 0–1 амплификацией ГС в первичной опухоли высокая эффективность предоперационной ХТ не обладает прогностической значимостью.
В то же время оказалось, что у больных с присутствием двух и более амплификаций ГС высокая эффективность предоперационной ХТ значимо улучшает отдаленные результаты лечения.
В настоящем исследовании впервые был оценена предиктивная и прогностическая значимость амплификаций хромосомных регионов локализации ГС – 3q,5p, 6p, 7q, 8q, 9p, 9q, 10p,10q21.1, 12р, 13q, 16p, 18q, 19p – в ткани первичной опухоли больных РМЖ. Основным результатом представленной работы стало выявление их прогностической значимости с одновременной оценкой непосредственной эффективности НАХТ. Достижение как полного, так и частичного регресса новообразования на фоне НАХТ у больных РМЖ, в первичной опухолевой ткани которых идентифицировано ≥2 амплификаций любых регионов локализации ГС, ассоциировано со значительным повышением БМВ. Однако даже хороший ответ на НАХТ не ведет к увеличению выживаемости больных с 0–1 амплификацией ГС. Иначе говоря, пользу от НАХТ в отношении увеличения выживаемости имеют только пациентки, в опухоли которых до лечения определяется ≥2 амплификаций ГС, и именно этим больным показана НАХТ.
По данным литературы, многие амплификации обозначенных нами хромосомных регионов встречаются в опухоли и ассоциированы с неблагоприятным исходом. Согласно базе данных www.progenetix.org по частоте встречаемости при опухолях всех изученных локализаций (177 типов опухолей), амплификация 8q24 оказалась наиболее распространенной CNA и встречалась более чем в 30% всех образцов [21]. Наиболее значимым геном в этом локусе, по данным COSMIC, является протоонкоген с-Myc [22], а по совместительству и ГС, входящий в коктейль Синью Яманаки [23]. Установлено, что амплификации 8q региона предсказывают развитие метастазов у больных РМЖ [24].
В другом исследовании 8227 опухолей различных локализаций было определено, что наиболее часто амплификации встречаются в 1q, 5p, 7p, 8q, и 20q регионах [25]. В исследовании H. Wikman et al. (2012) в первичной опухоли молочной железы больных с метастазами в головной мозг была показана высокая частота (более 30%) амплификаций локусов 8q, 16p. В метастазах амплификации были найдены во многих локусах, в т.ч. и в нескольких из нашего списка (5p, 7, 8q, 10p, 18) с частотой встречаемости >30% [26]. Повышенная экспрессия самих ГС также связана со стимуляцией опухолевых стволовых клеток и неблагоприятным прогнозом. Такого рода данные имеются в отношении SOX2, TGF-β, ОСТ3 и MYC [10, 15, 27, 28]. Повышенная экспрессия гена LAT показана при многих видах рака и ассоциирована с неблагоприятным исходом для рака эндометрия и РМЖ [29, 30]. Помимо индукции стволовости SNAI2 и VIM увеличивают инвазию опухолевых клеток, и эта стимуляция может происходить под действием ХТ [12, 20]. Таким образом, в различных исследованиях показано, что амплификации регионов локализации ГС и их повышенная экспрессия служат маркерами неблагоприятного исхода заболевания.
Ограничения исследования
В настоящий момент ограничения исследования могут быть связаны с использованием в неоадъювантном режиме таргетной терапии для лечения больных с HER2+ РМЖ, что обеспечивает высокую частоту полных морфологических регрессий. В этом случае вероятность появления новых мутантных клонов под действием предоперационной терапии существенно снижена и необходимость прогноза их появления остается под вопросом.
Заключение
Полученные на сегодняшний день данные позволяют говорить о перспективности дальнейшего изучения новой стратегии лечения больных РМЖ. Если в опухолевой ткани определяется 0–1 амплификация ГС, то таким пациенткам целесообразнее начать лечение с хирургического вмешательства с последующим проведением адъювантной ХТ. Если же в опухолевой ткани идентифицированы ≥2 амплификаций регионов локализации ГС, то таким больным следует назначать НАХТ, которая в случае высокой эффективности может существенно увеличить БМВ. Представленные результаты дают основание для начала проспективного исследования, в котором НАХТ будет назначаться пациенткам в зависимости от наличия в опухоли амплификаций ГС.



