Актуальность
Тридцать–сорок лет назад, когда в большинстве стран в основном выполнялась радикальная мастэктомия, увеличение показателей выживаемости и определенное снижение смертности в некоторых странах Европы и Северной Америки связывали с внедрением маммографического скрининга. В последующие годы по мере лучшего понимания механизма и биологии заболевания, обусловившего более широкое применение адъювантной системной терапии (гормоно- и химиотерапии), наблюдающееся увеличение показателей выживаемости нельзя было объяснить влиянием только скрининга, т.к. оно наблюдалось и вне скрининга (при более распространенных карциномах молочной железы) [1, 2].
В практических условиях планирование системного лечения основывается на стадии, иммуногистохимическом подтипе заболевания и возра-сте пациента (пре-, постменопауза). Соответственно, выделяются люминальные (ER+) опухоли (люминальный А и люминальный B), HER2-позитивные и трижды негативные подтипы (фенотипы) РМЖ (ТНРМЖ). Они не полностью соответствуют молекулярно-генетическим вариантам, определяемым по экспрессии соответствующих генов (например, с помощью РАМ-50) [3, 4].
В рекомендациях St. Gallen (2019) H.J. Bustein [5] и ESMO (European Society of Medical Oncology, 2019, 2020) [6] уровень экспрессии рецепторов эстрогенов (ER) от 1 до 10%, ранее считавшийся низким для назначения гормонотерапии, был признан достаточным обоснованием гормонального лечения. Конечно, это вызывает много вопросов, т.к. до сих пор не проводилось специальных клинических испытаний эффективности ЭТ при низкой экспрессии ER (от 1 до 10%) [7].
Сторонники такой широкой интерпретации позитивности ER напоминают, что в 2018–2019 гг. произошел очередной пересмотр методологии лабораторного определения и трактовки позитивности экспрессии рецепторов стероидных гормонов. Если принять эту точку зрения, то 70–80% РМЖ следует считать гормонзависимыми при уровне экспрессии ER выше 1%.
В связи с широким распространением люминального А – раннего (операбельного) РМЖ, важно знать, какие из этих пациентов нуждаются кроме ЭТ в адъювантной или неоадъювантной химиотерапии (ХТ). На прошедшей в октябре 2020 г. 12-й конференции по раннему РМЖ (EBCC-12, Barcelona, 2020) по крайней мере две сессии были посвящены лечению люминальных опухолей молочной железы. Одна из них называлась «Пациенты с люминальным А-подтипом РМЖ не нуждаются в адъювантной ХТ» (председатель – д-р Christos Sotiriou). Показания к адъювантной ХТ были рассмотрены с учетом профиля генной экспрессии (рис. 1). Еще на конференции St. Gallen (2019) на вопрос, полезен ли геномный анализ в определении показаний к ХТ при ER+ РМЖ, Т3N0 или 1–3 N+» 74,5% членов панели экспертов ответили позитивно. На 12-й конференции EBCC (2020) были рассмотрены 9-летние результаты двух крупнейших клинических испытаний (TAILOR – генная экспрессия ONCOTYPE DX, и MINDACT – генная экспрессия MAMMAPRINT). В обоих проектах в группах пациентов промежуточного риска, составивших около 75% популяции, не выявлено достоверной пользы от дополнительной к ЭТ ХТ. Некоторое (3–5%) улучшение выживаемости благодаря ХТ наблюдалось в испытании MINDACT у пременопузальных пациентов с высоким клиническим и молекулярным риском. Планирование лечение ER+ РМЖ, основанного на результатах исследований TAILOR и MINDACT, получило 1А-уровень доказательности [8, 9].
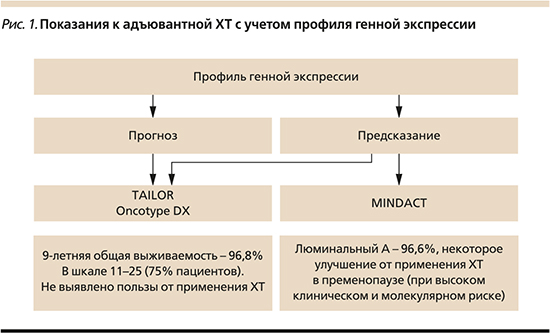
Общее голосование on-line на 12-й конференции EBCC (октябрь 2020 г.) показало, что 75% проголосовавших не поддерживали использование адъювантной ХТ при люминальном А-РМЖ без метастазов в региональных лимфоузлах (N0) и 33 против 67% голосовавших поддерживали дополнительное использование ХТ до адъювантной ЭТ при наличии регионарных метастазов (N+). В рекомендациях ESMO (2019) также предлагается назначение одной ЭТ при раннем люминальном А-РМЖ, за исключением случаев «со значительным распространением опухоли».
Таким образом, с помощью более точного иммуногистохимического определения фенотипа опухоли и при возможности дополнительного использования «генетических сигнатур» (Oncotype DX, Mammaprint, Predict) удается определить пациентов с люминальным А-РМЖ, нуждающихся только в адъювантной ЭТ без использования ХТ. Это важное достижение в деэскалации цитотоксического лечения.
Вместе с тем известно, что у значительного числа пациентов с люминальными (ER+) опухолями возникает рецидив заболевания через 5 и более лет после хирургического вмешательства. Когда и почему наступает резистентность к применяемой ЭТ, назначаемой в адъюванте на 5 и 10 лет? Клинически выявляемое наступление рецидива заболевания (обычно отдаленные метастазы) означает наступление резистентности к проводимой ЭТ. Скорее всего она возникает значительно раньше срока, клинически определяемого с помощью компьютерной (КТ), магнитно-резонансной томографии (МРТ), ультразвукового исследования (УЗИ) рецидива, и пациенты в течение нескольких месяцев и, возможно, лет получают неэффективную адъювантную терапию, сопровождающуюся побочными токсическими эффектами (остеопороз, тромбоэмболия и др.).
Многие маркеры резистентности уже известны, ко многим из них получены ингибиторы (см. таблицу).

Для маркеров MYC, FOXA 1, CTCF пока нет клинически приемлемых средств, преодолевающих резистентность.
Известно, что циклин-зависимые киназы (CDK 4/6), регулирующие переход клеточного цикла от G1 к S-фазе, фактически контролируют пролиферацию и выживание клеток. Исследовано три препарата: палбоциклиб, абемациклиб, рибоциклиб.
Исследование циклина E (CCNE1) в качестве маркера в исследовании PALOMA-3 отметило более высокие показатели беспрогрессивной выживаемости пациентов, получавших палбоциклиб+фулвестрант только при низком уровне экспрессии циклина E1 [10]. Однако все же рано говорить о том, что найден клинически приемлемый подход и маркер, предсказывающий эффективность ингибиторов CDK 4/6.
Мутация PIK3CA встречается при различных фенотипах РМЖ от 20 до 50% случаев. Однако только в последнее время разработан специфический ингибитор PIK3CA – препарат алпелисиб [11].
Мутация ESR 1 (Era) исходно определяется в 4%, в процессе терапии достигает 20–30%, демонстрируя резистентность к ингибиторам ароматазы и тамоксифену.
В перспективе в условиях адъювантной ЭТ т.н. жидкостная биопсия и исследование плазмы на наличие мутации ESR1 позволят своевременно прервать терапию ингибиторами ароматазы или тамоксифеном с переходом на фазлодекс+ингибиторы CDK 4/6.
Влияние на показатели БРВ (исследование PALLAS и MonarchE)
На 12-й конференции EBCC (2–3 октября 2020 г.) были представлены первые результаты адъювантного применения ингибиторов CDK 4/6 в проекте PALLAS (палбоциклиб+ЭТ против одной ЭТ) [12] и проект MonarchЕ (абемацклиб+ЭТ против одной ЭТ) (рис. 2) [13]. Оба проекта очень схожи. Из предшествовавших клинических испытаний распространенных и метастатических РМЖ видно, что оба препарата близки по эффективности. Однако оказалось, что в исследовании MonarchE получено достоверное улучшение показателя 2-летней безрецидивной выживаемости (БРВ) получавших абемациклиб+ЭТ (р=0,0096), в то время как в исследовании PALLAS добавление к ЭТ палбоциклиба не увеличивало показатели БРВ (негативный результат). Как это может быть, если те же препараты были высокоэффективными при ER+ метастатическом РМЖ?
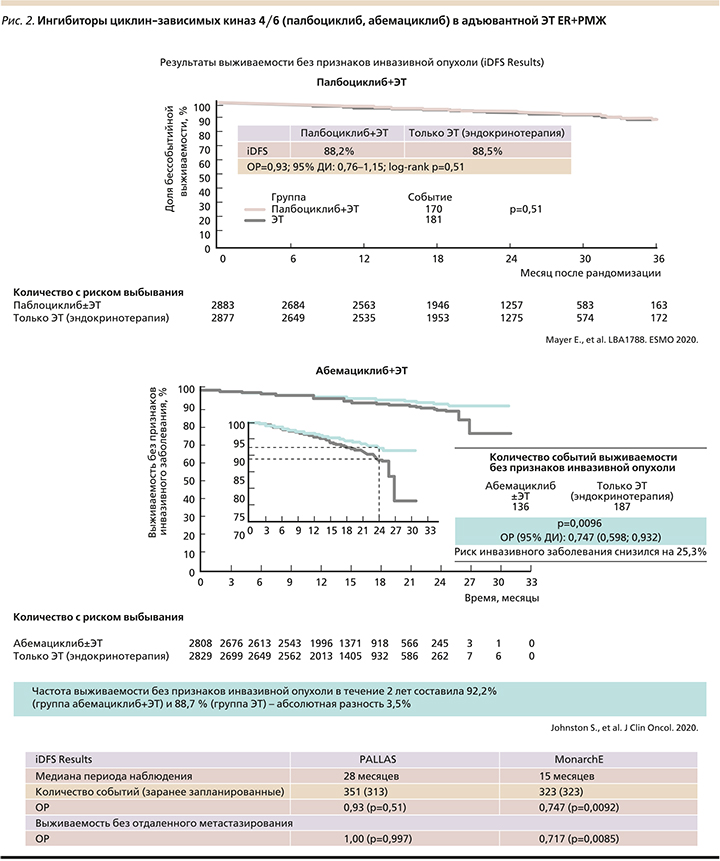
С учетом несомненной эффективности ингибиторов CDK 4/6 при распространенном и метастатическом ER+РМЖ (испытания PALOMA, MONALEESA) негативное сообщение о PALLAS вызвало удивление, особенно после информации о позитивных результатах испытания MonarchE (A. Wolf, 2020). Надо как-то объяснить эти «расходящиеся» результаты сходных по дизайну исследований адъювантного применения ингибиторов CDK 4/6 при ранних (операбельных) ER+ РМЖ.
Конечно, средние сроки наблюдения для раннего РМЖ невелики: 15 месяцев в проекте MonarchE и 28 месяцев в проекте PALLAS. Сейчас выполняется 3-е испытание ингибитора CDK 4/6 (NATALE), продолжительность терапии – 3 года. Кроме того, судя по критериям включения, в испытании MonarchE чаще включались пациенты высокого риска (100%) против 58% в проекте PALLAS. Давно известно, что чем больше риск даже операбельных РМЖ, тем выше абсолютные отличия БРВ.
Пока нет клинически пригодного специфического биомаркера, предсказывающего активность ингибиторов CDK 4/6.
Почти завершенное исследование PENELOPE-B фокусируется в специфической группе пациентов с HR+/HER2- РМЖ с резидуальным заболеванием после неоадъювантной ХТ с последующей рандомизацией на получение в течение года постнеоадъювантного палбоциклиба+гормональная терапия против плацебо+гормональная терапия. Результаты ожидаются в 2021 г.
Оценивая завершенные и планируемые исследования эффективности ингибиторов CDK 4/6, следует обсудить два подхода к оценке результатов: краткосрочный (несколько месяцев в условиях неоадъювантного клинического испытания) и отсроченного (многолетнего) наблюдения с оценкой БРВ и общей выживаемости (ОВ).
Уже проведенное неаодъювантное испытание ALTERNATE при HR+ РМЖ фактически адресовано деэскалации ХТ с использованием именно показателей выживаемости как первичной цели исследования.
Многие квалифицируют ингибиторы CDK 4/6 как форму «мягкой» оральной ХТ. По мнению Prat (2020), неоадъювантные стратегии позволяют редуцировать или даже устранять «классическую» ХТ [15].
NATALE – третье адъюватное испытание ингибиторов CDK 4/6, тестирующее более продолжительную (3 года) терапию рибоциклибом. Уже включены 4000 пациентов с промежуточным риском, сравнимым с проектом PALLAS и MonarchE.
Большинство событий в испытании MonarchE проявлялись отдаленными метастазами в кости и печень с явным снижением их частоты у получавших абемациклиб. При включении в испытание большинство пациентов не подвергались углубленной лучевой диагностике (КТ, МРТ). Поэтому, возможно, часть пациентов могли иметь асимптомное субклиническое системное заболевание до начала адъювантной терапии. Уже известно, что ингибиторы CDK 4/6 более эффективны в 1-й линии терапии РМЖ.
«Куда двинется клиническая онкология сейчас?» – спрашивает A.C. Wolf (2020). [14]. Явно позитивное клиническое испытание MonarchE свидетельствует о потенциально новой роли ингибиторов CDK 4/6 в лечении пациентов с ранним (операбельным) РМЖ с промежуточным и высоким риском рецидива заболевания. Однако еще рано давать определенные рекомендации. Необходимо понять долгосрочный «вклад» адъювантного использования ингибиторов CDK 4/6 в этом приложении. Биология ранних рецидивов (в первые 2 года, как в MonarchE) может отличаться от поздних рецидивов. Необходим более продолжительный период наблюдения, чтобы подтвердить сохраняющуюся клиническую пользу такого лечения. Тогда будет возможным утвердить новый стандарт применения ингибиторов CDK 4/6 в адъювантной терапии раннего HR-позитивного РМЖ.
Интерес к PIK3CA-мутации недавно увеличился из-за публикации исследования SOLAR1, в котором было продемонстрировано клинически значимое улучшение выживаемости без прогрессирования при применении α-селективного ингибитора PI3K. Алпелисиб, специфический ингибитор продукта PIK3CA, PI3Ka, был недавно одобрен FDA (Food and Drug Administration) в комбинации с фулвестрантом для лечения ER+метастатического РМЖ, содержащего мутации PIK3CA [11].
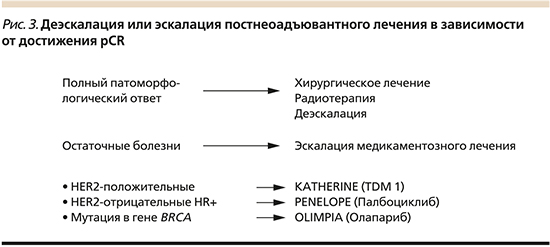
При обсуждении практической пригодности различных прогностических и предиктивных маркеров само достижение патоморфологического полного регресса (pCR) с помощью НСТ рассматривается как один из маркеров чувствительности к специфической терапии (рис. 3). А при наличии остаточной опухоли (резидуального заболевания) рекомендуется лечение с учетом его фенотипа, т.к. он меняется в 20–25% случаев [3, 4].
Анти-HER2-таргетная терапия в сочетании с ХТ служит важным компонентом нео/адъювантного лечения при HER2- позитивном РМЖ. Панель St. Gallen (2019) решительно поддержала использование НСТ в качестве предпочтительного лечебного подхода к 2-й или 3-й стадии HER2- позитивного РМЖ по тем же причинам, что и при ТНРМЖ, т.е. для увеличения шансов проведения органосохраняющего хирургического лечения и получения прогностической информации, а также для адаптации терапии в зависимости от степени остаточного заболевания. Большинство экспертов одобрили ХТ на основе комбинации антрациклинов-алкилирующих агентов и таксанов в сочетании с таргетным лечением на основе трастузумаба и пертузумаба в качестве предпочтительного подхода при 2-й или 3-й стадии HER2-позитивного РМЖ в адъювантном или неоадъювантном режимах [2]. Многие участники дискуссии предпочитают назначать неантрациклиновые схемы, такие как доцетаксел/карбоплатин/трастузумаб/пертузумаб. Некоторые эксперты St. Gallen (2019) выступили за включение пертузумаба даже при 1-й клинической стадии для неоадъювантной терапии HER2-позитивного, ER-отрицательного РМЖ.
У женщин с остаточным инвазивным HER2- позитивным РМЖ после НСТ использование адъювантной терапии трастузумаб-эмтанзином (TD-M) значительно снизило риск рецидива: абсолютный эффект от 8 до 12% [15]. Панель St. Gallen (2019) полагает, что при достижении полного патоморфологического ответа (pCR) на анти-HER2-таргетную терапию не требуется добавления трастузумаба-эмтанзина. В адъювантной терапии эти пациенты должны получать трастузумаб или трастузумаб плюс пертузумаб, как это первоначально предлагалось в их начальной схеме неоадъювантного лечения.
ТНРМЖ, встречающийся относительно редко (15–18%), остается наиболее сложным и трудноподдающимся лечению. В то же время при ранних стадиях ТНРМЖ достижение pCR с помощью антрациклинов, таксанов, платины приводит к неплохим 5-летним результатам, сходным с другим фенотипом [3, 4].
Панель St. Gallen (2019) рекомендовала ХТ на основе антрациклинов, алкилирующих агентов и таксанов в качестве предпочтительного режима для многих женщин с 1-й стадией заболевания и практически для всех женщин с более высокой стадией ТНРМЖ. Большинство участников панели St. Gallen (2019) указали на предпочтительность ХТ на основе таксанов и алкилирующих агентов без антрациклинов при стадии T1b (≤1 см) N0 ТНРМЖ. Участники дискуссии решили, что в каждом конкретном случае врач решает: следует ли назначать адъювантную ХТ при опухолях T1a (≤0,5 см) N0?
В нескольких клинических испытаниях изучалось: улучшает ли исходная ХТ на основе платины результаты при ТНРМЖ (2018)? Исследования НСТ последовательно показывают, что добавление ХТ на основе платины улучшают частоту полного патоморфологического ответа при ТНРМЖ, хотя влияние на долговременное рецидивирование заболевания остается менее определенным, особенно если в лечение уже включен другой алкилирующий агент (т.е. циклофосфамид) [16].
Панель St. Gallen (2019) проголосовала против рутинного включения платины в отношении женщин с уже назначенными режимами ХТ алкилирующими препаратами, таксанами и на основе антрациклинов. Панель высказалась за включение ХТ платиной среди женщин с часто встречающимися мутациями BRCA1/2, хотя это мнение не было единогласным.
Пациенты с ТНРМЖ, имеющие остаточный (резидуальный) инвазивный рак после НСТ, характеризуются более высоким риском рецидива заболевания. Данные из единственного рандомизированного испытания (CREATE-X) [17] свидетельствуют о том, что такие пациенты получают выгоду от добавления адъювантной терапии капецитабином, хотя в традиционных адъювантных исследованиях капецитабин не продемонстрировал улучшения результатов, наблюдаемых при стандартных режимах ХТ (GEICAM) [18]. Все же панель рекомендовала пациентам с остаточным инвазивным раком, особенно с поражением лимфоузлов и/или более чем 1 см остаточной опухоли в молочной железе, получать адъювантно капецитабин после завершения неоадъювантной ХТ на основе таксанов, антрациклинов и алкилирующих агентов.
При ТНРМЖ и при HER2+ РМЖ основные ожидания связываются с прогрессом иммунологических подходов и проведением эффективной иммунотерапии. Высокая мутационная нагрузка в опухоли является важным предиктором ответа на иммунотерапию при ТНРМЖ, что может быть объяснено тем фактом, что опухоли, содержащие больше мутаций, экспрессируют больше абберантных белков, которые могут служить антигенами, распознаваемыми иммунной системой и индуцирующими иммунный ответ [19].
Включение в качестве прогностического биомаркера лимфоцитарной инфильтрации опухоли представляется ключевым шагом в понимании биологии ТНРМЖ и HER2- позитивного РМЖ [20]. Количественная патоморфологическая оценка TILs привносит больше прогностической информации, чем степень злокачественности (G) при HER2+ и ТНРМЖ (рис. 4) [20].
Высокие результаты были описаны в исследовании 131 пациента с TНРМЖ, проведенном Miyashita et al. [21], которые оценивали соотношение CD8/FOXP3 на исходном уровне и в резидуальной опухоли. Показатель 5-летней БРВ составил 72% у пациентов с высоким соотношением CD8/FOXP3 по сравнению с 40% в группе пациентов с низким соотношением CD8/FOXP3 (p=0,009). Эти результаты показывают роль иммунной активации в опухолевой строме как прогностического фактора, а также как потенциальной терапевтической мишени для изучения [22–25].
ХТ модулирует опухолевое микроокружение путем изменения состава стромальных иммунных клеток. После неоадъювантной ХТ наблюдается уменьшение Т-регуляторных (СD4) и увеличение Т-цитотоксических (CD8) клеток в тканях и образцах крови, что свидетельствует об иммуномодулирующем лечении [1].
Патогенетический путь через экспрессию PD1 и лиганда PDL1 служит главным регулятором иммунного ответа на растущую опухоль. В последние годы были разработаны моноклональные антитела, блокирующие иммунные «чекпоинт-белки». При РМЖ наиболее исследован препарат атезолизумаб (анти-PDL1-антитело) [26, 27].
В исследовании Impassion 130 (рис. 5) использование атезолизумаба (ингибитора лиганда PDL1) в комбинации с наб-паклитакселом при метастатическом ТНРМЖ увеличило показатели 2-летней беспрогрессивной выживаемости (в группе с позитивным PDL1) [28].
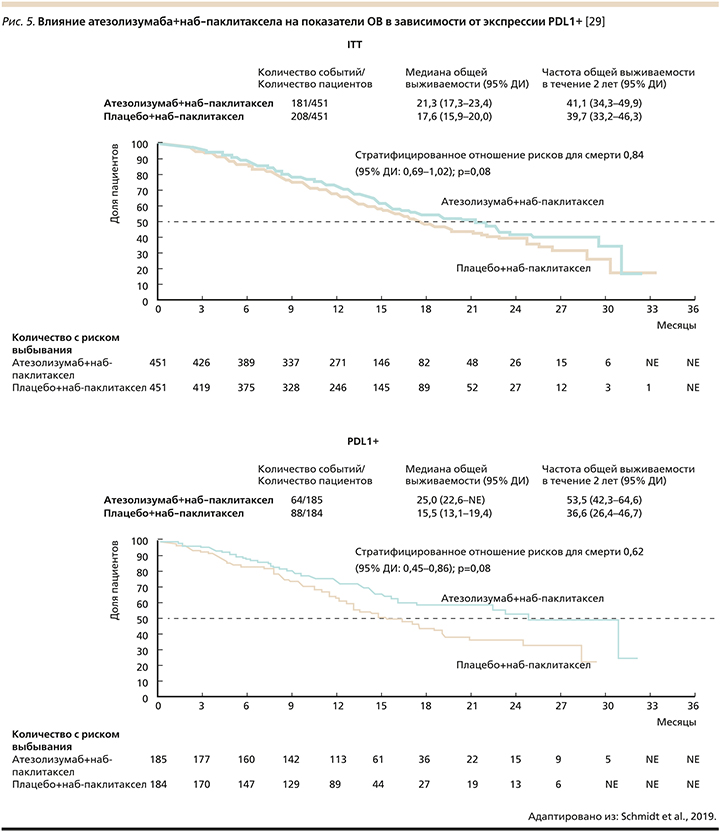
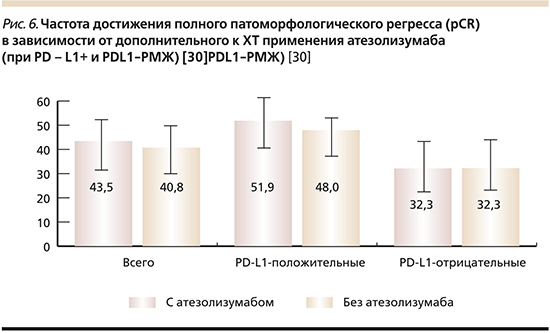
В исследовании 3-й фазы NeoTrip [30] при первом анализе статической значимой зависимости достижения pCR от добавления атезолизумаба не было выявлено во всей группе (рис. 6). При этом частота pCR была выше у пациентов с позитивным PDL1+ (р<0,0001). Ожидается оценка беспрогрессивной (бессобытийной) выживаемости. В более поздней оценке испытания NeoTrip PD-L1, представленной на ESMO-2020 доктором G. Bianchini, было показано, что комбинация атезолизумаба, карбоплатина и наб-паклитаксела увеличивает достижение патоморфологического полного ответа (pCR) более чем на 10% по сравнению с одной неоадъювантной ХТ [31].
Выводы
Эксперты ESMO (2020) и St. Gallen (2019) рекомендуют, чтобы большинство пациентов с ТНРМЖ и HER2+ РМЖ с опухолями более 2 см (Т2 и более) получали сначала НСТ, чтобы изначально понять их «базисную биологию» (чувствительность или резистентность к терапии). Степень клинического и патоморфологического ответа опухоли на предоперационную (неоадювантную) системную терапию рассматривается как своего рода предиктивный маркер.
Ожидается, что дополнительные биомаркеры, такие как циркулирующие внеклеточные ДНК (cell-free DNA) и иммунная Т-лимфоцитарная инфильтрация резидуальной опухоли, позволят усовершенствовать конечную целевую точку исследований.
Необходимо усовершенствовать диагностическую точность и чувствительность изобразительных (imaging) лучевых методов определения ответа на проводимую системную терапию и корреляцию их со степенью патоморфологического ответа, вплоть до pCR.
Исследования с ксенотрансплантатами демонстрируют, что мутационный профиль опухоли и паттерны экспрессии генов очень схожи между исходными опухолями и резидуальным заболеванием. Кроме того, существует высокая степень соответствия между ответами на лечение, наблюдаемыми у пациентов, и их соответствующими моделями ксенотрансплантата.
Появление новых технологий, таких как секвенирование ДНК, профили экспрессии генов, ctDNA и ксенотрансплантаты, полученные от пациентов, улучшило понимание биологии опухоли, путей, вовлеченных в прогрессирование опухоли, и механизмов устойчивости к лекарственным средствам.



