Рак молочной железы
Финальный анализ выживаемости в исследовании CLEOPATRA
В исследовании CLEOPATRA 808 пациентов с HER2-позитивным метастатическим местно-рецидивирующим или нерезектабельным раком молочной железы (РМЖ) получали лечение пертузумаб/трастузумаб/доцетакселом (П/Т/Д) или плацебо вместо пертузумаба. При отборе больных в плане предшествующего лечения допускались нео/адъювантная терапии не ранее, чем за 12 месяцев до прогрессирования болезни; и I линия гормонотерапии по поводу метастатического рака молочной железы (мРМЖ). Надо отметить, что ранее 48 пациентов группы плацебо перешли в группу терапии пертузумабом в связи с ранее полученными данными о его влиянии на результаты лечения. Медиана наблюдения пациентов составила 50 месяцев, медиана общей выживаемости (ОВ) – 40,8 месяца в группе плацебо по сравнению с 56,5 – в группе пертузумаба. Различие в длительности ОВ было статистически достоверным, достигнув 15,7 месяца (HR=0,68; 95% CI – 0,56–0.84; p=0,0002). Медиана выживаемости без прогрессирования (ВБП) оказалась также лучше в группе П/Т/Д (18,7 против 12,4 месяца) (ОР – 0,68; р<0,0001) [1].
Профиль безопасности режима П/Т/Д в общей популяции пациентов, а также для пациентов, перешедших в группу терапии пертузумабом, не выявил противоречий с ранее известным профилем безопасности пертузумаба. Профиль кардиологической безопасности в долгосрочной перспективе не изменялся [1]. Таким образом, было показано несомненное преимущество комбинации П/Т/Д перед таковой трастузумаба и доцетаксела по параметрам ОВ и ВБП при лечении РМЖ.
Эффективность и безопасность продолжения поддерживающей терапии с бевацизумабом или бевацизумабом/капецитабином после первой линии химиотерапии доцетакселом/бевацизумабом при HER-негативном метастатическом раке молочной железы в исследовании IMELDA
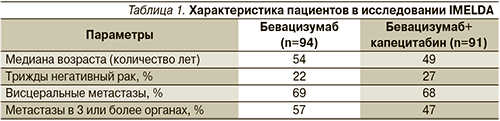
В открытое рандомизированное исследование III фазы (IMELDA) включили пациентов с HER2-негативным измеряемым мРМЖ с общим статусом по шкале ECOG<2, ранее не получавших химиотерапию. За период с июня 2009 по март 2011 г. 284 пациента были включены в исследование, 185 распределены в группы поддерживающей терапии. Лечение пациентов начали с терапии бевацизумабом/доцетакселом, после 3–6 курсов при условии отсутствия прогрессирования болезни больных распределили в группы продолжения лечения бевацизумабом или бевацизумабом/капецитабином. Поддерживающая терапия продолжалась до прогрессирования заболевания. Стратификация проведена по следующим факторам: ответ на лечение, наличие висцеральных метастазов, статус рецепторов эстрогена, уровень лактатдегидрогеназы.
В табл. 1 представлены характеристики пациентов. Медиана возраста в группе бевацизумаба составила 54 года, в группе бевацизумаб/капецитабин – 49 лет. Трижды негативный РМЖ был выявлен у 22% пациентов, включенных в группу бевацизумаба, и у 27% пациентов в группе бевацизумаб/капецитабин. Процент пациентов с висцеральными метастазами в обеих группах был одинаковым (69 против 68%), но в группе бевацизумаба больные с ≥3 пораженными метастазами органами составили 57%, тогда как в группе бевацизумаб/капецитабин только 47% [2].
Исследование показало, что добавление к поддерживающей терапии бевацизумабом капецитабина статистически значимо влияет на увеличение ВБП с момента рандомизации (11,9 против 4,3 месяца; р<0,001), а также медиану ОВ (39 против 23,3 месяца; р<0,001), несмотря на меньшую, чем планировалось, выборку пациентов (табл. 2). Зарегистрированные нежелательные явления были предсказуемыми и определялись профилем токсичности включенных в исследование препаратов (табл. 3).
Эффективность и безопасность продолжения/возобновления терапии бевацизумабом во II линии при HER-негативном местно рецидивирующем/ метастатическом раке молочной железы
Исследование TANIA
В исследование включили пациентов с местно-рецидивирующим или мРМЖ, HER2-негативным прогрессирующим, после первой линии терапии бевацизумабом в комбинации с цитостатиком (период лечения ≥12 недель). К химиопрепарату второй линии добавили бевацизумаб (15 мг/кг каждые 3 недели или 10 мг/кг каждые 2 недели) или проводили лечение только цитостатиком. При стратификации учитывали режим химиотерапии I линии (с таксанами, без таксанов, винорельбином); ВБП (<6 против ≥6 месяцев); статус гормональных рецепторов; уровень лактатдегидроге-назы.
С января 2011 по апрель 2013 г. в исследование были включены 494 пациента (247 – в группу химиотерапии и 247 – в группу химиотерапии и бевацизумаба). Пациентам, получившим во II линии лечения цитостатик и бевацизумаб, после прогрессирования и в третьей линии лечения сохранили бевацизумаб в комбинации с химиотерапией. В другой группе пациенты получали вторую и третью линии лечения без бевацизумаба (модель исследования не включала перекрестный дизайн). Режим химиотерапии выбирали исследователи (допускались паклитаксел, доцетаксел, наб-паклитаксел, пегилированный липосомальный доксорубицин, непегилированный липосомальный доксорубицин, доксорубицин, эпирубицин, гемцитабин, винорельбин, капецитабин, циклофосфамид), двойные комбинации не допускались.
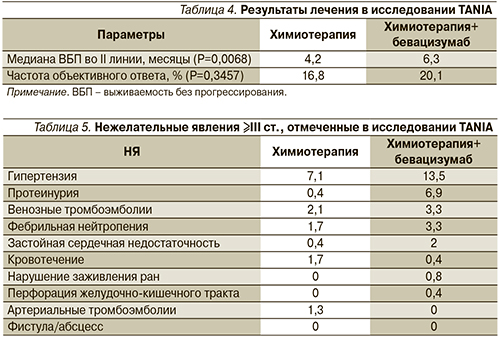
В группах, получавших только химиотерапию и химиотерапию/бевацизумаб медиана возраста была 54 и 56 лет соответственно; трижды негативный РМЖ был в 23 и 20% случаев; в качестве лечения второй линии капецитабин был выбран для 59% больных группы химиотерапии и для 61% группы химиотерапии/бевацизумаба; свободный от болезни интервал ≤12 месяцев для 10 и 7% больных соответственно. Значимой разницы в частоте объективных ответов (16,8 против 20,9%) выявлено не было, но частота достижения стабилизации заболевания оказалась выше в группе химиотерапия/бевацизумаб (48,9%) по сравнению с группой химиотерапии (33,5%). В группе химиотерапии и бевацизумаба медиана ВБП составила 6,3 месяца против 4,2 в группе химиотерапии [3]. Частота побочных эффектов была незначительно выше в группе, получавшей бевацизумаб в комбинации с химиотерапией. Результаты лечения и побочные эффекты представлены в табл. 4, 5.
Несмотря на то что заключительные данные ОВ и ВБП с момента рандомизации до прогрессирования на терапии третьей линии, результаты по безопасности терапии третьей линии ожидаются к середине 2015 г., в настоящее время можно говорить о статистически значимом улучшении ВБП на фоне сохранения терапии бевацизумабом и смене химиопрепарата после прогрессирования болезни при использовании цитостатика и бевацизумаба в первой линии.
Лечение распространенного рака молочной железы палбоциклибом и летрозолом при рецепторпозитивной и HER-негативной опухоли
Палбоциклиб – пероральный селективный ингибитор циклинзависимых киназ (cyclin-dependent kinases – CDK) CDK 4/6.
В исследовании PALOMA-1 достигнуто достоверное увеличение медианы ВБП у пациенток, находящихся в постменопаузе, при лечении местнораспространенного/ метастатического рака молочной железы (ER+, HER2-).
При лечении использовали комбинацию палбоциклиба и летрозола или монотерапию летрозолом. В группе комбинированной терапии медиана ВБП составила 20,2 месяца, в группе монотерапии этот показатель составил 10,2 месяца (ОР: 0,488; p=0,0004). Эти данные были представлены 6 апреля на ежегодной конференции Американской ассоциации исследований рака (AACR) 2014 года, прошедшей в Сан-Диего.
Предклинические данные определили, что клеточная линия рака молочной железы РЭ+ люминального типа, вместе с низким уровнем CDKN2A, и высокими уровнями Rb и CCDN1 наиболее чувствительна к антипролиферативному действию палбоциклиба.
В материале представленном на ESMO 2014 выделены маркеры чувствительности к палбоциклибу и летрозолу и их взаимосвязь с ВБП
Ген ретинобластомы (Rb ген) был открыт первым из антионкогенов и является наиболее известным из них. Мутации гена Rb, приводящие к его инактивации, связаны с развитием ряда опухолей. У пациентов с ретинобластомой мутации гена Rb были найдены в 100% случаев.
У 46 пациентов ER+HER2- ретроспективно методом FISH- анализа были изучены биомаркеры (CDKN2A и CCDN1). У 21 пациентки биомаркеры (БМ) были позитивными и у 25- негативными. У пациенток с позитивными биомаркерами медиана ВБП составила 26,1 месяца в группе комбинированной терапии против 7,5 месяца в группе монотерапии летрозолом. При негативных биомаркерах медиана ВБП увеличивалась до 35,3 месяца при лечении паблоциклибом и летрозолом против 5,7 месяца в группе летрозола.
Во II проспективной части исследования 99 пациентов с ER+HER- с позитивными биомаркерами были пролечены палбоциклибом и летрозолом или только летрозолом. Медиана ВБП в группе комбирированной терапии составила 18,1 месяца против 11.1 месяца в группе летрозола (р=0,0046). У 145 пациентов изучен индекс пролиферации Ki67, не выявлено различий результатах лечения в группах с Ki67 больше 20% по сравнению с группой, где этот показатель равен или меньше 20%. Протеин pRb и циклин D1 были позитивными в более чем 90% образцов изученных опухолей.

Таким образом, комбинация палбоциклиба и летрозола увеличивала ВБП в обеих группах (БМ+ и БМ-) по сравнению с монотерапией летрозолом, но наиболее эффективной эта терапия была в тех случаях, когда биомаркеры были негативными [9].
Наиболее частым побочным эффектом была нейтропения. Нейтропения III/ регистрировалась у 57%, IV степени – у 5% пациентов. Причиной прекращения лечения нейтропения стала у 6% (5) пациентов [8].
Меланома
Использование двух таргетных препаратов (кобиметиниб и вемурафениб) в I линии терапии пациентов с метастатической или местораспространеной меланомой с мутацией гена BRAF
В двойном слепом рандомизированном исследовании BRIM III фазы оценивалась комбинированная терапия вемурафенибом, ингибитором BRAF, и пероральным препаратом кобиметинибом, представляющим собой малую молекулу, ингибитор MEK. Было показано в доклинических исследованиях, одновременное ингибирование MEK и BRAF предотвращает развитие приобретенной резистентности. На фоне блокирования парадоксальной активации сигнального пути MAPK , которое возникает из-за ингибирования RAF) отмечается уменьшение возникновения очагов гиперпролиферации.
За период с января 2013 по январь 2014 г. в исследование были включены 495 пациентов с нерезектабельной местнораспространенной или метастатической меланомой с мутацией BRAF V600, ранее не получавших лечения. После рандомизации все пациенты принимали вемурафениб 960 мг дважды в день 28 дней и 21 день кобиметиниб/плацебо 60 мг один раз в день.
Медиана ВБП, по оценке независимых экспертов, составила 11,3 месяца в группе комбинированной терапии против 6,0 – в группе вемурафениб/плацебо (ОР=0,60; р=0,0003). Частота объективных ответов составила 68% в группе двойной таргетной терапии и 45% в группе монотерапии (р<0,0001). При лечении вемурафениб/кобиметинибом полный ответ достигнут 10% пациентов по сравнению с 4% в контрольной группе. Показатель 9-месячной ОВ составил 81,1 и 72,5% в группах двойной и монотерапии соответственно (ОР=0,65; р=0,046). Зарегистрировано увеличение частоты развития нежелательных явлений ≥3-й степени тяжести при применении комбинированной терапии (65%) по сравнению с терапией вемурафенибом (59%). Чаще развивалась серозная ретинопатия 1-й и 2-й степени, а также снижение фракции выброса 2-й степени тяжести при использовании двух препаратов. В целом безопасность применения вемурафениба и кобиметиниба была сопоставимаой с профилем безопасности в группе монотерапии [4, 5]. В настоящий момент исследование продолжается для полной оценки ОВ.
Исследование coBRIM подтвердило увеличение эффективности комбинированной терапии ингибитором BRAF и ингибитором MEK по сравнению с монотерапией ингибитором BRAF больных меланомой с мутацией BRAFV600. Вероятно, применение ингибиторов BRAF и MEK может стать новым стандартом таргетной терапии меланомы с мутацией BRAFV600.
Дабрафениб и траметиниб по сравнению с монотерапией вемурафенибом больных меланомой с мутацией BRAF. Рандомизированное открытое исследование III фазы COMBI-v
С июня 2012 по октябрь 2013 г. 704 пациента были рандомизированы в исследование в соотношении 1:1 в группу дабрафениба (150 мг дважды в день) в комбинации с траметинибом (2 мг в день) или в группу терапии вемурафенибом (960 мг дважды в день).
В исследование вошли пациенты с нерезектабельной или метастатической меланомой (стадия IIIC или IV) с мутацией BRAF V600/K, ранее не получавшие противоопухолевую терапию.
Медиана ОВ в группе дабрафениба/траметиниба не была достигнута, а для группы вемурафениба составила 17,2 месяца (р=0,002). Подгрупповой анализ данных ОВ также показал преимущество комбинированной терапии. Медиана ВБП в группе дабрафениба и траметиниба составила 11,4 против 7,3 месяца в группе монотерапии (р<0,001). Частота общего ответа была на 13% выше в группе комбинированной терапии (р<0,001). Длительность ответа составила 13,8 месяца в группе дабрафениб/траметиниб и 7,5 – в группе вемурафениба. Модель исследования не включала перекрестный дизайн. Частота нежелательных явлений была сопоставимой в обеих группах и согласовывалась с данными предыдущих исследований. В группе вемурафениба чаще наблюдали артралгию, сыпь, алопецию, гиперкератоз, эффект фотосенсибилизации и папилломы кожи. В группе монотерапии чаще регистрировали события, связанные с ингибированием BRAF: плоскоклеточный рак кожи и кератоакантому, гиперкератоз, папиллому кожи, ладонно-подошвенный синдром, алопецию, фотосенсибилизацию и солнечные ожоги, недерматологические злокачественные новообразования. Лихорадка 3-й степени тяжести наиболее часто регистрировалась в группе дабрафениб/траметиниб.
Применение в первой линии комбинации препаратов дабрафениб и траметиниб улучшает ОВ и ВБП по сравнению с вемурафенибом больным нерезектабельной или метастатической меланомой кожи с мутацией BRAF V600E/K. С ингибированием BRAF связано возникновение резистентности опухоли и развитие плоскоклеточного рака кожи. Одновременное ингибирование BRAF и MEK уменьшает эти эффекты.
В исследовании I/II фаз, сравнившем комбинацию дабрафениб/траметиниб и терапию дабрафенибом, а также в исследовании III фазы, комбинации дабрафениб/траметиниб по сравнению с дабрафенибом, было показано что двойная терапия увеличивала частоту общих ответов, ВБП и снижала частоту развития плоскоклеточного рака кожи [6].
Рак щитовидной железы
Ленватиниб в лечении рефрактерного к радиоактивному йоду рака щитовидной железы
SELECT-многоцентровое двойное слепое плацебо-контролируемое исследование ленвантиниба при рефрактерном к радиактивному йоду дифференцированном раке щитовидной железы. Ленватиниб-мультикиназный пероральный ингибитор VEGFR1-3, FGFR1-4, PDGFRα, RET и KIT. Пациенты были рандомизированы по принципу 2:1, принимали ленватиниб в дозе 24 мг в день, 28 дней. Положительный эффект ленватиниба был достигнут как в общей популяции: увеличение медианы ВБП на 14,7 месяца по сравнению с плацебо (р<0,0001), так и во всех выделенных подгруппах. Среди всех выделенных подгрупп при фолликулярном раке щитовидной железы медиана ВБП в настоящее время не достигнута против 16,4 месяца при папиллярном раке. Также при уровне тиреотропного гормона ≤0,5 мкЕД/мл медиана ВБП составила 18,7 месяца по сравнению с медианой ВБП при уровне тиреотропного гормона > 0,5–2,0 мкЕД/мл – 15,1 месяца.
Пациенты с быстрым прогрессированием до рандомизации (≤3 месяцев) имели более высокий показатель ВБП (18,7 месяца) по сравнению с медленно прогрессирующими пациентами – 16,6 месяца. Пациенты с вовлечением в процесс почек или печени имели худшие показатели ВБП – 12,8 и 11,0 месяцев против ВБП пациентов без поражения – 20,2 и 18,7 месяца [7]. Гипертензия, развивающаяся при лечении ленватинибом, может оказаться фактором прогноза эффективности лечения. Данные, полученные в исследовании ленватиниба фазы II на пациентах со всеми подтипами распространенного рака щитовидной железы (дифференцированного, медуллярного и анапластического), демонстрируют многообещающую активность препарата при всех типах распространенного рака щитовидной железы. Профиль нежелательных явлений в целом был близок к данным, полученным в предыдущих клинических исследованиях.
Другой анализ, представленный на конгрессе, характеризовал изменения размера опухоли при лечении ленватинибом пациентов с дифференцированным раком щитовидной железы, резистентным к терапии радиоактивным йодом. У пациентов, принимавших ленватиниб в течение года или более, наблюдалось быстрое сокращение размера опухоли в первые восемь недель с последующим постоянным, более медленным уменьшением размеров опухоли.
Исследование препарата MPDL3280A в лечении уротелиального рака мочевого пузыря
Препарат MPDL3280A – моноклональное антитело к рецептору белка PD-1.
MPDL3280A предназначен для целенаправленного воздействия на PD-L1, экспрессирующийся на опухолевых клетках, и на инфильтрирующих опухоль иммунных клетках, предотвращая их связывание с PD-1 и B7.1 на поверхности Т-клеток. Путем подавления PD-L1, MPDL3280A способен активировать Т-клетки, восстанавливая их способность эффективно обнаруживать и атаковать клетки опухоли.
Результаты лечения уротелиального рака мочевого пузыря препаратом MPDL3280A были озвучены на конференции ASCO в 2014 году, но также представлены и на ESMO 2014.
Лечение новым препаратом получили 68 больных метастическим уротелиальным раком мочевого пузыря. Из них у 30 пациентов при исследовании опухоли методом иммуногистохимии была выявлена экспрессия PD-L1.
В общей группе 72% больных ранее уже получили 2 или более линии химиотерапии. У 75% пациентов были висцеральные метастазы и у 33%-метастазы в печень.
Среди пациентов с опухолью экспрессирующей рецепторы объективный ответ на лечение был достигнут в 43%. Медиана длительности эффекта не достигнута. В случаях когда рецептор не экспрессировался ответили на лечение 11% больных [10].
Наиболее частыми побочными эффектами были снижение аппетита, слабость, тошнота. Побочные эффекты развились у 57% пациентов.
Первая фаза исследования препарата при метастатическом почечноклеточном раке показала хорошую переносимость и эффективность лечения.
MPDL3280A продолжает изучаться при меланоме, колоректальном раке, раке почки, немелкоклеточном раке легкого
При лечении немелкоклеточного рака легкого эффективность анти -PD-L-1 терапии корелировала с экспрессией PD-L-1 в иммунных клетках, инфильтрирующих опухоль (р=0,02), но не коррелировала с экспрессией рецепторов в опухолевых клетках [11].


