Введение
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируются по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей. Гетерогенность БА проявляется различными фенотипами заболевания, многие из которых возможно выделить в обычной клинической практике [1].
В клинической практике врача больные БА составляют значительную часть. Современное здравоохранение рассматривает БА, в частности тяжелую бронхиальную астму (ТБА), как глобальную проблему здравоохранения, охватившую весь мир.
В мире насчитывают около 300 млн человек, страдающих астмой, что составляет 5% населения планеты. Люди всех возрастов во всем мире страдают этим хроническим заболеванием дыхательных путей, которое при недостаточно эффективном лечении может значительно ограничивать повседневную жизнь пациентов и даже приводить к смерти [2].
Определено, что бронхиальная астма – многофакторное заболевание, на тяжесть течения которого влияют климат, расовая принадлежность, генетика, уровень развития общества, а также сопутствующая патология [2]. К ТБА относят пациентов, у которых контроль не достигается при использовании максимально высоких доз рекомендованных препаратов (рефрактерная астма, стероид-резистентная астма), а также больных, у которых контроль астмы достижим только при использовании максимальных доз лекарственных препаратов, включая системные глюкокортикостероиды (СГКС) [3].
Характеристика ТБА
Диагностика тяжелой терапевтически резистентной астмы требует тщательного уточнения и подтверждения диагноза, определения эндотипической и фенотипической характеристики заболевания и решения вопроса о назначении таргетной биологической терапии.
В зависимости от иммунологической характеристики воспаления выделяются Т2-эндотип и неТ2-эндотип [4].
- Т2-эндотип БА, реализуемый за счет преобладания Th2-ответа (аллергическая астма) или высокой активности врожденных лимфоидных клеток 2-го типа ILC – «innate lymphoid cells» (неаллергический и аллергический варианты БА) и проявляющиеся преимущественно эозинофильным воспалением. Т2-воспаление связано с высокими уровнями интерлейкина-5 (ИЛ-5) и ИЛ-13.
- НеТ2-эндотип БА, реализуемый, вероятно, через Тh1- и Th17-клетки и ассоциированный с преимущественно нейтрофильным воспалением в слизистой оболочке бронха. Характеристика фенотипов и эндотипов БА представлена в табл. 1 [2].
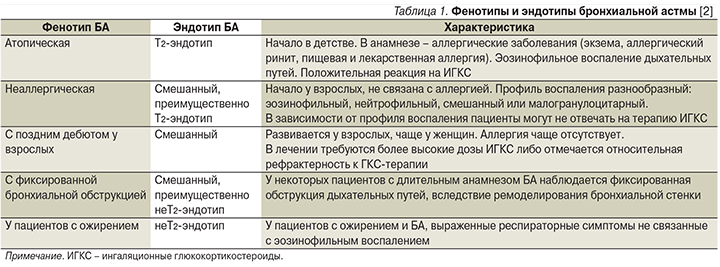
Фенотипы и эндотипы БА у одного и того же больного могут меняться. Неблагоприятная динамика заболевания чаще наблюдается у больных неаллергическим фенотипом БА под влиянием факторов окружающей среды, аллергенов, сезонных влияний, экологических факторов, инфекции органов дыхания, терапии ИГКС [5].
В табл. 2 дана клинико-иммунологическая характеристика фенотипов БА и особенно терапии [6].
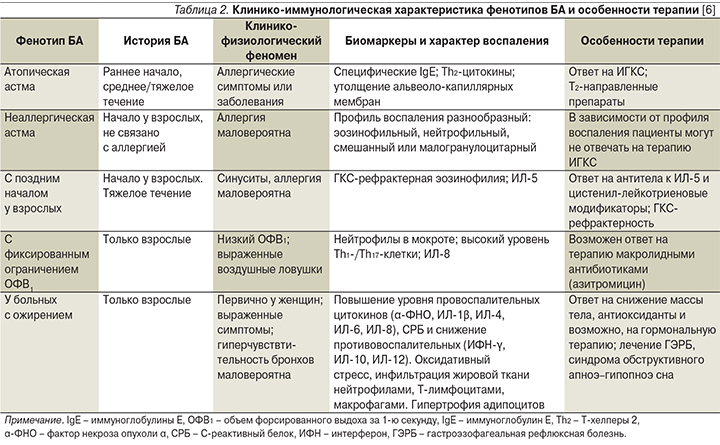
Определение фенотипа БА в клинической практике помогает врачу определять тактику ведения пациента, подбора дозировки ИГКС, прогнозировать эффективность лечения, а также проведения профилактических мероприятий.
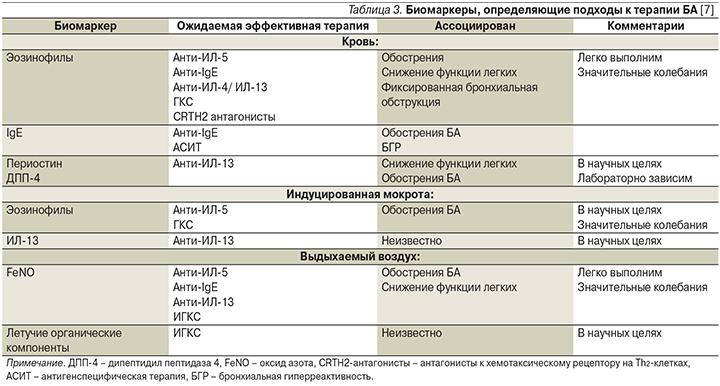
Современные подходы к классификации БА основаны на выявлении специфических биомаркеров, лежащих в основе изменений бронхиального дерева. Биомаркеры, определяющие подходы к терапии БА, представлены в табл. 3 [7].
Эозинофилы индуцированной мокроты. Эозинофилы являются ключевыми игроками в клеточной кооперации бронхиального воспалительного иммунного ответа при T2-эндотипе БА. Как при аллергической, так и при неаллергической форме эозинофильного фенотипа астмы уровни эозинофилов в мокроте могут быть повышены и варьируются от 1 до 50%, что также сопровождается эозинофилией тканей и крови [8]. Уровень эозинофилов в индуцированной мокроте ≥2–3% у взрослых пациентов с БА позволяет диагностировать эозинофильную астму (более надежен уровень эозинофилии мокроты ≥3%) [9]. Анализ мокроты, характеризующийся чувствительностью >80% и специфичностью 95%, считается наиболее надежным способом определения эозинофильного воспаления при БА [10]. Однако в ряде случаев получение мокроты крайне затруднительно для больных БА, в связи с этим проводится поиск других потенциальных биомаркеров, характеризующихся достоверно высокой корреляцией с бронхиальной эозинофилией. В качестве одного из таких суррогатных биомаркеров в настоящее время рассматривается уровень эозинофилов периферической крови.
Эозинофилы периферической крови. Определение абсолютного числа эозинофилов в периферической крови может быть использовано в качестве прогностического биомаркера [11]. Рост числа эозинофилов в периферической крови коррелирует со степенью тяжести БА и обратно пропорционален ОФВ1 [12].
Высокие показатели числа эозинофилов в крови связаны с повышенной частотой обострений, а также распространенностью (% пациентов) будущих обострений, начиная с порогового значения ≥300 кл/мкл. Наиболее сильной эта связь была при пороговом значении числа эозинофилов в крови ≥400 кл/мкл [13].
Уровень эозинофилов крови 400–450 кл/мкл и более (по результатам ≥2 исследований) представляет собой достоверный биомаркер, позволяющий спрогнозировать наличие эозинофилии мокроты и значимый положительный эффект от назначения ряда таргетных биологических молекул, например анти-ИЛ-5-препаратов.
Установлено, что повышенные уровни эозинофилов крови служат фактором риска смертельных исходов при БА. Так, больные с повышением уровня эозинофилов в крови в 4,3 раза больше подвержены риску смерти по сравнению с пациентами с нормальным содержанием эозинофилов крови [14].
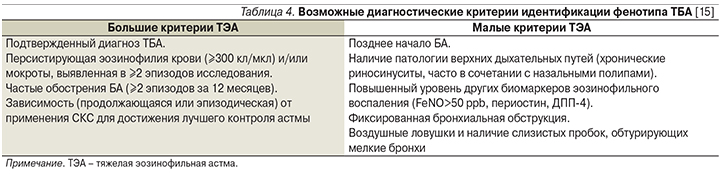
Возможные диагностические критерии идентификации фенотипа тяжелой эозинофильной астмы (ТЭА) отражены в табл. 4 [15].
Оксид азота выдыхаемого воздуха. Уровень фракционного оксида азота выдыхаемого воздуха (FeNO) также может быть рассмотрен в качестве потенциального суррогатного биомаркера для характеристики выраженности эозинофильного воспаления в дыхательных путей при T2-эндотипе БА. На основании многочисленных исследований в настоящее время выявлены общие закономерности изменения уровня FeNO при различных патологических состояниях бронхолегочной системы. Доказано, что выдыхаемый оксид азота, продуцируемый в дыхательных путях активными воспалительными клетками – эозинофилами и нейтрофилами, является одним из маркеров аллергического воспаления дыхательных путей, позволяет дифференцировать характер поражения и оценить эффект от назначаемой для предупреждения обострений терапии. К преимуществам методики определения уровня FeNO относятся неинвазивный забор материала, быстрота исполнения, безопасность, высокие воспроизводимость и специфичность, а также отсутствие возрастных ограничений, что позволяет рекомендовать его для широкого внедрения в клиническую практику [16–18]. Эозинофилия мокроты часто прямо коррелирует с содержанием оксида азота в выдыхаемом воздухе у больных БА. В то же время следует помнить о высокой вариабельности показателя FeNO и зависимости его значения от многих факторов, включая курение и терапию ГКС.
Периостин и дипептидилпептидаза 4 (ДПП-4). ИЛ-13 влияет на различные клетки, в т.ч. эпителиальные, стимулируя их к секреции матриксных протеинов, одним из которых является периостин. Периостин является секретируемым матрицеллюлярным белком, связанным с фиброзом, и его экспрессия активируется с помощью рекомбинантных ИЛ-4 и -13 в культивируемых эпителиальных клетках бронхиального дерева и фибробластах бронхов [19]. В ряде исследований пациенты с плохо контролируемой БА, имеющие высокий уровень периостина в плазме крови до начала терапии, проявляли значимо больший эффект в ответ на анти-ИЛ-13-препарат лебрикизумаб, что позволяет предположить значение периостина в качестве биомаркера для определения популяции больных, для которых эффективность лечения антителами против ИЛ-13 будет наиболее эффективной [20, 21].
ДПП-4 – еще один матриксный белок, синтез которого эпителиальными клетками также регулируется при участии ИЛ-13. ДПП-4 рассматривают как потенциальный биомаркер для выбора таргетной анти-ИЛ-13-терапии больных тяжелой БА.
В многоцентровом исследовании фазы 2b при участии 452 взрослых больных БА, перенесших 2–6 обострений за 12 месяцев продемонстрировано, что тралокинумаб улучшал ОФВ1 у пациентов, которые отличались повышенным уровнем периостина и ДПП-4, в отличие от больных астмой, у которых уровни этих биомаркеров оказались нормальными. Тралокинумаб также уменьшал частоту обострений у пациентов с повышенным уровнем периостина [22].
Выдыхаемый угарный газ. Неинва-зивная оценка воспаления дыхательных путей потенциально полезна при лечении БА. В некоторых исследованиях сообщалось, что содержание выдыхаемого монооксида углерода (CO) значительно увеличивается у астматиков, не получавших ГКС [18, 23]. CO в организме в основном происходит из-за деградации гемоглобина ферментом гемоксигеназа (Hemoxigenaza – HO) [24]. Было обнаружено, что экспрессия индуцибельной изоформы HO-1 повышается в альвеолярных макрофагах у астматиков в связи с увеличением выдыхаемого CO. Эти данные свидетельствуют о том, что CO может быть кандидатом неинвазивного биомаркера воспаления дыхательных путей. В мета-анализе J. Zhang et al. показано, что у пациентов с БА определялся значительно более высокий уровень CO по сравнению со здоровыми субъектами [24]. Установлено, что у пациентов с БА, получавших СГКС и/или ИГКС, были более низкие уровни CO по сравнению с больными БА, не лечившимися ГКС (0,79 промилле против 1,39; p>0,05) [24]. Сравнительная оценка концентрации СО в выдыхаемом воздухе показала значительно более высокое содержание угарного газа у больных БА независимо от уровня контроля по сравнению со здоровыми субъектами. В цитируемом мета-анализе, основанном на 18 исследованиях 632 астматиков и 734 здоровых субъектов, показано, что концентрация CO в выдыхаемом воздухе повышается как у взрослых, так и у детей с БА независимо от лечения ГКС, тяжести заболевания или уровня контроля астмы [24]. В то же время повышенные уровни выдыхаемого СО наблюдались при обострении астмы и уменьшались после лечения СГКС [25].
Помимо БА при других заболеваниях, таких как аллергический ринит, бронхоэктатическая болезнь, инфекции нижних и верхних дыхательных путей, интерстициальные заболевания легких и муковисцидоз, также определялось увеличение концентрации СО в выдыхаемом воздухе [18, 24]. Установлено, что уровень CO повышен у пациентов с бессимптомной атопией. Эти данные свидетельствуют о том, что повышенный уровень СО может быть одним из индикаторов воспаления дыхательных путей.
Вопросы базисной терапии ТБА
Современное лечение БА основано на максимальной элиминации провоцирующих факторов и прерывании каскада воспалительных реакций с помощью фармакологических средств. В настоящее время в основе терапии БА легкоперсистирующего и среднего течения препаратами выбора являются ИГКС и ИГКС в сочетании с длительнодействующими β2-агонистами (ДДБА) [1, 2]. В качестве терапии второй линии используются М-холинолитики длительного действия, теофиллины, антилейкотриеновые препараты, СГКС, а также новые генно-инженерные препараты.
Современное развитие генно-инженерных биотехнологий переводит вопрос о целесообразности биофенотипирования и эндотипирования БА со ступени научной дискуссии на качественно новый уровень с очевидным значением для практической медицины. В ближайшие 5–10 лет ожидается значительное расширение возможностей терапии тяжелой, плохо контролируемой астмы, основанное на внедрении в практику новых иммунобиологических препаратов, предназначенных для таргетной терапии: антитела к IgЕ (омализумаб), анти-ИЛ-5 (реслизумаб, меполизумаб) и анти-ИЛ-5Rα (бенрализумаб), анти-ИЛ-4Rα (дупилумаб) и анти-ИЛ-13 (лебрикизумаб, тралокинумаб). Все эти препараты позволят сделать подход к лечению тяжелой терапевтически резистентной астмы более целенаправленным и эффективным для достижения лучших результатов [26].
К особенностям эффективного применения указанных дорогостоящих биопрепаратов относится необходимость поиска чувствительных и специфичных биомаркеров, позволяющих разрабатывать четкие аргументированные критерии для определения группы больных с наиболее высокой прогнозируемостью положительного ответа на терапию. Биофенотипический подход к выбору препарата таргетной терапии тяжелой БА у взрослых представлен на рисунке [26].
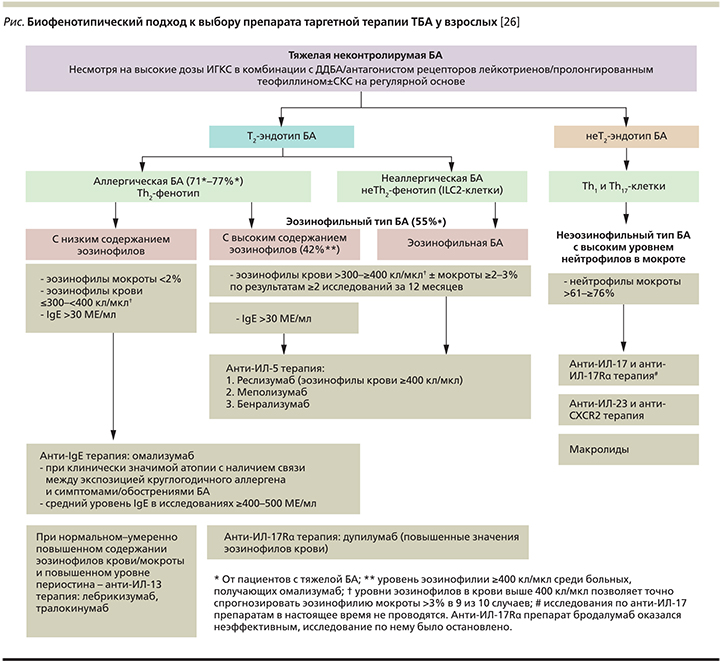
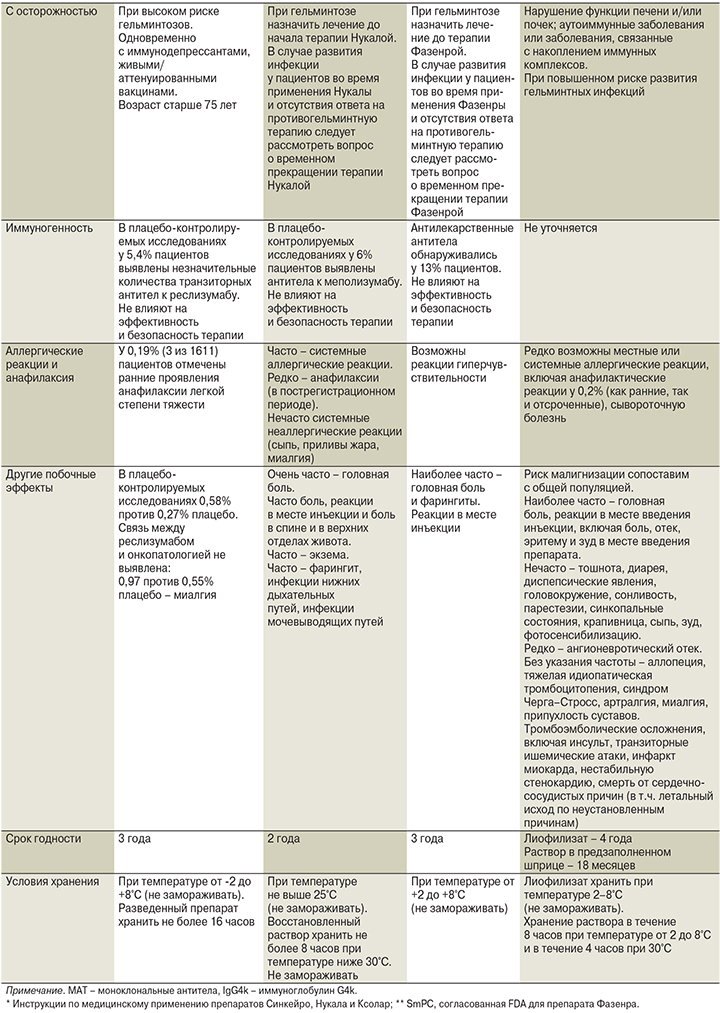
Характеристика моноклональных антител для лечения ТБА дана в табл. 5 в соответствии с инструкцией по медицинскому применению препаратов.
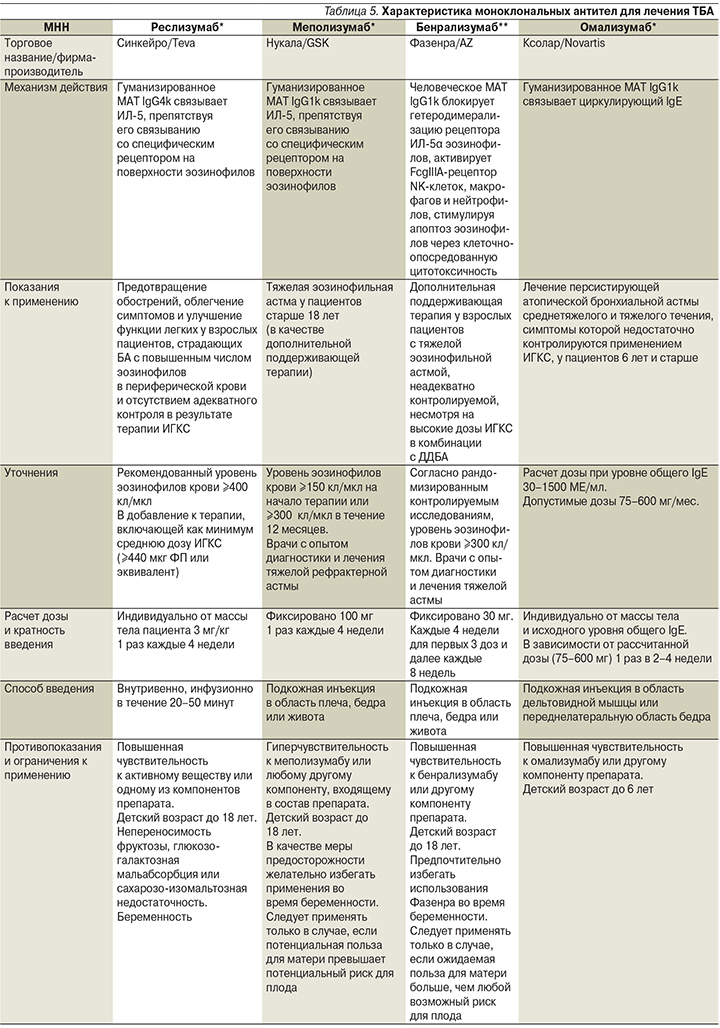
Омализумаб (Ксолар) – рекомбинантные гуманизированные моноклональные антитела к IgE, основу которых составляет молекула IgG1 человека. Препарат связывает циркулирующие в крови IgE, тем самым блокируя аллергический каскад на раннем этапе его развития. При этом наблюдается достоверное уменьшение числа клеток, несущих на своей поверхности рецепторы к IgE (прежде всего базофилов и тучных клеток), снижается число эозинофилов в подслизистом слое бронхов, подавляются реакции ранней и поздней фаз аллергического ответа [27]. Установлено, что у больных атопической БА омализумаб достоверно уменьшает число эозинофилов в биоптатах слизистой оболочки бронхов и индуцированной мокроте, уменьшает число клеток с высокоаффинными рецепторами для IgE [27]. Это первый нестероидный препарат, обладающий выраженным противовоспалительным эффектом. Эффективность омализумаба при тяжелой аллергической БА продемонстрирована в ряде обширных рандомизированных клинических исследований. Во всех исследованиях показано снижение (на 19–58%) частоты тяжелых обострений БА, улучшение качества жизни пациентов, снижение гормональной нагрузки за счет уменьшения дозы ГКС, уменьшение симптомов и потребности в скоропомощных препаратах. Омализумаб, как правило, хорошо переносится, и частота побочных эффектов на омализумаб не отличается от плацебо. Однако в нескольких исследованиях зарегистрирована анафилактическая реакция, развившаяся в ответ на инъекцию омализумаба, что обусловливает необходимость проведения терапии подготовленным персоналом в условиях медицинского учреждения.
Добавление омализумаба к терапии больных тяжелой БА значимо влияет на ряд фармакоэкономических показателей, уменьшая:
- частоту обострений, в т.ч. тяжелых (на 50%);
- число внеплановых визитов к врачу (были у 3% пациентов, получавших омализумаб, по сравнению с 7,4% в контрольной группе);
- число госпитализаций (в одном из исследований в течение года был госпитализирован каждый 8-й пациент, находившийся на терапии омализумабом, по сравнению с каждым 4-м, получавшим традиционное лечение);
- число обращений за экстренной медицинской помощью (0,33 за год у пациентов, получавших омализумаб, по сравнению с 0,62 в контрольной группе).
Меполизумаб (Нукала) представляет собой гуманизированное моноклональное антитело, которое связывает и ингибирует ИЛ-5, первичный цитокин, ответственный за активацию, продукцию и дифференциацию эозинофилов. Доказательства клинической эффективности меполизумаба основывались преимущественно на трех рандомизированных контролируемых исследованиях (DREAM, MENSA и SIRIUS), сравнивавших меполизумаб с плацебо. Соответствующая популяция была определена с точки зрения степени тяжести астмы (четыре или более обострений в предыдущем году и/или зависимость от поддерживающих доз СГКС) и степени эозинофилии (число эозинофилов в крови ≥300 кл/мкл в предыдущий год) [28]. В плацебо-контролируемом исследовании DREAM назначался меполизумаб внутривенно в дозах 75 мг, 250 или 750 мг и в исследовании MENSA в дозе 75 мг внутривенно или 100 мг подкожно [28]. Оценка функции легких определен на 32-й неделе, когда среднее увеличение от исходного уровня ОФВ1 до бронходилатации было на 100 мл больше в группе внутривенного введения меполизумаба, чем в группе плацебо (р=0,02), и на 98 мл больше в группе подкожного введения меполизумаба, чем в группе плацебо (р=0,03). Среднее увеличение относительно исходного уровня ОФВ1 после пробы с бронхолитиком было на 146 мл больше в группе внутривенного введения меполизумаба, чем в группе плацебо (р=0,003), и на 138 мл больше в группе подкожного введения меполизумаба, чем в группе плацебо (р=0,004) [28]. В данных исследованиях были случаи смерти пациентов (3 человека), не связанные с введением препарата и с обострением основного заболевания, и 7–9% побочных эффектов, наиболее частыми из которых были головная боль и назофарингит.
Еще одним значимым показанием к лечению меполизумабом служит наличие полипозного риносинусита, что характерно для тяжелой неконтролируемой астмы, преимущественно с поздним началом. Было проведено рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование 1:1 в шести центрах трех стран (Бельгия, Нидерланды и Великобритания). Возраст пациентов составил от 18 до 70 лет. Данное исследование было направлено на то, чтобы определить, может ли лечение меполизумабом снизить потребность в хирургическом вмешательстве в отношении пациентов с тяжелыми рецидивирующими двусторонними полипами носа, получающими местную терапию ГКС. Исследование продемонстрировало статистически значимое снижение доли пациентов, которые соответствовали критериям, требующим хирургического вмешательства уже через 4 недели после последней дозы меполизумаба по сравнению с группой плацебо. Это подтверждается клинически значимым улучшением симптомов и показателями Sino-Nasal Outcome Test-22 (SNOТ-22) – предиктора постоперационного улучшения у пациентов с хроническим синуситом в группе меполизумаба по сравнению с группой плацебо [29]. Анализ обзора литературы и сравнительных клинических исследований меполизумаба и омализумаба показал, что лечение меполизумабом приводило к большему снижению клинически значимых обострений (отношение шансов [ОШ]=0,63, 95% доверительный интервал [ДИ] – 0,45–0,89), но не обострений, требующих госпитализации, по сравнению с омализумабом (ОШ – 0,58, 95% ДИ – 0,16–2,13) и сопоставимому влиянию на функцию легких и профили переносимости [30].
Реслизумаб (Синкейро) представляет собой гуманизированное моноклональное иммуноглобулиновое IgG4k-антитело, нацеленное на ИЛ-5. Реслизумаб связывается с высокой аффинностью с циркулирующим человеческим ИЛ-5 и подавляет сигнальный путь ИЛ-5, потенциально нарушая созревание и выживание эозинофилов. Рандомизированные плацебо-контролируемые исследования III фазы продемонстрировали на 16-й и 52-й неделях уменьшение годовой частоты обострений среди больных тяжелой эозинофильной БА на фоне лечения ИГКС на 54% и увеличение ОФВ1 на фоне лечения реслизумабом [31].
К концу исследования терапия реслизумабом вызвала прирост ОФВ1 на 237 мл [31]. Установлено, что реслизумаб снижает частоту обострений и улучшает функцию легких пациентов с тяжелой неконтролируемой эозинофильной астмой. Согласно сравнительной характеристике, проведенной M. Mukherjee et al., сравнивали эффективность терапии индивидуально дозированной от массы тела внутривенной формой реслизумаба больных тяжелой астмой с неадекватным ответом на лечение меполизумабом для подкожного введения в фиксированной дозе 100 мг [32]. В данное исследование были включены 10 преднизолон-зависимых пациентов с ТБА с эозинофилией крови >300 кл/мкл и эозинофилией мокроты >3%, которые ранее получали на протяжении ≥12 месяцев фиксированную дозу меполизумаба (100 мг) подкожно каждые 4 недели.
Получены следующие результаты:
- у СГКС-зависимых пациентов с ТЭА, ранее продемонстрировавших неадекватный ответ на терапию меполизумабом, лечение реслизумабом в течение 4 месяцев привело к снижению уровня эозинофилов на ≥50% и/или нормализации значений в крови и мокроте (<300 кл/мкл и <3% соответственно);
- улучшились показатели ACQ (Asthma Control Questionnaire) на ≥1,5;
- отсутствие обострений астмы, требующих дополнительной дозы СГКС.
Девять из 10 преднизолон-зависимых пациентов, лечившихся реслизумабом, продемонстрировали адекватный ответ, против 4 из 10 при лечении меполизумабом. Только реслизумаб статистически значимо уменьшал эозинофилию мокроты по сравнению с исходным уровнем (р=0,002). У 5 (из 6) пациентов со стойкой эозинофилией мокроты >3% на фоне лечения меполизумабом реслизумаб позволил достичь контроля эозинофильного воспаления в дыхательных путях (<3% эозинофилов в мокроте).
Авторы показали, что содержание ИЛ-5, связанного с Ig, было более выраженным в мокроте пациентов во время терапии меполизумабом по сравнению с реслизумабом (р=0,004), что указывает на возможность образования иммунных комплексов в связи с недостаточной концентрацией моноклональных антител (МАТ) в дыхательных путях [32]. Установлено, что реслизумаб уменьшал уровни эозинофильной пероксидазы (EPX) индуцированной мокроты на 65,4% по сравнению с исходным уровнем (р=0,03), в то время как после лечения меполизумабом не наблюдалось значимого снижения уровней EPX в мокроте (р=0,82). Реслизумаб продемонстрировал по сравнению с меполизумабом улучшение контроля ТБА на 57,2% по результатам заполнения ACQ-5 (p=0,006) [32].
Бенрализумаб (Faserna) – антиэозинофильное моноклональное антитело (моноклональное антитело к α-субъединице рецептора ИЛ-5), вызывающее быстрое и практически полное снижение уровня эозинофилов в крови в течение 24 часов, что подтверждается результатами исследования препарата в исследованиях SIROCCO, CALIMA [33]. Исследования включили пациентов в возрасте от 12 до 72 лет с тяжелой неконтролируемой эозинофильной астмой. Результаты исследования оказались достаточно показательными: ежегодная частота обострений снизилась на 51 и 36% соответственно, прирост ОФВ1 составил до 159 мл и сократилось потребление ГКС на 75%. Бенрализумаб способствовал быстрой элиминации эозинофилов из крови до уровней, граничащих с неопределяемыми [33].
Лебрикизумаб – новое гуманизированное моноклональное антитело, разработанное для специфического блокирования действия ИЛ-13 – цитокина, участвующего в процессах воспаления дыхательных путей и развития бронхиальной обструкции у некоторых групп пациентов. Все больше и больше клинических испытаний пытались оценить клиническую пользу моноклональных антител против ИЛ-13 для неконтролируемой астмы. Целью данного исследования служит оценка эффективности и безопасности моноклональных антител против ИЛ-13 при неконтролируемой астме. LAVOLTA-I и -II «Roche» представляют собой идентичные двойные слепые рандомизированные многоцентровые плацебо-контролируемые исследования III фазы, предназначенные для оценки эффективности и безопасности препарата лебрикизумаб для пациентов с ТБА, не поддающейся контролю, несмотря на проведение стандартного лечения ИГКС в сочетании с препаратом поддерживающей терапии.
В общей сложности в данных исследованиях участвовали более 2100 пациентов из 28 стран [34]. Первичной конечной точкой в обоих исследованиях была частота обострений астмы за 52 недели. Оценка первичной и дополнительных конечных точек проводилась на основе подгруппы пациентов с более высоким уровнем сывороточного периостина или эозинофилов крови.
В исследовании LAVOLTA-I достигнута первичная конечная точка, демонстрирующая значительное уменьшение частоты обострений астмы у пациентов с повышенным уровнем сывороточного периостина или эозинофилов крови, являющихся биомаркерами воспаления дыхательных путей. Кроме того, данное исследование показало значимое улучшение функции легких, которое определялось по ОФВ1. Однако наблюдаемый эффект, описываемый первичной и дополнительными конечными точками, был менее выраженным, чем в исследованиях II фазы с препаратом лебрикизумаб. В связи с этим клиническая разработка лебрикизумаба для лечения астмы была приостановлена [34].
Дупилумаб (Dupilumab) – моноклональное антитело к α-субъединице ИЛ-4-рецептора, которая блокирует сигнальные пути ИЛ-4 и -13. Дупилумаб ограничивает активность белков, отвечающих за воспаление воздушных путей в легких, которое служит основной причиной развития астмы. В проведенном клиническом исследовании больных среднетяжелой и тяжелой эозинофильной БА были получены обнадеживающие результаты в виде уменьшения доли пациентов с обострением астмы на 87% по сравнению с плацебо. ОФВ1 улучшился более чем на 200 мл при добавлении дупилумаба к ИГКС по сравнению с плацебо, причем этот рост сохранялся во время уменьшения их дозировки и отмены. Это особенно примечательно, потому что пациенты, входящие в исследования, имели ОФВ1 примерно 70% от прогнозируемой величины [35, 36]. При рассмотрении профиля безопасности и переносимости в отношении плацебо во время лечения дупилумабом отмечены более высокая частота реакций в месте инъекции, ринофарингит, тошнота и головная боль. Кроме того, прогрессирующая кожная сыпь, крапивница и отек возникли у одного пациента, получавшего дупилумаб, потребовавшего неургентной симптоматической терапии (СГКС и антигистаминные препараты) и немедленного прерывания лечения. Удивительно и неожиданно, но дупилумаб, по-видимому, повышает уровень эозинофилов; данное явление было выявлено у четырех пациентов. Поэтому с учетом ограниченного размера исследуемой популяции (n=52), получавшей дупилумаб в этом исследовании, общий диапазон возможных побочных эффектов неизвестен и необходим их тщательный мониторинг.
Заключение
Согласно международным статистическим данным, в современной популяции пациентов с БА отмечается тенденция к увеличению резистентности к стандартной базисной фармакотерапии ИГКС/ДДБА, антилейкотриеновым препаратам и тиотропия бромиду (Спирива Респимат). Совершенствование лечения тяжелой трудно контролируемой БА осуществляется в зависимости от фенотипа болезни и должно предусматривать использование таргетной терапии МАТ.


