Создание биологических модификаторов иммунного ответа (biologics) стало революцией в медицине – впервые появились препараты, производимые с помощью рекомбинантной ДНК, действие которых нацелено на конкретные звенья патогенеза заболеваний. Целенаправленность специфического воздействия на иммунную систему, высокая эффективность, хорошая переносимость и комплаентность обусловили широкое распространение биолоджиков в самых разных областях медицины, в т.ч. в дерматологии.
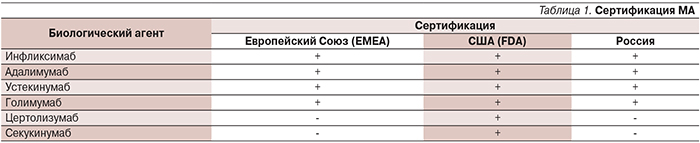
Для лечения псориаза и псориатического артрита (ПА) применяют все три группы биологических модификаторов иммунного ответа: антитела, слитые белки, рекомбинантные человеческие цитокины и факторы роста, но наибольшее распространение получили препараты, нацеленные на блокаду специфических рецепторов на поверхности иммунокомпетентных клеток или провоспалительных цитокинов – моноклональные антитела (МА). Мы разделили указанные медикаменты на группы согласно результатам их сертификации в России, Европе и США (табл. 1).
МА, разрешенные к широкому применению в России
Адалимумаб
Адалимумаб – рекомбинантные МА, пептидная последовательность которых идентична иммуноглобулину (Ig) G1 человека. Препарат селективно связывается с фактором некроза опухоли α (ФНО-α) и нейтрализует его биологические функции за счет блокады взаимодействия с поверхностными клеточными р55- и р75-рецепторами. Адалимумаб изменяет уровни молекул адгезии, вызывающих миграцию лейкоцитов, быстро снижает уровни острофазных показателей воспаления (С-реактивного белка и СОЭ), сывороточных уровней цитокинов (интерлейкина-6 [ИЛ-6]), сывороточной активности матриксных металлопротеиназ (ММР-1 и ММР-3), вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща [1].
Адалимумаб вводят подкожно в область живота или переднелатеральную область бедра исходно в дозе 80 мг, через 1 неделю – 40 мг, далее – по 40 мг 1 раз в 2 недели.
 ПА – основное показание к назначению адалимумаба. Препарат был разрешен к применению в практическом здравоохранении в 2005 г. для лечения активного ПА в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами на основании результатов международного рандомизированного плацебо-контролируемого клинического исследования ADEPT [2].
ПА – основное показание к назначению адалимумаба. Препарат был разрешен к применению в практическом здравоохранении в 2005 г. для лечения активного ПА в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами на основании результатов международного рандомизированного плацебо-контролируемого клинического исследования ADEPT [2].
Псориаз. В 2008 г. Food and Drug Administration (FDA – Управление по контролю за пищевыми и лекарственными средствами) США одобрила применение препарата при бляшечном псориазе после двойного слепого плацебо-контролируемого многоцентрового международного исследования REVEAL, в котором участвовали свыше 1200 пациентов в течение года [3, 4].
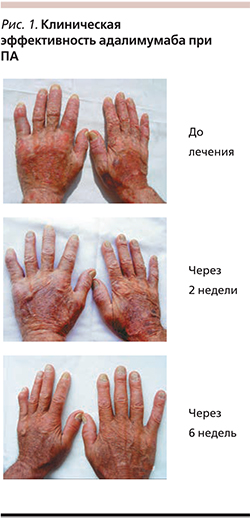
Под нашим наблюдением адалимумаб в качестве монотерапии получали 19 больных ПА: 11 женщин и 8 мужчин. Поражение суставов у всех пациентов сопровождалось распространенными высыпаниями и поражением ногтей. Возраст пациентов колебался от 22 до 62 лет, длительность псориаза – от 10 до 33, ПА – от 3 до 27. Предшествовавшая терапия для всех пациентов была недостаточно эффективной. Препарат вводили согласно инструкции. У всех больных уже через 3–7 дней уменьшалась скованность суставов. Через месяц по критерию ACR-20 ответили 10 человек, ACR-50 – 5, ACR-70 – 3; через 12 недель – 2, 6 и 12 пациентов соответственно. Клинический пример представлен на рис. 1. Все пациенты достигли PASI-75 (улучшение индекса PASI более чем на 75%) через 12 и 40 недель. Переносимость препарата в целом по группе была хорошей, серьезных побочных эффектов не зарегистрировано.
Голимумаб
Голимумаб – полностью человеческие МА к ФНО-α – последний внедренный в клиническую практику ингибитор ФНО-α.
Вводят подкожно по 50 или 100 мг 1 раз в месяц [5].
ПА. Голимумаб одобрен FDA для лечения ПА на основании исследования III фазы GO REVEAL, в котором участвовали 405 пациентов в течение 14 недель [6]. К 14-й неделе лечения терапевтический эффект ACR-20 был достигнут у 51% больных, получавших препарат в дозе 50 мг, и у 41% — в дозе 100 мг по сравнению с 9% в группе плацебо. По индексам ACR-50 и ACR-70 у пациентов, принимавших голимумаб, также отмечено значительное улучшение по сравнению с группой плацебо.
Препарат разрешен к применению в комбинации с метотрексатом или в качестве монотерапии при активном прогрессирующем ПА, когда другие методы лечения оказались неэффективными.
Псориаз. W.K. Lee и соавт. (2015) [7] описали успешное лечение голимумабом в дозе 50 мг/мес пациента, страдавшего псориатической эритродермией.
Инфликсимаб
Инфликсимаб – селективный антагонист ФНО-α, представляющий собой химерные МА IgG1, которые на 75% состоят из человеческого и на 25% из мышиного белка. Инфликсимаб связывается с ФНО-α с высокими специфичностью, аффинностью и авидностью, образует стабильные комплексы с ФНО-α, подавляет биологическую активность свободного и мембран-ассоциированного ФНО-α, не взаимодействует с лимфотоксином (ФНО-β), лизирует (или индуцирует апоптоз) ФНО-продуцирующих клеток [8].
Инфликсимаб вводят внутривенно в дозе 3–5 мг/кг исходно, через 2 и 6 недель, а далее 1 раз в 8 недель.
Псориаз. В 2006 г. результаты двух мультицентровых рандомизированных двойных слепых плацебо-контролируемых исследований (EXPRESS и EXPRESS II) позволили FDA рекомендовать инфликсимаб для лечения псориаза. Препарат применяют для лечения взрослых больных псориазом (тяжелым и средней тяжести), если они не отвечают на другие системные методы терапии (включая циклоспорин, ацитретин, метотрексат и ПУВА-терапию), не переносят эти препараты или имеют противопоказания к их применению [9, 10].
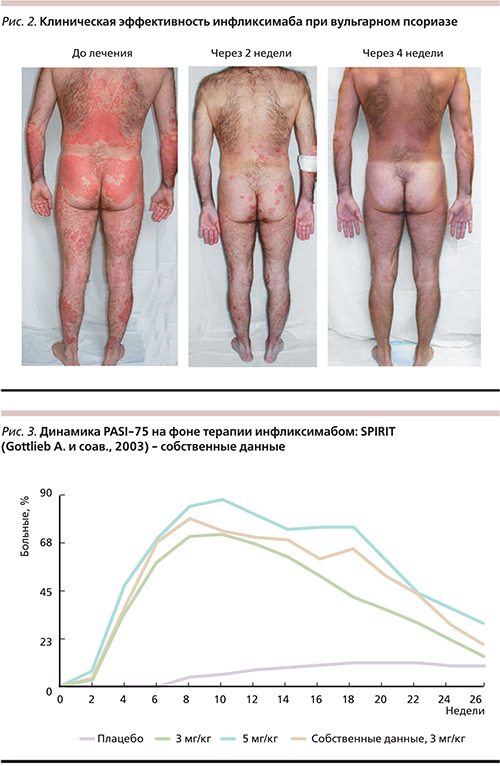
Мы применяли инфликсимаб в качестве монотерапии в отношении 35 больных псориазом (14 женщин и 21 мужчина), рефрактерных к предшествующей терапии. Возраст пациентов колебался от 18 до 72 лет, длительность заболевания – от 12 до 43. Большинство больных – 27 – страдали распространенным вульгарным, 8 – артропатическим псориазом. Предшествующая терапия для всех пациентов была неэффективной. Инфликсимаб вводили согласно инструкции. У всех больных уже после первой инфузии препарата отмечен быстрый регресс высыпаний: на 2–4-е сутки уменьшились шелушение и экссудативные явления, исчез венчик гиперемии вокруг папул и бляшек, на 8–10-е сутки появился псевдоатрофический ободок Воронова, уменьшилась инфильтрация элементов. Клинический пример представлен на рис. 2. Динамика индекса площади поражения и тяжести псориаза PASI (Psoriasis Area and Severity Index) в целом была близкой к таковой в исследовании SPIRIT (рис. 3). Переносимость инфликсимаба в целом была хорошей. У одного больного во время каждой инфузии появилась головная боль, самопроизвольно регрессировавшая и не связанная с изменением артериального давления. У двух пациентов после третьей инфузии во время введения препарата появился гриппоподобный синдром.
ПА. Одновременно на основании исследований IMPACT I и IMPACT II FDA одобрила применение инфликсимаба для лечения активного прогрессирующего ПА [11, 12].
Устекинумаб
Устекинумаб – полностью человеческие МА класса IgG1k, которые с высокой специфичностью и аффинностью связывают ИЛ-12 и ИЛ-23, предотвращая их связывание с рецептором ИЛ-12R-β1, экспрессируемым на поверхности иммунных клеток, подавляя таким образом ИЛ-12- и ИЛ-23-опосредованное воспаление при псориазе.
Препарат вводят подкожно в дозе 45 или 90 мг исходно, через месяц, затем 1 раз в 3 месяца.
Псориаз. На III фазе клинических испытаний безопасность и эффективность препарата были доказаны в отношении 766 пациентов в параллельном рандомизированном двойном слепом плацебо-контролируемом исследовании PHOENIX I [13] и 1230 – в PHOENIX II [14]. PASI-75 на 12-й неделе достигли 67–76% пациентов. Испытания проходили в течение 80 недель. Эффект оказался прямо пропорционален концентрации устекинумаба в плазме крови.
ПА. III фаза мультицентровых рандомизированных двойных слепых плацебо-контролируемых клинических исследований с участием 615 (PSUMMIT I) и 312 пациентов (PSUMMIT II), получавших устекинумаб в течение 24 недель, доказала эффективность и безопасность препарата [15].
На основании результатов вышеперечисленных исследований устекинумаб был разрешен FDA к широкому применению при псориазе в 2009 г, при ПА – в 2013 г.
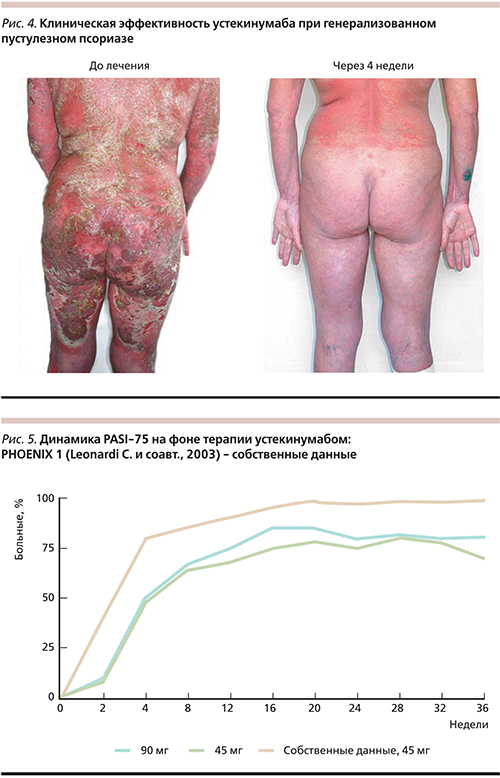
Под нашим наблюдением устекинумаб в качестве монотерапии получали 9 больных распространенным вульгарным псориазом (4 женщины и 5 мужчин) и две женщины, страдавшие генерализованным пустулезным псориазом. Возраст пациентов колебался от 28 до 56 лет, длительность заболевания – от 8 до 33. Предшествовавшая терапия для всех пациентов была неэффективной. Препарат вводили согласно инструкции. У всех больных уже после первой инъекции начинался регресс высыпаний: на 8–10-е сутки уменьшились шелушение и экссудативные явления, исчез венчик гиперемии вокруг папул и бляшек, на 14–16-е сутки появился псевдоатрофический ободок Воронова, уменьшилась инфильтрация элементов. Клинический пример представлен на рис. 4. Динамика индекса PASI в нашем исследовании по сравнению с таковым в PHOENIX 1 представлена на рис. 5. Переносимость устекинумаба в целом по группе была хорошей, побочных эффектов не зарегистрировано.
МА, не сертифицированные в России, но сертифицированные в США
Апремиласт
Апремиласт – пероральный низкомолеклярный селективный ингибитор фосфодиэстеразы-4, повышающий уровень внутриклеточного цАМФ, что в результате подавляет секрецию ФНО-α [16]. Кроме того, апремиласт ингибирует экспрессию провоспалительных цитокинов и повышает экспрессию противовоспалительных медиаторов, таких как ИЛ-10 [17].
Псориаз. Положительные результаты рандомизированных двойных слепых плацебо-контролируемых исследований ESTEEM 1 и ESTEEM 2 с участием 1426 пациентов стали основанием для использования апремиласта в практической дерматологии по показанию «бляшечный псориаз тяжелый или средней тяжести у взрослых пациентов» [18–20].
ПА. В марте 2014 г. FDA одобрила препарат для лечения ПА у взрослых пациентов. Предшествовавшие клинические исследования III фазы PALACE 1, 2 и 3, в которых приняли участие 1493 пациента в течение 52 недель, засвидетельствовали способность апремиласта значительно облегчать симптомы заболевания как в качестве монотерапии, так и в комбинации со средствами базисной терапии ревматоидного артрита [21–23]. Так, например, к 16-й неделе терапии была выявлена существенная эффективность в достижении ACR-20 в подгруппах больных, получавших апремиласт по 20 мг 2 раза в сутки (31%) и по 30 мг 2 раза в сутки (40%) по сравнению с плацебо (19%; p<0,001).
Секукинумаб
Секукинумаб (AIN457) – полностью человеческие МА, которые таргетно связывают и нейтрализуют ИЛ-17A.
Псориаз. Разные режимы дозирования препарата изучены в трех двойных слепых плацебо-контролируемых исследованиях II фазы. В первом из них 81% пациентов, получавших секукинумаб в дозе 150 мг подкожно 1 раз в месяц, достигли PASI-75 на 12-й неделе лечения по сравнению с 9% в группе плацебо. В другом исследовании при внутривенном введении секукинумаба 83% пациентов достигли PASI-75 по сравнению с 10% в группе плацебо. В третьем исследовании при приеме секукинумаба внутрь 55% пациентов достигли PASI-75 в первый месяц терапии по сравнению с 2% в группе плацебо на 12-й неделе [24].
FDA для лечения псориаза рекомендована следующая схема: 300 мг исходно, затем 1 раз в неделю в течение первых 4 недель, а позже – 300 мг 1 раз в 4 недели. Дозу 300 мг вводят подкожно в виде двух инъекций по 150 мг.
ПА. В двух базовых рандомизированных плацебо-контролируемых многоцентровых клинических исследованиях FUTURE 1 и FUTURE 2 приняли участие более 1000 пациентов. Положительная динамика со стороны пораженных периферических суставов сопровождалась регрессом кожного процесса [25].
Сертолизумаб
Сертолизумаб (Certolizumab pegol) – Fab-фрагмент рекомбинантных гуманизированных МА к ФНО-α. Вводят подкожно 200 мг 2 раза в течение первого дня, через 2 и 4 недели, далее – 200 мг 1 раз в 2 недели [26].
ПА. В многоцентровом рандомизированном двойном слепом-плацебо-контролируемом исследовании RAPID была оценена эффективность и безопасность препарата для 409 пациентов с активным и прогрессирующим ПА в течение 24 недель. Клинический ответ на терапию отмечен у некоторых больных уже в первую неделю лечения. На 24-й неделе зарегистрирована статистически достоверная разница рентгенологической картины между пациентами, получавшими цертолизумаб и плацебо [27].
Высокая эффективность и хорошая переносимость позволили FDA рекомендовать цертолизумаб для лечения взрослых пациентов с активным ПА в 2013 г.
Псориаз. На II фазе клинических испытаний, проведенных K. Reich и соавт. (2012), PASI-75 достигли 75–83% пациентов при удовлетворительной переносимости препарата [28].
МА, находящиеся на этапе клинических испытаний
Базиликсимаб
Химерные МА к α-цепи (CD25) рецептора ИЛ-2 (ИЛ-2R) на поверхности активированных Т-лимфоцитов. Препарат специфически блокирует рецептор, тем самым предотвращая репликацию Т-клеток, а также активацию В-лимфоцитов, ответственных за реакцию «трансплантата против хозяина». С 1998 г. базиликсимаб используют для предотвращения немедленного отторжения трансплантата.
Псориаз. Успешное лечение больного тяжелым рефрактерным псориазом описали в 2000 г. C.M. Owen, P.V. Harrison [29]. Тогда же A. Salim, R.M. Emerson, K.L. Dalziel (2000) [30] с помощью базиликсимаба удалось помочь пациенту с генерализованным пустулезным псориазом.
Бродалумаб
Человеческие МА к рецептору А ИЛ-17. Препарат ингибирует сигнальный путь воспаления, блокируя связь некоторых ИЛ-17 лигандов и рецептора. Бродалумаб вводят подкожно по 140 или 280 мг 1 раз в две недели.
Псориаз. В июне 2014 г. успешно завершилось клиническое исследование III фазы AMAGINE-1. Из 198 пациентов 75% достигли 90%-го улучшения, а 62% – полного клинического выздоровления [31, 32].
ПА. Тогда же успешно завершилась II фаза клинических испытаний препарата при ПА [33].
Галиксимаб
Химерные МА к CD80 [42], используемые для терапии В-клеточных лимфом [34, 35].
Псориаз. Клинические исследования I/II фаз продемонстрировали эффективность разового введения препарата и курсового лечения псориаза: у 40% больных PASI снизился более чем на 50% [36]. Однако режимы дозирования при псориазе не отработаны.
Гуселькумаб
МА к ИЛ-23.
Псориаз. Во II фазе клинических исследований приняли участие 253 больных вульгарным псориазом. Гуселькумаб вводили каждые 8 или 12 недель в дозе от 5 до 200 мг. Результаты лечения оценивались врачом по пятибалльной шкале PGA. Среди получавших препарат в дозе 200 мг снижение выраженности заболевания до 0–1 пункта наступило у 83% пациентов, 5 мг – у 34%, плацебо – у 7% [37]. В августе 2014 г. начато многоцентровое рандомизированное двойное слепое исследование III фазы для оценки эффективности и безопасности гуселькумаба для лечения больных вульгарным псориазом (тяжелым и средней тяжести).
Даклизумаб
Гуманизированные МА к CD25- субъединице ИЛ-2-рецептора Т-лимфоцитов. Препарат используют для предотвращения отторжения трансплантированных органов, а также для лечения рассеянного склероза [38]. Даклизумаб продается в США. Продажа в Европе прекращена в 2008 г. по коммерческим причинам.
Псориаз. J.G. Krueger и соавт. (2000) [39] и J. Wohlrab и соавт. (2001) [40] обнаружили снижение индекса PASI в среднем на 30% на фоне терапии даклизумабом. S. Dichmann и соавт. (2002) [41] успешно применили даклизумаб у ВИЧ-инфицированных больных псориатической эритродермией.
Иксекизумаб
Гуманизированные МА, которые связывают ИЛ-17 и блокируют его действия.
Псориаз. В процессе клинических исследований больным вульгарным псориазом тяжелым и средней тяжести назначали иксекизумаб подкожно в дозах 10, 20, 75 и 150 мг один раз в две недели в течение первых двух месяцев, далее – один раз в месяц. Через 12 недель PASI-75 в группе, получавшей 20 мг препарата, достигли 77% пациентов, 75 мг – 83%, 150 мг – 82%. У пациентов, получавших плацебо, PASI-75 был зафиксирован на уровне 8%, как и при использовании минимальной дозы 10 мг. Эффект от применения иксекизумаба сохранялся через 20 недель после начала терапии [42].
Тилдракизумаб
Гуманизированные селективные МА к субъединице р19 ИЛ-23. Препарат вводят подкожно в дозе 100 или 200 мг.
Псориаз. В настоящее время проходят международные клинические испытания III фазы, в которых участвует свыше 2000 пациентов, получающих тилдракизумаб или этанерсепт (группа сравнения) [43, 44].
Тофацитиниб
Мощный селективный ингибитор янус-киназ (JAK-киназ) -1, -2, -3 и в меньшей степени – тирозинкиназы-2, индифферентный в отношении прочих киназ генома человека [45]. Препарат принимают внутрь вне зависимости от приема пищи в дозе от 2 до 60 мг/сут, чаще – 5 или 10 мг два раза в день.
Псориаз. В плацебо-контролируемом клиническом исследовании IIb-фазы приняли участие 197 человек, которые принимали препарат в дозе 2, 5 или 15 мг 2 раза в день на протяжении 12 недель. PASI-75 достигли 25, 40,8 и 66,7% пациентов соответственно [46].
В июне 2014 г. в Journal of Investigative Dermatology поступила в печать статья, в которой описан пациент, страдавший псориазом и алопецией, получавший тофацитиниб. Первые два месяца терапии пациент получал препарат в дозе 10 мг/сут, в течение следующих трех месяцев – 15 мг/сут. Псориатические элементы регрессировали, отросли волосы на голове и теле, появились брови и ресницы. Спустя восемь месяцев после начала лечения зафиксировано полное восстановление волосяного покрова [47].
Неэффективные МА
Сиплизумаб
Гуманизированные МА, блокирующие CD2-рецептор Т- и NK-клеток и его взаимодействие с LFA-3 на антигенпрезентирующей клетке. Препарат избирательно подавляет функции Т- и NK-клеток, тестируется в качестве средства для лечения лимфопролиферативных заболеваний и для профилактики отторжения трансплантата.
Псориаз. R. Bissonnette и соавт. (2009) [48], резюмируя результаты двух рандомизированных клинических исследований, в которых участвовали 124 больных в течение 16 недель и 420 больных в течение 12 недель, отметили недостаточную эффективность препарата: PASI-75 достигли только 14% пациентов. Статистически достоверных различий по сравнению с плацебо не выявлено.
ABX-IL8
Полностью человеческие МА к свободному ИЛ-8.
Псориаз. Двойное слепое плацебо-контролируемое рандомизированное клиническое исследование II фазы с участием 256 пациентов в течение 24 недель продемонстрировало неэффективность препарата [49].
ОКТ4А
Гуманизированныe анти-CD4 МА IgG4.
Псориаз. H. Bachelez и соавт. (1998) [50], A.B. Gottlieb и соавт. (2000) [51] доказали неэффективность препарата при вульгарном псориазе.
МА, производство которых прекращено
Эфализумаб
Рекомбинантные гуманизированные IgG1-МА к CD11a-субъединице ассоциированного с функцией лейкоцитов антигена 1 (LFA-1). Препарат ингибирует активацию Т-лимфоцитов и уменьшает миграцию клеток из сосудов в дерму и эпидермис.
Псориаз. Эфализумаб был одобрен FDA в октябре 2003 г. для лечения псориаза на основании длительных успешных клинических исследований [52, 53]. Однако в процессе широкого применения у 4 из 2000 больных псориазом, леченных эфализумабом, произошла активация латентного JC-вируса, что привело к летальному исходу от прогрессивной мультифокальной лейкоэнцефалопатии [54]. Из-за высокого риска развития смертельной инфекции центральной нервной системы препарат запрещен с 2009 г.
Практические рекомендации
1. В дерматологической практике использование МА ограничено следующими нозологиями (МКБ 10):
- L40.0 Псориаз обыкновенный.
- L40.5 Псориаз артропатический.
2. Показания к применению МА:
- ПА, требующий системной терапии;
- псориаз тяжелый или средней тяжести;
- псориаз лица, аногенитальной области, ногтей;
- неэффективность, непереносимость или наличие противопоказаний к другим видам терапии;
- неудовлетворенность пациента результатами предыдущей терапии.
3. Противопоказания:
- возраст моложе 18 лет;
- гиперчувствительность к белковым препаратам в анамнезе;
- беременность (для анти-ФНО- агентов – категория В);
- лактация;
- острые или подострые инфекционные заболевания (в т.ч. активный туберкулез, вирусные гепатиты);
- высокий риск развития сепсиса;
- прогрессирование лимфопролиферативных заболеваний и/или злокачественных новообразований менее чем за 5 лет до начала терапии (кроме базалиомы);
- меланома;
- сердечная недостаточность IIБ–III степеней (для анти-ФНО МА);
- демиелинизирующие заболевания нервной системы (для анти-ФНО МА);
- иммунная несостоятельность или иммунная супрессия;
- чрезмерная хроническая гиперинсоляция или чрезмерное лечение фото(химио)терапевтическими методиками (свыше 200 сеансов ПУВА-терапии).
4. Скрининг – исходно, затем 1 раз в 6 месяцев:
- общее физикальное обследование;
- ЭКГ;
- общий анализ крови;
- биохимия крови (глюкоза, мочевина, креатинин, билирубин, АСТ, АЛТ, щелочная фосфатаза);
- анализ крови на гепатиты, сифилис, ВИЧ;
- рентген органов грудной клетки;
- реакция Манту или Диаскин-тест/квантифероновый тест;
- анализ мочи.
5. Побочные эффекты:
- реакции в месте введения: эритема, отек;
- инфузионные реакции (во время внутривенного введения или в течение часа после);
- гриппоподобный синдром (озноб, лихорадка, головная боль, миалгии);
- инфекции верхних дыхательных и мочевыводящих путей, туберкулез, сепсис;
- злокачественные новообразования;
- демиелинизирующие заболевания нервной системы;
- усугубление сердечной недостаточности;
- образование вторичных антител.
6. При неэффективности одного ингибитора ФНО-α пациента переключают на лечение другим ингибитором ФНО-α или МА к ИЛ-12/23.
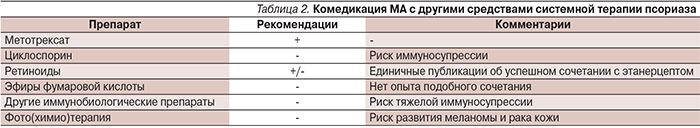
7. Возможности сочетанной системной терапии псориаза МА и другими препаратами (табл. 2).


