Введение
Смертность от сердечно-сосудистых заболеваний (ССЗ) намного опережает таковую от инфекционных и онкологических болезней. По оценкам Всемирной организации здравоохранения (ВОЗ), в 2012 г. от ССЗ во всем мире умерли 17,5 млн человек, что составило 31% от всей мировой смертности. Из этого числа 7,4 млн (42%) умерли от ишемической болезни сердца (ИБС), 6,7 (38%) млн – от инсульта. По подсчетам ВОЗ, к 2030 г. от ССЗ ежегодно будут умирать около 23,6 млн человек. Ежегодная общая смертность населения составляет, по разным данным, 1,2–2,4%, при этом сердечно-сосудистая смертность (ССС) – 0,6–1,4%, частота нефатального инфаркта миокарда (ИМ) – от 0,6 (по данным исследования RITA-2) до 2,7% (по данным COURAGE). При этом у больных очень высокого риска ежегодная смертность увеличивается до 3,8%, в то время как у лиц с гемодинамически незначимым атеросклерозом коронарных артерий смертность находится на уровне 0,63% (данные регистра REACH). ССЗ – ведущая причина смерти населения в РФ с вкладом в общую смертность 57%. ССЗ также служит наиболее частой причиной госпитализаций и потерь трудоспособности населения РФ. Экономический ущерб от ССЗ в РФ составляет порядка 3% внутреннего валового продукта страны. Кривая смертности от ССЗ в РФ имеет волнообразную форму: с 1991 по 1994 г. она возрастала с 621 до 836 случаев на 100 тыс. населения, затем отмечался спад до 747 случаев в 1998 г., после чего смертность снова возросла до 927 случаев в 2003 г. С того момента и по настоящее время отмечается относительно устойчивая тенденция к снижению смертности от ССЗ, которая в 2013 г. составила 698,1 случая, в 2014 г. – 653,7 на 100 тыс. населения. Однако эти показатели по-прежнему являются одними из самых высоких в мире, превысив аналогичные показатели в развитых странах в 4–6 раз [1]. Поэтому важным моментом остается индивидуализация подходов к коррекции факторов риска в зависимости от тяжести течения заболевания. В связи с этим целесообразно ввести пятую категорию риска, что позволит обосновать и провести максимально интенсивное лечение с использованием препаратов, доказавших свое влияние на достижение не только тех или иных параметров и показателей, но и значительно снижающих риск сердечно-сосудистых осложнений (ССО). Предлагается назвать такую группу – группу экстремального риска (ЭР). Таким образом, пациентов можно будет разделить на пять категорий риска – низкий, умеренный, высокий, очень высокий и экстремальный.
Обоснование введения категории ЭР
Как известно, категория очень высокого риска ССЗ включает достаточно обширную категорию пациентов, среди которых имеются пациенты с наличием нескольких патологий, каждая из которых подпадает под данную категорию [2]. Несомненно, что их сочетание значительно увеличивает риск развития осложнений. Это диктует необходимость выделения дополнительной категории, которую предлагается определить как группу ЭР. Это позволит ввести более жесткие требования к контролю факторов риска для этих пациентов, что должно положительно повлиять на частоту ССО и смертность в этой наиболее тяжелой категории.
Действительно, в настоящее время к очень высокой категории риска можно отнести как пациента с ИБС, так и больного, у которого имеется сочетание ИБС с сахарным диабетом 2 типа (СД2) и недостаточностью кровообращения. Однако сердечно-сосудистый риск (ССР) во втором случае, несомненно, значительно выше. В частности, сочетание СД2 с ССЗ значительно ухудшает прогноз. В связи с этим в последнее время в лечении СД2 происходит переход от «глюкоцентрического» подхода к более глобальной тактике, ставящей основной целью снижение частоты ССО [3]. Приобретают важность не столько абсолютные уровни глюкозы плазмы натощак и уровень гликозилированного гемоглобина (HbA1c), сколько безопасность используемых в конкретном случае препаратов и их способность снижать частоту ССО. Этот подход подобен тому, что был ранее предложен для борьбы с артериальной гипертензией: важен не столько собственно гипотензивный эффект терапии, сколько ее влияние на ССР [4]. В 2017 г. Национальным обществом по изучению атеросклероза (НОА) предложены более жесткие целевые уровни холестерина липопротеидов низкой плотности (ЛПНП). У больных очень высокого риска целевой уровень ЛПНП должен быть 1,5 ммоль/л или ниже [2]. Этот уровень ЛПНП также может быть одним из целевых показателей терапии для больных ЭР.
Официально категория ЭР была выделена в рекомендациях 2017 г. Американской ассоциацией клинических эндокринологов и Американским колледжем эндокринологов (AACE) [5].
В этих рекомендациях к категории ЭР относят пациентов со следующими состояниями:
- Прогрессирование ССЗ, вызванных атеросклерозом, включая нестабильную стенокардию у пациентов с уровнем ЛПНП менее 1,8 ммоль/л.
- Клинически значимое ССЗ у пациентов с СД, хронической болезнью почек (ХБП) 3–4-й ст. или с гетерозиготной семейной гиперхолестеринемией (геСГХС).
- Развитие ССЗ у мужчин моложе 55 лет или женщин моложе 65 лет.
В табл. 1 представлена предлагаемая в данных рекомендациях градация категорий риска и тактика лечения.
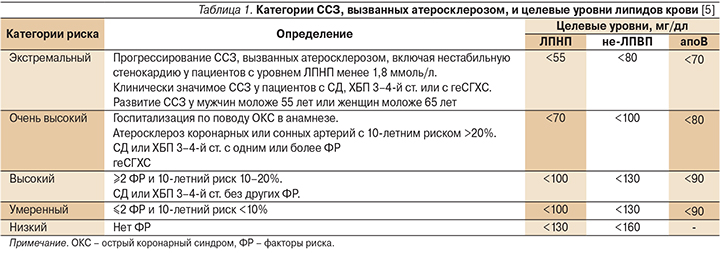
Как следует из табл. 1, определение категорий риска несколько отличается от такового, представленного в Рекомендациях НОА 2017 г. С учетом имеющихся российских рекомендаций по коррекции нарушений липидного обмена и на основании ряда клинических исследований, описанных ниже, целесообразно следующее определение ЭР для российской популяции: сочетание клинически значимого ССЗ, вызванного атеросклерозом, с СД2 и/или СГХС, ССО у пациента с ССЗ, вызванным атеросклерозом, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ЛПНП≤1,5 ммоль/л. При этом к ССЗ, вызванным атеросклерозом, следует относить ИБС, ишемический инсульт или транзиторное нарушение мозгового кровообращения, ишемию нижних конечностей.
Таким образом, с введением категории ЭР классификация категорий риска ССО приобретает следующий вид (табл. 2).
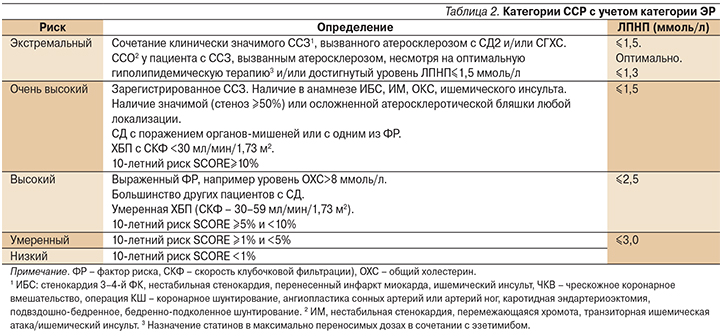
Как видно из табл. 2, пациентам ЭР требуется достигать целевого уровня ЛПНП≤1,5 ммоль/л. Однако имеются основания полагать, что целевой уровень ЛПНП ≤1,3 ммоль/л будет более оптимальным. В настоящий момент доказательная база по более низкому целевому уровню ЛПНП только формируется, что не позволяет рекомендовать его в качестве обязательного.
С целью облегчения работы врачей целесообразно разработать электронное приложение для мобильных устройств, в котором после заполнения врачом соответствующих полей будет показана категория риска, выданы целевые уровни ЛПНП и описана терапевтическая тактика.
Помимо изменения тактики лечения данных больных выделение группы ЭР, возможно, позволит повлиять на льготное лекарственное обеспечение пациентов, которые войдут в эту группу.
Тактика лечения пациентов ЭР
Пациентам данной группы обязательна коррекция факторов риска: артериальной гипертензии, гиподинамии, абдоминального ожирения; отказ от курения, использование средиземноморской или нордической диеты. Рекомендуется контроль уровня Лп(а), целевой уровень HbA1c составляет <7%.
Пациентам с уровнем ОХС более 7,5 ммоль/л и/или ЛПНП более 4,9 ммоль/л необходимо исключить наличие СГХС.
С этой целью целесообразно использовать Голландские критерии. Кроме того, при подозрении на СГХС требуется проводить каскадный скрининг с обследованием родственников первой и второй линий [6]. При подозрении на семейный характер нарушения липидного обмена по возможности следует провести генетическое обследование пациента с использованием технологии NGS (Next Generation Sequences) для исключения мутации в генах, кодирующих выработку рецепторов ЛПНП, белка – модулятора рецепторов ЛПНП, апоВ, PCSK9. При обнаружении мутации в раках каскадного скрининга у родственников первой линии индексного больного следует выполнить генетический анализ по технологии SNP (Single Nucleotide Polymorphism).
При выборе антигипертензивной терапии больных ЭР целевой уровень артериального давления (АД) должен быть ≤130/80 мм рт.ст. (и не ниже 120/80 мм рт.ст.), но только в том случае, если достижение такого уровня АД возможно без значимых побочных эффектов антигипертензивной терапии [7].
Для пациентов с ЭР обязательным требованием служат достижение целевого уровня ЛПНП≤1,5 ммоль/л, оптимальный уровень ≤1,3 ммоль/л. Его достижение предполагается за счет усиления гиполипидемической терапии, а именно статинотерапии (аторвастатин или розувастатин) в максимально переносимых дозах в сочетании с эзетимибом, в ряде случаев в качестве третьего компонента возможно сочетание с ингибиторами PCSK9. Достижение целевого уровня ЛПНП в данной группе пациентов служит приоритетной задачей, поэтому необходимо использовать весь доступный арсенал гиполипидемических препаратов. При выборе препаратов статинового ряда предпочтение следует отдавать оригинальным статинам. В случае наличия ХБП с СКФ<60 мл/мин/1,73 м2 в качестве препарата первой линии следует рассмотреть аторвастатин в дозе 40–80 мг/сут. Для пациентов с ХБП и сниженной СКФ применение аторвастатина более предпочтительно, чем розувастатина, что было показано в исследованиях с оригинальным аторвастатином – PLANET I и PLANET II. Несмотря на то что розувастатин более выраженно снижал уровень ЛПНП, аторвастатин продемонстрировал более выраженный ренопротективный эффект у больных ХБП как с СД, так и без него [8]. Кроме того, при изучении влияния статинов на время развития ССО по сравнению с плацебо показано, что время до расхождения кривых короче в исследованиях со статинами по сравнению с нестатиновыми липидснижающими препаратами – 10,3 против 20,0 месяцев. Среди исследований со статинами время расхождения короче в исследованиях с аторвастатином по сравнению с другими статинами: 4,75 против 11,4 месяца [9]. При выборе конкретного препарата аторвастатин необходимо учитывать его доказательную базу.
Имеются данные, что, возможно, целевой уровень ЛПНП ≤1,3 ммоль/л более предпочтителен для больных ЭР, однако доказательная база для такой рекомендации в настоящее время недостаточна.
Ниже приводятся данные по этому вопросу.
В случае сочетания ЭР с СД2 в качестве антигипергликемической терапии наряду с метформином необходимо применение эмпаглифлозина и/или лираглутида. При сочетании СД2 с хронической сердечной недостаточностью (ХСН) предпочтение отдается эмпаглифлозину, при сочетании доказанного ССЗ с СД2 – эмпаглифлозину или лираглутиду, при сочетании ССЗ, СД2 и ожирения – лираглутиду.
IMPROVE-IT, FOURIER и ODYSSEY Outcomes: клинические исследования, обосновавшие необходимость более интенсивного снижения уровня ЛПНП у пациентов ЭР
Одним из первых исследований, продемонстрировавших преимущества более выраженного снижения ЛПНП у лиц с очень высоким и ЭР, стало исследование IMPROVE-IT. Включались пациенты, перенесшие ОКС, сравнивались эффекты гиполипидемической терапии только статинами и комбинированной терапии – статин и эзетимиб. Первичной конечной точкой были сердечно-сосудистая смерть, инфаркт, нестабильная стенокардия, ЧКВ. В группе интенсивного контроля значение ЛПНП составило 1,369 ммоль/л. На фоне лечения в течение 7 лет анализ выживаемости по Каплану–Майеру показал, что частота возникновения конечной точки в группе интенсивной терапии достоверно ниже по сравнению с обычной терапией – 32,7 против 34,7%. Относительный риск (ОР) снизился на 6,4% (ОР=0,936, 95% доверительный интервал [ДИ] – 0,89–0,99; p=0,016). Снижение абсолютного риска составило 2%. Анализ подгруппы пациентов с СД (27% от всех включенных в работу) продемонстрировал снижение ОР на 14,4% (ОР=0,856, 95% ДИ – 0,779–0,939) в группе интенсивной терапии и только 2,3% в группе стандартного лечения (ОР=0,977, 95% ДИ – 0,915–1,044; p=0,023). Разделение пациентов на другие подгруппы (в зависимости от курения, АГ, ЧКВ в анамнезе, уровня креатинина) не продемонстрировало значимой разницы при проведении субанализа [10].
В исследовании FOURIER изучалось влияние более интенсивной гиполипидемической терапии лиц с очень высоким и ЭР. Изучался дополнительный эффект от добавления к стандартной гиполипидемической терапии эволокумаба. Первичной конечной точкой были ИМ, сердечно-сосудистая смерть, инсульт, ЧКВ, нестабильная стенокардия. Были включены 27,5 тыс. больных, длительность исследования составила 2,2 года, исследование плацебо-контролируемое. В группе эволокумаба средний уровень ЛПНП составил 0,775 ммоль/л. На этом фоне конечной точки достигли 9,8% пациентов в группе эволокумаба и 11,3% в группе сравнения. Таким образом, интенсивная гиполипидемическая терапия позволила дополнительно на 20% снизить риск (95% ДИ – 0,73–0,89). Именно после данного исследования AACE было предложено выделить категорию ЭР и использовать более низкие целевые уровни ЛПНП [11].
Кроме того, в 2010 г. группой CTT (Cholesterol Treatment Trialists’) Collaboration был проведен мета-анализ 26 клинических исследований, включивших 169 138 пациентов. Рассматривались группы больных ОКС, стабильной ИБС, СД1 (337 пациентов), СД2 (5414 пациентов), а также ХСН. Во всех случаях продемонстрировано дополнительное снижение риска на 24% на каждый 1 ммоль/л снижения уровня ЛПНП. Кроме того, показано, что чем ниже снижается уровень ЛПНП, тем в большей степени уменьшается риск. Даже для лиц с исходным уровнем ЛПНП<2,0 ммоль/л снижение на каждый 1 ммоль/л снижает риск значимых ССО на 29%, у лиц с исходным уровнем ЛПНП<1,8 ммоль/л – на 37% [12]. В другом мета-анализе 2014 г., включившем 38 153 пациента, больные были разделены на группы в зависимости от достигнутого уровня ЛПНП: 1,3 ммоль/л, 1,9; 2,6; 3,2; 3,9 ммоль/л. По сравнению с уровнем 3,9 ммоль/л в группе пациентов с уровнем ЛПНП 1,3 ммоль/л снижение относительного риска ССО составило 0,44 (95% ДИ – 0,35–0,55). При сравнении группы пациентов с уровнем ЛПНП 1,3 и 1,9 ммоль/л снижение ОР составило 0,81 (95% ДИ – 0,70–0,95). Таким образом, при достижении уровня ЛПНП<1,3 ммоль/л, ХС не-ЛПВП<1,9 ммоль/л, а апоВ<50 мг/дл отмечен наименьший уровень сердечно-сосудистых событий [13].
Аналогичные результаты показало исследование ODYSSEY Outcomes (число включенных пациентов – 18 924) [14]. Терапия алирокумабом продемонстрировала снижение ОР сердечно-сосудистых событий вне зависимости от исходного уровня ЛПНП. Отмечено значительное снижение абсолютного риска в группе пациентов, достигших уровня ЛПНП≥2,5 ммоль/л 3,4% в отношении первичной комбинированной конечной точки и 1,7% в отношении общей смертности. Снижение ОР составило 15%.
Особенности терапии пациентов ЭР при сочетании с СД2
Эмпаглифлозин – первый антигипергликемический препарат, продемонстрировавший в крупном проспективном многоцентровом двойном слепом исследовании III фазы EMPA-REG Outcome (NCT01131676) не только безопасность, но и преимущества применения – уменьшение частоты ССО и улучшение исходов, связанных с сердечной недостаточностью (СН), у пациентов с СД2 и установленными заболеваниями сердечно-сосудистой системы и высоким ССР.
Исследование EMPA-REG Outcome проведено в 590 клинических центрах 42 стран и включило 7020 пациентов (71% из них – мужчины) с СД2 и подтвержденными ССЗ, средняя длительность наблюдения составила более 3 лет. Пациенты были разделены на две группы и получали эмпаглифлозин или плацебо в добавление к стандартной терапии, включившей препараты с доказанной способностью снижения частоты ССО. Первичная комбинированная конечная точка включила случаи сердечно-сосудистой смерти, ИМ без смертельного исхода (за исключением безболевого ИМ) и инсульта без смертельного исхода (3P-MACE); вторичная комбинированная конечная точка включала кроме этого случаи госпитализации в связи с СН. Исследование продолжалось до наступления, по крайней мере у 691 пациента, событий, отвечавших по результатам стандартизованной оценки определению первичной конечной точки.
По итогам исследования EMPA-REG Outcome было продемонстрировано снижение частоты достижения первичной конечной точки 3P-MACE на 14% (p=0,038). При этом результаты по каждому из компонентов комбинированной точки были различными: общая смертность снизилась на 32% (p<0,001), ССС – на 38% (p<0,0001), частота нефатального ИМ недостоверно снизилась на 13% (p=0,22), частота нефатального инсульта, напротив, имела тенденцию к увеличению (на 24%; p=0,22), а общая частота смерти от некардиальных причин имела лишь тенденцию к снижению (на 16%; p=0,29). При этом снижение смертности в группе эмпаглифлозина наблюдалось на раннем этапе исследования (<3 месяцев) и было отмечено во всех подгруппах обследованных.
Частота случаев госпитализации по поводу СН снизилась на 35% (p=0,002), в т.ч. на 37% среди пациентов, не имевших СН исходно, и на 28% среди пациентов с СН, диагностированной исходно. Частота госпитализаций или смертей в связи с СН снизилась на 39%, число новых случаев СН (по установленным в исследовании критериям СН, в частности СН с фракцией выброса левого желудочка <35%) – на 30%; частота композитных исходов (госпитализаций по поводу СН или назначение петлевых диуретиков) – на 37%.
Таким образом, исследование EMPA-REG Outcome продемонстрировало не только сердечно-сосудистую безопасность эмпаглифлозина, но и его отчетливые протективные кардиоваскулярные эффекты в виде уменьшения частоты развития ССО и улучшения показателей, характеризующих течение СН у пациентов с СД2 [15].
Влияние на ССО аналога глюкагонподобного пептида лираглутида продемонстрировано в плацебо-контролируемом исследовании LEADER. Первичная композитная точка – сердечно-сосудистая смерть, нефатальный ИМ, нефатальный инсульт. Были включены 9340 больных, время наблюдения составило 3,8 года. Первичная конечная точка фиксировалась достоверно реже в группе лираглутида – 608 (13,0%) из 4668 больных, чем в группе плацебо, – 694 (14,9%) из 4672 больных (ОР=0,87, 95% ДИ – 0,78–0,7; p<0,01 для noninferiority; p=0,01 для superiority). ССС в группе лираглутида составила 4,7%, в группе плацебо – 6,0%; p=0,007, смертность от любых причин также была ниже в группе лираглутида – 8,2 против 9,6% в группе плацебо (p=0,02). Частота развития ИМ, инсульта и ХСН также была ниже в группе лираглутида [16].
Заключение
В связи с тем что первым проявлением ССЗ может быть сердечно-сосудистая смерть, крайне важно выявлять пациентов высоких градаций риска не только на этапе появления клинической симптоматики, но и до возникновения таких проявлений. Следует подчеркнуть, что опасность представляет не степень стеноза коронарной или сонной артерий, а состояние атеросклеротической бляшки. Однако на современном этапе развития кардиологии нет достоверных неинвазивных методов, позволяющих выявлять нестабильные атеросклеротические бляшки. Поэтому крайне важно оценить категорию риска пациента для определения тактики лечения. Среди факторов риска ССО следует выделить 4 основных – гипертензия, дислипидемия, курение, СД2/нарушение толерантности к глюкозе.
В выявлении пациентов с ИБС существует две основные разнонаправленные ошибки – гипердиагностика и недооценка степени риска. Частыми причинами необоснованной постановки диагноза ИБС служат наличие болевого синдрома в грудной клетке без доказанности его ишемического генеза, пожилой возраст и изменения конечной части желудочкового комплекса на электрокардиограмме (ЭКГ). Недооценка степени риска проистекает из того, что лечение, как правило, начинают только при наличии гемодинамически значимого стеноза. Кроме того, необоснованно широко используется ЧКВ. Однако показано, что при стабильной ИБС эндоваскулярное лечение не влияет на прогноз [17] и не во всех случаях влияет на качество жизни [18].
Для повышения эффективности борьбы с ССО целесообразно внести следующие коррективы:
- при наличии факторов риска или при подозрении на наличие ССЗ, обусловленного атеросклерозом, обязательно требуется определить категорию риска;
- при постановке диагноза ИБС следует руководствоваться данными инструментальных методов, подтверждающих наличие ишемии миокарда: перфузионной сцинтиграфии миокарда или стресс-эхокардиографии. Выявлять ИБС при помощи ЭКГ в покое и суточного мониторирования ЭКГ нецелесообразно;
- при выявлении пациентов с СН требуется помимо рентгенографии грудной клетки и проведения эхокардиографии измерять уровень натрийуретического пептида в крови. Это особенно актуально для больных СН с сохраненной фракцией выброса;
- при наличии ССЗ, вызванного атеросклерозом, назначение гиполипидемической терапии обязательно вне зависимости от исходного уровня ЛПНП.
- пациентам с СД2 назначение терапии статинами обязательно вне зависимости от исходного уровня ЛПНП. При выборе противодиабетической терапии следует использовать препараты, снижающие риск ССО;
- следует более широко использовать электрокардиостимуляторы, в т.ч. с функцией кардиовертеров-дефибрилляторов, в тех случаях, когда это соответствует требованиям рекомендаций [19].
Таким образом, введение дополнительной категории риска должно способствовать более пристальному вниманию к пациентам с ЭР, к более жесткому и частому контролю у них показателей липидного профиля, HbA1c, АД. Пациентам этой категории требуется пристальное внимание к коррекции факторов риска и приверженности назначенной терапии, более тщательный инструментальный контроль, в частности проведение дуплексного сканирования экстракраниальных артерий и артерий нижних конечностей. В случае наличия СД целесообразно ведение таких пациентов совместно кардиологом и эндокринологом. Принятие указанной категории риска повысит мотивацию как пациентов, так и их лечащих врачей, что должно способствовать снижению риска развития ССО.



